Основные законы химии презентация кратко
Обновлено: 01.07.2024
Презентация на тему: " Основные законы науки химии. Учитель биологии и химии Учитель биологии и химии МОБУ СОШ ЛГО с. Пантелеймоновка Г. П. Яценко." — Транскрипт:
1 Основные законы науки химии. Учитель биологии и химии Учитель биологии и химии МОБУ СОШ ЛГО с. Пантелеймоновка Г. П. Яценко
3 Атомно – молекулярное учение. Атомно – молекулярное учение. Михаил Васильевич Ломоносов (1711 – 1765) Джон Дальтон (1766 – 1844) Учение создали русский ученый М.В.Ломоносов и английский ученый Дж.Дальтон в 1741 году.
4 Основные положения атомно – молекулярного учения Основные положения атомно – молекулярного учения. 1. Вещества состоят из молекул. Молекула - это наименьшая частица вещества, которая это наименьшая частица вещества, которая сохраняет его химические свойства. сохраняет его химические свойства. 2. Молекулы состоят из атомов. Атом – это наименьшая частица химического элемента, наименьшая частица химического элемента, которая сохраняет его химические свойства. которая сохраняет его химические свойства. Химический элемент – это отдельный вид Химический элемент – это отдельный вид атомов. атомов.
5 3. Вещества, молекулы которых состоят из атомов одного элемента простые вещества. Вещества, одного элемента простые вещества. Вещества, молекулы которых состоят из атомов разных молекулы которых состоят из атомов разных элементов – сложные вещества. элементов – сложные вещества. 4. Молекулы и атомы находятся в непрерывном движении. движении. 5. В результате химических реакций 5. В результате химических реакций молекулы одних веществ превращаются в молекулы одних веществ превращаются в молекулы других веществ. молекулы других веществ.
6 Периодический закон – фундаментальный закон химии. В 1869 году Д. И. Менделеевым был сформулирован Периодический закон. Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов. Дмитрий Иванович Менделеев ( ) ( )
7 Соответствие показателя строения атома с устройством электронных уровней. Общее количество электронов в атоме. Порядковый номер элемента Количество энергетических уровней в атоме Номер периода элемента Количество валентных электронов в атоме Номер группы элемента
8 Закон постоянства состава веществ. Жозеф Луи Пруст (1754 – 1826) Закон был открыт французским ученым в 1808 году для вещества молекулярного строения. Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества. Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества. Первая формулировка закона: От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства.
9 Закон сохранения массы вещества. Антуан Лоран Лавуазье (1743 – 1794) (1743 – 1794) Михаил Васильевич Ломоносов ( ) Закон открыт в 1756 г. М. В. Ломоносовым. В 1789 г. Подтвержден французским химиком А. Лавуазье.
11 Закон Авогадро. Амедео Авогадро (1776 – 1856) (1776 – 1856) В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул. 1 моль газа при T° = 273 К, p = Па занимает объём V = 22,4 литра. В одном моле различных веществ содержится N A = 6,022 х 10²³ молекул ( число Авогадро)
14 Закон кратных отношений. Джон Дальтон ( ) Закон установлен в 1803 году Джоном Дальтоном. Если два простых вещества образуют между собой несколько соединений, то массы одного из них, взаимодействующие с одной и той же массой другого, относятся между собой как небольшие числа.
15 Уравнение Менделеева – Клапейрона. Формула, устанавливающая зависимость между давлением, молярным объемом и абсолютной температурой идеального газа:
16 Закон Бойля – Мариотта. Роберт Бойль ( ) В 1660 году открыл закон изменения объёма газов с изменением давления, который позднее получил название закона Бойля – Мариотта: независимо от Бойля этот закон сформулировал французский физик Эдм Мариотт. Эдм Мариотт
17 Для газа данной массы при постоянной температуре произведение давления газа на его объём постоянно:
18 Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется: V/T = const при p = const Жозеф Луи Гей – Люссак (1778 – 1850) 1802 году был открыт газовый закон.
19 Задачи для закрепления. Задание 1. Вычислите число атомов азота в 100 г карбоната аммония, содержащего 10% не азотистых примесей. Ответ: 1,13 х атомов азота) (Ответ: 1,13 х атомов азота). Задание 2. Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32% воды по массе. (Ответ: FeSO 4 х 7H 2 O). Задание 3. При каком молярном соотношении оксида серы (VI) и аргона получается смесь, которая в два раза тяжелее воздуха? (Ответ: ʋ (SO 2 ): ʋ (Ar) =3:1).
20 png oSq5EUlnTioB7bYfL_Wxg_73M3 jpg jpg rCatdd4Ulnl7PCj1nlOy3QP veshestva.jpg jpg jpg png jpg?cb= jpg jpg nm90MsNRFgRWuN8bvf3TRyEABSR8g

№ слайда 1
ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ДЕПАРТАМЕНТА ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ № 8 ИМЕНИ ДВАЖДЫ ГЕРОЯ СОВЕТСКОГО СОЮЗА И.Ф.ПАВЛОВА (ГАОУ СПО ПК №8 ИМ. И.Ф.ПАВЛОВА)

№ слайда 2
Основные понятия и законы химии

№ слайда 3
Содержание Основные понятия химии…………………………………. 3 Состав веществ. Изменение веществ………………… 8 Основные законы химии. 24 Обозначения, названия и единицы физической величины…………………………………………………………….. 34 Задания. 35

№ слайда 4
Основные понятия химии.

№ слайда 5
Химия – это наука о составе, строении, свойствах и превращениях веществ. Вещество – один из видов материи, который характеризуется массой покоя. Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.
№ слайда 6
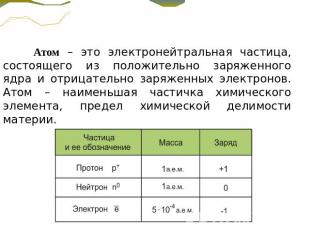
Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом – наименьшая частичка химического элемента, предел химической делимости материи.

№ слайда 7
Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких элементов, которая определяет химические свойства вещества.

№ слайда 8
Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Вещества, образованные одним химическим элементом, называют простыми. Один и тот же химический элемент может образовывать несколько простых веществ. Это явление называют аллотропией, а различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями.

№ слайда 9
Состав веществ. Изменение веществ.
№ слайда 10
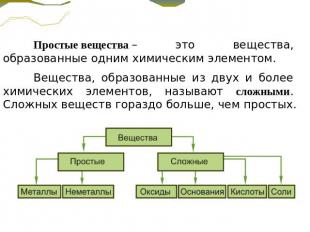
Простые вещества – это вещества, образованные одним химическим элементом. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.

№ слайда 11
Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество. Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.

№ слайда 12
Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.

№ слайда 13
Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.

№ слайда 14
Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу. Посмотреть видеоролик.

№ слайда 15
Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.

№ слайда 16
Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество. Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру. Графическая формула отражает порядок соединения атомов, т. е. связи между ними. Посмотреть видеоролик получения формулы по названию

№ слайда 17
Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода : Единая углеродная атомная единица массы (а. е. м.) равна:

№ слайда 18
Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса ( ) равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.
№ слайда 19
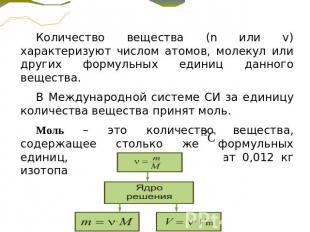
Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В Международной системе СИ за единицу количества вещества принят моль. Моль – это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода .

№ слайда 20
№ слайда 21
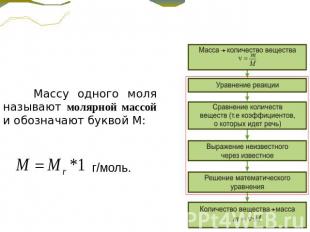
Массу одного моля называют молярной массой и обозначают буквой М:

№ слайда 22

№ слайда 23
Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( ) и массу ( ) отдельной молекулы (или атома): Массу молекулы (атома) в килограммах можно рассчитать по уравнению следовательно

№ слайда 24
Из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое называют постоянной Авогадро. Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества; она всегда равна

№ слайда 25
Основные законы химии

№ слайда 26
Закон сохранения массы. Был открыт М. В. Ломоносовым и сформулирован А. Лавуазье: Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Этот закон является одним из основных стехиометрических законов химии. Посмотреть видеоролик.

№ слайда 27
Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения между реагирующими веществами, вывод химических формул и составление уравнений химических реакций.

№ слайда 28
Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Однако уже в начале XIX в. К. Бертолле показал, что элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.

№ слайда 29
Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным независимо от способа их получения. Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения.

№ слайда 30
Вещества постоянного состава называют дальтонидами в честь английского физика и химика Дж. Дальтона, а вещества переменного состава – бертоллидами в честь французского химика К. Бертолле. Посмотреть видеоролик.

№ слайда 31
Закон Авогадро. Сформулирован А. Авогадро в результате проведения многочисленных экспериментов: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.

№ слайда 32
Из закона Авогадро вытекают 2 следствия: Один моль любого газа при одинаковых условиях занимает один и тот же объем. Этот объем, называемый молярным ( ), при нормальных условиях (давление = 101325 Па и абсолютной температуре = 273,15 К) равен 22,4 л:

№ слайда 33
Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные массы Отношение масс двух газов, занимающих равный объем при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D.

№ слайда 34
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). где p – давление; V – объем газа; m – масса газа; М – молярная масса газа; Т – температура; n – количество вещества газа, моль; R – универсальная газовая постоянная, значение которой зависит от единиц, в которых измеряют давление и объем.

№ слайда 35
Основные законы химии

№ слайда 36
Задания Найдите относительные молекулярные массы веществ, состав которых описывается формулами: Рассчитайте относительные молекулярные массы медного купороса и кристаллической соды

№ слайда 37
Сколько молекул содержится в 32 г сернистого газа ? Какова масса молекул аммиака ? Какова масса 5,6 (н. у.) углекислого газа? Сколько молекул содержится в этом объеме газа? Каков объем 128 г сернистого газа при нормальных условиях? Сколько молекул содержится в 128 г этого газа? Найдите массу кислорода, содержащегося в баллоне объемом 50 л при температуре и давлении 790 кПа.

№ слайда 38
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:

Основные понятия химии.

Состав веществ. Изменение веществ.

Химия – это наука о составе, строении, свойствах и превращениях веществ. Вещество – один из видов материи, который характеризуется массой покоя. Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.

Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом – наименьшая частичка химического элемента, предел химической делимости материи.

Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких элементов, которая определяет химические свойства вещества.

Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Вещества, образованные одним химическим элементом, называют простыми. Один и тот же химический элемент может образовывать несколько простых веществ. Это явление называют аллотропией, а различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями.

Простые вещества – это вещества, образованные одним химическим элементом. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.

Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество. Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.

Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.

Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.

Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу. Посмотреть видеоролик.

Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это способность атомов одного химического элемента соединятся со строго определенным числом атомов другого химического элемента.

Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество. Молекулярная (истинная) формула показывает качественный состав и число составляющих вещество частиц, но не показывает порядок связей частиц в веществе, т. е. его структуру. Графическая формула отражает порядок соединения атомов, т. е. связи между ними. Посмотреть видеоролик получения формулы по названию

Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода : Единая углеродная атомная единица массы (а. е. м.) равна: 1 а. е. м. = кг.

Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса ( ) равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.

Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В Международной системе СИ за единицу количества вещества принят моль. Моль – это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода .


Массу одного моля называют молярной массой и обозначают буквой М: г/моль.


Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( ) и массу ( ) отдельной молекулы (или атома): Массу молекулы (атома) в килограммах можно рассчитать по уравнению следовательно (кг/моль) (кг/моль) =

Из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое называют постоянной Авогадро. Постоянная Авогадро ( ) – число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества; она всегда равна

Основные законы химии

Закон сохранения массы. Был открыт М. В. Ломоносовым и сформулирован А. Лавуазье: Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. Этот закон является одним из основных стехиометрических законов химии. Посмотреть видеоролик.

Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения между реагирующими веществами, вывод химических формул и составление уравнений химических реакций.

Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Однако уже в начале XIX в. К. Бертолле показал, что элементы могут соединятся друг с другом в разных соотношениях в зависимости от массы реагирующих веществ.

Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным независимо от способа их получения. Состав соединений немолекулярной структуры (с атомной, ионной или металлической кристаллической решеткой) не является постоянным и зависит от способа их получения.

Вещества постоянного состава называют дальтонидами в честь английского физика и химика Дж. Дальтона, а вещества переменного состава – бертоллидами в честь французского химика К. Бертолле. Посмотреть видеоролик.

Закон Авогадро. Сформулирован А. Авогадро в результате проведения многочисленных экспериментов: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.

Из закона Авогадро вытекают 2 следствия: Один моль любого газа при одинаковых условиях занимает один и тот же объем. Этот объем, называемый молярным ( ), при нормальных условиях (давление = 101325 Па и абсолютной температуре = 273,15 К) равен 22,4 л:

Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные массы Отношение масс двух газов, занимающих равный объем при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D.

Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). или где p – давление; V – объем газа; m – масса газа; М – молярная масса газа; Т – температура; n – количество вещества газа, моль; R – универсальная газовая постоянная, значение которой зависит от единиц, в которых измеряют давление и объем.

Сколько молекул содержится в 32 г сернистого газа ? Какова масса молекул аммиака ? Какова масса 5,6 (н. у.) углекислого газа? Сколько молекул содержится в этом объеме газа? Каков объем 128 г сернистого газа при нормальных условиях? Сколько молекул содержится в 128 г этого газа? Найдите массу кислорода, содержащегося в баллоне объемом 50 л при температуре и давлении 790 кПа.





- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 29 человек из 18 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дистанционные курсы для педагогов
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 611 977 материалов в базе
Материал подходит для УМК
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 09.02.2020 1578
- PPTX 4.3 мбайт
- 152 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Уразова Динара Куанышевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Онлайн-тренинг: нейрогимнастика для успешной учёбы и комфортной жизни
Время чтения: 2 минуты
Россияне ценят в учителях образованность, любовь и доброжелательность к детям
Время чтения: 2 минуты
Новые курсы: преподавание блогинга и архитектуры, подготовка аспирантов и другие
Время чтения: 16 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
ТЕМА 1. Важнейшие химические понятия и законы Урок 1. Атом, Химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии.
Урок 1. 1. Что изучает химия? Химия – это наука о веществах, их свойствах и превращениях веществ.
Урок 1. 2. Что называют атомом и молекулой? Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра и электронов Молекула - наименьшая частица вещества, обладающая всеми его свойствами.
Урок 1. 3. Что такое абсолютная и относительная атомная и молекулярная массы?
Урок 1 Относительная атомная масса (см. атомная масса химического элемента) А r Относительная молекулярная масса ( сумма относительных атомных масс всех атомов, образующих молекулу вещества) Mr КОЛИЧЕСТВО ВЕЩЕСТВА – число атомов, молекул или других формульных единиц вещества ( моль)
УРОК 1 Молярная масса – масса 1 моль вещества (г моль, кг моль) М Молярный объем – объем 1 моль газа при н.у. V m = 22,4 л/моль
УРОК 1 1.Какое количество вещества ( моль) содержит 12,04 · 10 ²³ атомов натрия? 2.Какова масса 2 моль азота? 3.Какой объем занимают 1,5 моль кислорода? 4.Какова масса 3 литров гелия?
1. n = N/ Na = 12, 04 · 10 ²³ / 6,02 · 10²³ = 2 моль 2 . m = n · M ( N₂ ) = 2 моль · 28 г/ моль = 56 г . 3 . V= n · Vm = 1,5 моль · 22,4 л/моль = 33,6 л. 4. m= n · M = V/Vm · M(He)= 3 л ./ 22,4л/моль · 4г/моль = = 0,54 г.
Урок 1. 4. Основные положения атомно-молекулярного учения. Атомно-молекулярное теория базируется на следующих законах и утверждениях: Все вещества состоят из атомов Атомы одного химического вещества ( химический элемент ) обладают одинаковыми свойствами, но отличаются от атомов другого вещества При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества ) При физических явлениях молекулы не изменяются, при химических происходит изменение их состава Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
Урок 1. 5.Строение атома. Ядро : протоны и нейтроны Электроны
Урок 1. 6. Химический элемент, изотопы. Химический элемент – совокупность атомов с одинаковым зарядом ядра ( числом протонов). Изотопы - разновидность атомов одного химического элемента с разным числом нейтронов в ядре.
Урок 1 - Каков порядковый номер калия? - Сколько протонов в его ядре? - Сколько электронов в атоме калия? - Сколько нейтронов в ядре калия? - Чему равно массовое число атома калия? № = 19 р = 19 е = 19 n = 20 Ar(K) = 39
Урок 1 7.Вещество. Это вид материи; физическая субстанция со специфи- ческими химическими свойствами.
8. Простые и сложные вещества
ТЕСТЫ мельчайшая химически неделимая электронейтраль- ная частица вещества виды элементарных частиц? что называют массовым числом? вид атомов с одинаковым зарядом ядра? разновидность атомов с одинаковым зарядом ядра, но разной массой?
ТЕСТЫ Найдите соответствие : Химический элемент А) состоит из атомов одного вида, обладает 2. Простое вещество постоянными физическими свойствами 3. Сложное вещество Б) состоит из атомов разных видов, имеет 4. Смесь постоянные свойства В) состоит из разных веществ, которые отличаются по свойствам Г) один вид атомов, физические свойства которого обычно не характеризуются Только сложные вещества перечислены в ряду : воздух, вода, кислород 2) серная кислота, водород, озон 3) поваренная соль, вода, сероводород 4) кислород, азот, хлор Только простые вещества перечислены в ряду: 1) железо, кислород, соляная кислота 2) оксид натрия, вода, азот 3) фтор, кислород, сера 4) углерод, вода, сера ОТВЕТ: 1 – Г; 2 - А; 3 – Б; 4 - В ОТВЕТ: 1 - 3 ОТВЕТ: 3
Урок 1 Закон постоянства состава вещества: каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
Читайте также:

