Основные способы получения кислот кратко
Обновлено: 16.05.2024
Кислотам дали такое название не просто так. Большинство из них имеют кислый вкус. С некоторыми из них знаком каждый из вас. Это, например, уксусная кислота, которая есть в каждом доме, аскорбиновая кислота (она же витамин C), лимонная кислота и т.д. Но не стоит все кислоты пробовать на вкус. Кислоты являются очень едкими веществами. Даже всем нам привычная и известная аскорбиновая кислота в большой концентрации будет вредна нашему организму. А от более сильных кислот — серной, соляной и даже уксусной — можно получить очень сильные ожоги, вплоть до летального исхода. Поэтому при работе с кислотами нужно быть осторожными, а также соблюдать технику безопасности.
Таблица названий некоторых кислот и их солей
| Название кислоты | Формула | Название соли |
|---|---|---|
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | CH3COOH | Ацетат |
Классификация кислот
| По содержанию кислорода | |
|---|---|
| Кислородсодержащие (H2SO4) | Бескислородные (HCl) |
| По количеству содержащихся катионов водорода (H+) | ||
|---|---|---|
| Одноосновные (HCl) | Двухосновные (H2SO4) | Трёхосновные (H3PO4) |
| По растворимости (в воде) | |
|---|---|
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
| По силе (степени диссоциации) | |
|---|---|
| Сильные (H2SO4) | Слабые (CH3COOH) |
| По летучести | |
|---|---|
| Летучие (H2S) | Нелетучие (H2SO4) |
| По устойчивости | |
|---|---|
| Устойчивые (H2SO4) | Неустойчивые (H2CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
Химические свойства кислот
- Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
H2SO4 + 2Na → Na2SO4 + H2↑
Металлы, находящиеся в ряду активности после водорода, не вступают в реакцию с кислотой (кроме концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
- Взаимодействуют с оксидами основных и амфотерных металлов с образованием солей и воды:
H2SO4 + MgO → MgSO4 + H2O
- С основаниями, с образованием солей и воды (так называемая реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + H2O
- Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2↑
- Сильные кислоты могут вытеснять из солей более слабые кислоты:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Получение кислот
H2O + SO3 →H2SO4
H2 + Cl2 → 2HCl
- Вытеснение слабой кислоты из солей, более сильной кислотой:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
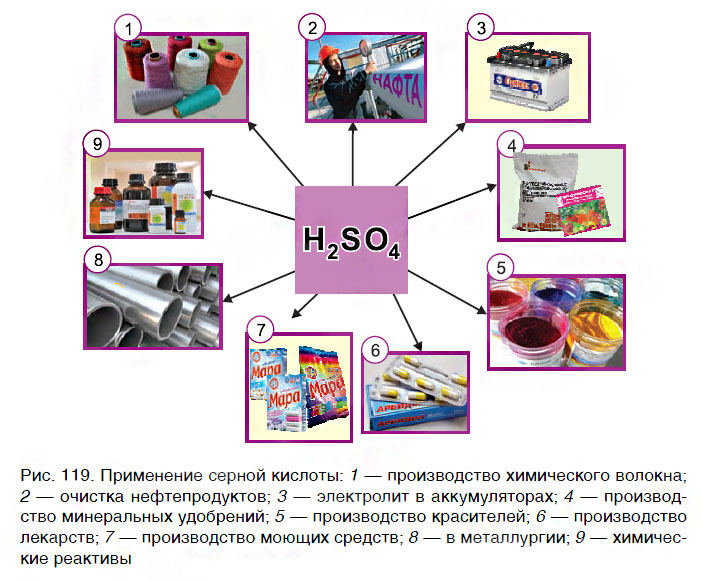
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.

Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).
1. Бескислородные кислоты получают при растворении в воде газообразных соединений неметаллов с водородом.
Так, например, соляная кислота образуется в результате растворения газа хлороводорода HCl в воде, а сероводородная кислота образуется при растворении газа сероводорода H 2 S в воде. Сами же упомянутые газообразные соединения можно получить в реакциях соединения водорода с соответствующими неметаллами:
2. Кислородсодержащие кислоты можно получить взаимодействием соответствующих кислотных оксидов с водой:
3. Кислоты можно получить из соответствующих солей. Реакции обмена протекают в соответствии с вытеснительным рядом кислот.
Например, соляная кислота вытесняет уксусную из растворов её солей, а фосфорная кислота может быть вытеснена серной:
C H 3 COONa + HCl → C H 3 COOH + NaCl , Ca 3 ( P O 4 ) 2 + 3 H 2 S O 4 → 2 H 3 P O 4 + 3 CaS O 4 .

Получение кислот
Для получения неорганических кислот используют реакции разных типов. Рассмотрим важнейшие из них.
Взаимодействие некоторых простых веществне — металлов с водородом
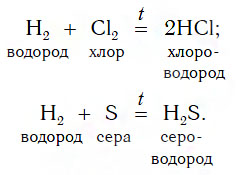
Образующиеся газообразные продукты реакций — HCl и H2S — растворяют в воде и получают соответствующие бескислородные кислоты — хлороводородную и сероводородную. Таким же образом можно получить и бромоводородную кислоту — раствор газа бромоводорода HBr в воде. К какому типу относятся рассмотренные реакции получения HCl и H2S?
Взаимодействие серной кислоты с твердыми солями
Этот способ основан на том, что нелетучая серная кислота H2SO4 при нагревании вытесняет летучие кислоты — HCl и HNO3— из их солей. Поэтому хлороводородную кислоту можно получить, нагревая смесь ее соли — твердого хлорида натрия с серной кислотой:
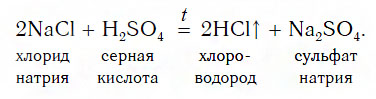
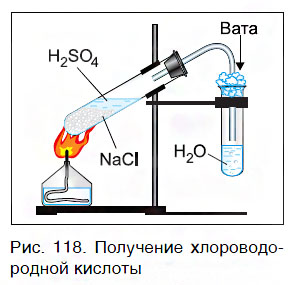
Для получения азотной кислоты нагревают смесь ее соли — нитрата натрия NaNO3 — с серной кислотой:
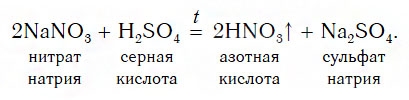
Пары азотной кислоты, образующиеся в результате этой реакции, охлаждают до комнатной температуры, и она переходит в жидкое состояние.
Взаимодействие кислотных оксидов с водой
Вы уже знаете, что кислотные оксиды, кроме SiO2, реагируют с водой. Это их свойство используют для получения некоторых кислородсодержащих кислот, например серной и фосфорной:
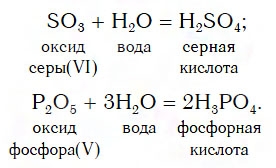
Поскольку оксид кремния SiO2 с водой не реагирует, то соответствующую ему кислоту H2SiO3 получают другими способами.
Применение кислот
Кислоты широко используются практически во всех сферах деятельности человека — в быту, в различных отраслях промышленности, в медицине. Наибольшее применение находит серная кислота (рис. 119). Так как кислоты оказывают разрушающее действие на кожу, бумагу, ткани, обращаться с ними следует осторожно, соблюдая правила безопасности.
Краткие выводы урока:
- Для получения кислот используют реакции: водорода с некоторыми простыми веществами (хлор и сера); кислотных оксидов с водой; солей с кислотами.
- Кислоты находят широкое применение в промышленности и в быту.
- Кислоты — едкие вещества, обращаться с которыми следует осторожно.
Кислоты - это сложные химические вещества, которые содержат атомы водорода, способные замещаться на атомы металлов и образовывать соли.

Кислоты различаются по основности: Основность определяется количеством атомов водорода, входящим в их состав. Например, серная - H2SO4 - двухосновная, так как в её состав входит 2 атома водорода.
Кислоты разделяют также на кислородосодержащие и не содержащие кислород. Например, соляная - HCl - не содержит атомов кислорода, а H2СO3 - угольная - содержит 3 атома кислорода и является кислородосодержащей.
Теперь разберём подробнее свойства кислот и их химическое взаимодействие c простыми и сложными веществами.
Основные химические свойства кислот:
H2SO4 +Zn → ZnSO4 + H2 - Образуется соль и выделяется водород
В зависимости от концентрации самой кислоты получаются различные продукты химической реакции. Например,
2H2SO4 + Cu → CuSO4 + SO2 +2H2O - в этом случае серная кислота - концентрированная. Разбавленная - на медь (Cu) никак не действует.
CuO + H2SO4 → CuSO4 + H2O - образуется соль и вода;
SnO + HCl → SnCl2 + H2O (оксид олова - SnO - амфотерный оксид)
- взаимодействие с основаниями и щелочами:
HCl + KOH → KCl + H2O - эту реакцию ещё называют реакцией нейтрализации - образуется соль и вода;
- взаимодействие с солью:
При химических реакциях кислот с солью обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т.д.
N2CO3 + 2HCl → 2NaCl + CO2 + H2O - выделяется углекислый газ CO2. Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду. При этих реакциях образуется соль и другая кислота (более слабая, чем та, которая вступала в реакцию).
Теперь рассмотрим основным способы получения кислот
Получение кислот
Получение кислот производят с помощью следующих химических реакций:
- при взаимодействии кислотных оксидов с водой:
- при взаимодействии кислоты с солью:
NaCl + H2SO4(конц.) → HCl + Na2SO4 - при этой химической реакции образуется новая более слабая кислота (более слабая, чем серная, но тоже сильная) и другая соль;
- при взаимодействии неметаллов с водородом с последующим растворением их в воде:
H2 + Cl2 → HCl (Надо помнить, что само по себе данное химическое соединение - газ хлороводород HCl кислотой не является. Для её образования необходимо полученный газ HCl растворить в воде). Аналогичным образом поступают с газом сероводородом:
- при окислении некоторых простых веществ:
P + 5HNO3 +2H2O → 3H3PO4 + 5NO (в этой химической реакции происходит окисление фосфора (P) азотной кислотой (HNO3) до ортофосфорной кислоты (H3PO4) с выделением оксида азота (NO)

Перейти на английский
Properties of acids
Getting acids
Читайте также:

