Метод валентных связей и метод молекулярных орбиталей кратко
Обновлено: 05.07.2024
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на следующих правилах.
1. При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные.
2. Число полученных молекулярных орбиталей равно числу исходных атомных.
3. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
4. При перекрывании атомных орбиталей возможно образование и -связи (перекрывание по оси химической связи), и -связи (перекрывание по обе стороны от оси химической связи).
5. Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8. Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Применим метод МО ЛКАО и разберем строение молекулы водорода. Изобразим на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов водорода (рис. 3.5).
Рис. 3.5.
Энергетическая диаграмма
несвязанных атомов водорода
Далее мысленно перекроем две атомные орбитали, образовав две молекулярные, одна из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая (разрыхляющая) – большей энергией (расположена выше) (рис. 3.6.).
Рис. 3.6.
Диаграмма уровней энергии АО
атомов H и МО молекулы H2
Видно, что имеется выигрыш в энергии по сравнению с несвязанными атомами. Свою энергию понизили оба электрона, что соответствует единице валентности в методе валентных связей (связь образуется парой электронов).
Метод МО ЛКАО позволяет наглядно объяснить образование ионов и , что вызывает трудности в методе валентных связей. На -связывающую молекулярную орбиталь катиона переходит один электрон атома H с выигрышем энергии (рис. 3.7).
Рис. 3.7.
Энергетическая диаграмма образования
катиона молекулы H2 по методу МО ЛКАО
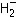
В анионе на двух молекулярных орбиталях необходимо разместить уже три электрона (рис. 3.8).
Рис. 3.8.
Энергетическая диаграмма образования
аниона молекулы H2 по методу МО ЛКАО
Если два электрона, опустившись на связывающую орбиталь, дают выигрыш в энергии, то третьему электрону приходится повысить свою энергию. Однако энергия, выигранная двумя электронами, больше, чем проигранная одним. Такая частица может существовать.
Известно, что щелочные металлы в газообразном состоянии существуют в виде двухатомных молекул. Попробуем убедиться в возможности существования двухатомной молекулы Li2, используя метод МО ЛКАО. Исходный атом лития содержит электроны на двух энергетических уровнях – первом и втором (1s и 2s) (рис. 3.9).
Рис. 3.9.
Энергетическая диаграмма образования
двухатомной молекулы Li2 по методу
МО ЛКАО
Перекрывание одинаковых 1s-орбиталей атомов лития даст две молекулярные орбитали (связывающую и разрыхляющую), которые согласно принципу минимума энергии будут полностью заселены четырьмя электронами. Выигрыш в энергии, получаемый в результате перехода двух электронов на связывающую молекулярную орбиталь, не способен компенсировать ее потери при переходе двух других электронов на разрыхляющую молекулярную орбиталь. Вот почему вклад в образование химической связи между атомами лития вносят лишь электроны внешнего (валентного) электронного слоя.
Перекрывание валентных 2s-орбиталей атомов лития приведет также к образованию одной
-связывающей и одной разрыхляющей молекулярных орбиталей. Два внешних электрона займут связывающую орбиталь, обеспечивая общий выигрыш в энергии (кратность связи равна 1).
Используя метод МО ЛКАО, рассмотрим возможность образования молекулы He2 (рис. 3.10).
Рис. 3.10.
Энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО невозможность образования химической связи между атомами He
В этом случае два электрона займут связывающую молекулярную орбиталь, а два других – разрыхляющую. Выигрыша в энергии такое заселение двух орбиталей электронами не принесет. Следовательно, молекулы He2 не существует.
Методом МО ЛКАО легко продемонстрировать парамагнитные свойства молекулы кислорода. С тем чтобы не загромождать рисунок, не будем рассматривать перекрывание 1s-орбиталей атомов кислорода первого (внутреннего) электронного слоя. Учтем, что p-орбитали второго (внешнего) электронного слоя могут перекрываться двумя способами. Одна из них перекроется с аналогичной с образованием -связи (рис. 3.11).
Рис. 3.11.
Перекрывание p-АО, направленных вдоль оси x -связи
Две других p-АО перекроются по обе стороны от оси x с образованием двух -связей (рис. 3.12).
Рис. 3.12.
Перекрывание p-АО, направленных
вдоль оси y (z), с образованием -связи
Энергии сконструированных молекулярных орбиталей могут быть определены по данным спектров поглощения веществ в ультрафиолетовой области. Так, среди молекулярных орбиталей молекулы кислорода, образовавшихся в результате перекрывания p-АО, две -связывающие вырожденные (с одинаковой энергией) орбитали обладают меньшей энергией, чем -связывающая, впрочем, как и *-разрыхляющие орбитали обладают меньшей энергией в сравнении с *-разрыхляющей орбиталью (рис. 3.13).
Рис. 3.13.
Энергетическая диаграмма,
иллюстрирующая с помощью метода МО ЛКАО
парамагнитные свойства молекулы O2
В молекуле O2 два электрона с параллельными спинами оказались на двух вырожденных (с одинаковой энергией) *-разрыхляющих молекулярных орбиталях. Именно наличием неспаренных электронов и обусловлены парамагнитные свойства молекулы кислорода, которые станут заметными, если охладить кислород до жидкого состояния.
Среди двухатомных молекул одной из наиболее прочных является молекула CO. Метод МО ЛКАО легко позволяет объяснить этот факт (рис. 3.14, см. с. 18).
Рис. 3.14.
Энергетическая диаграмма, иллюстрирующая
с помощью метода МО ЛКАО особую прочность
химической связи в молекуле CO
Результатом перекрывания p-орбиталей атомов O и C является образование двух вырожденных
-связывающих и одной -связывающей орбитали. Эти молекулярные орбитали займут шесть электронов. Следовательно, кратность связи равна трем.
Метод МО ЛКАО можно использовать не только для двухатомных молекул, но и для многоатомных. Разберем в качестве примера в рамках данного метода строение молекулы аммиака (рис. 3.15).
Рис. 3.15.
Энергетическая диаграмма образования молекулы
NH3 по методу МО ЛКАО
Поскольку три атома водорода имеют только три 1s-орбитали, то суммарное число образованных молекулярных орбиталей будет равно шести (три связывающих и три разрыхляющих). Два электрона атома азота окажутся на несвязывающей молекулярной орбитали (неподеленная электронная пара).
Когда говорят о формах молекул, прежде всего имеют в виду взаимное расположение в пространстве ядер атомов. О форме молекулы имеет смысл говорить, когда молекула состоит из трех и более атомов (два ядра всегда находятся на одной прямой). Форма молекул определяется на основе теории отталкивания валентных (внешних) электронных пар. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально (принцип минимума энергии). При этом необходимо иметь в виду следующие утверждения теории отталкивания.
1. Наибольшее отталкивание претерпевают неподеленные электронные пары.
2. Несколько меньше отталкивание между неподеленной парой и парой, участвующей в образовании связи.
3. Наименьшее отталкивание между электронными парами, участвующими в образовании связи. Но и этого бывает недостаточно, чтобы развести ядра атомов, участвующих в образовании химических связей, на максимальный угол.
В качестве примера рассмотрим формы водородных соединений элементов второго периода: BeH2, BH3, CH4, C2H4, C2H2, NH3, H2O.
Начнем с определения формы молекулы BeH2. Изобразим ее электронную формулу:
H:Be:H,
из которой ясно, что в молекуле отсутствуют неподеленные электронные пары. Следовательно, для электронных пар, связывающих атомы, есть возможность оттолкнуться на максимальное расстояние, при котором все три атома находятся на одной прямой, т.е. угол HBeH составляет 180°.
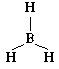
Молекула BH3 состоит из четырех атомов. Согласно ее электронной формуле в ней отсутствуют неподеленные пары электронов:
Молекула приобретет такую форму, при которой расстояние между всеми связями максимально, а угол между ними равен 120°. Все четыре атома окажутся в одной плоскости – молекула плоская:
Электронная формула молекулы метана выглядит следующим образом:
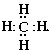
Все атомы данной молекулы не могут оказаться в одной плоскости. В таком случае угол между связями равнялся бы 90°. Есть более оптимальное (с энергетической точки зрения) размещение атомов – тетраэдрическое. Угол между связями в этом случае равен 109°28'.
Электронная формула этена имеет вид:
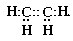
Естественно, все углы между химическими связями принимают максимальное значение – 120°.
Очевидно, что в молекуле ацетилена все атомы должны находиться на одной прямой:
H:C. C:H.
Отличие молекулы аммиака NH3 от всех предшествующих состоит в наличии в ней неподеленной пары электронов у атома азота:
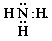
Как уже указывалось, от неподеленной электронной пары более сильно отталкиваются электронные пары, участвующие в образовании связи. Неподеленная пара располагается симметрично относительно атомов водорода в молекуле аммиака:
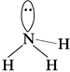
Угол HNH меньше, чем угол HCH в молекуле метана (вследствие более сильного электронного отталкивания).
В молекуле воды неподеленных пар уже две:
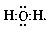
Этим обусловлена уголковая форма молекулы:
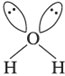
Как следствие более сильного отталкивания неподеленных электронных пар, угол HOH еще меньше, чем угол HNH в молекуле аммиака.
Приведенные примеры достаточно наглядно демонстрируют возможности теории отталкивания валентных электронных пар. Она позволяет сравнительно легко предсказывать формы многих как неорганических, так и органических молекул.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).
Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются s s. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Процесс образования частицы H2 + можно представить следующим образом:
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2 + равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s) 2 ]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2 — имеет электронную конфигурацию:
H2 — [(σ 1s) 2 (σ *1s) 1 ]
Кратность связи в H2 — составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s) 2 ]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s 2 ) Ве2 [KK*(σ 2s) 2 (σ *2s) 2 ]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s) 2 (π *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 ]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2 + и O2 — . В ионе O2 + на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
Кратность связи в ионе О2 + равна (8–3):2 = 2,5. В ионе O2 — на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
Кратность связи в ионе О2 — равна (8 – 5):2 = 1,5. Ионы О2 — и О2 + являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2 — , О2, О2 + кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO + , CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 (π*2px) 1 ] или
NO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 (π*2py) 1 ]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO — :
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO + имеет следующее электронное строение:
NO + [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO + равна трём.
В ряду NO — , NO, NO + избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF + ; NF — ; NF.
Энергия химической связи уменьшается в ряду:
NF + ; NF; NF — .
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO — ; CO; CO + .
Энергия химической связи увеличивается в ряду:
CO + ; CO; CO — .
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2 + ; Be2; Be2 + .
Молекулы He2 и Be2 не существуют, так как по методу МО они имеют нулевую кратность связи.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
B2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 1 (π2py) 1 ].
Кратность связи в B2 составляет (4–2):2=1.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
N2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ].
Кратность связи в N2 составляет (8–2):2=3.
6. Используя метод МО, определите кратность связи в молекуле С2.
Электроны располагаются на молекулярных орбиталях следующим образом:
С2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 ].
Кратность связи в С2 составляет (6–2):2=2.
7. На основе метода МО объясните, почему не существует молекулы Ne2.
Электроны располагаются на молекулярных орбиталях следующим образом:
Ne2 [KK*(σ 2s) 2 (σ *2s) 2 (σ 2pz) 2 (π2px) 2 (π2py) 2 (π*2px) 2 (π*2py) 2 (σ* 2pz) 2 ].
Кратность связи в Ne2 составляет (8–8):2=0.
Нулевая кратность связи объясняет тот факт, что данная молекула не существует.
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2 — .
Электроны располагаются на молекулярных орбиталях следующим образом:
N2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ];
N2 — [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 (π*2px) 1 ].
Кратность связи в N2 составляет (8–2):2=3;
Кратность связи в N2 — составляет (8–3):2=2,5.
Уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2 —
связано с уменьшением кратности связи.
9. Распределите электроны на молекулярных орбиталях для иона CN — . Определите кратность связи в этом ионе.
CN — [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ].
Кратность связи в CN — составляет (8–2):2=3.
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN + , CN, CN — .
Электроны располагаются на молекулярных орбиталях следующим образом:
CN + [KK*(σ2s) 2 (σ*2s 2 (π2p x ) 2 (π2p y ) 2 ];
CN [KK*(σ2s) 2 (σ*2s) 2 (π2p x ) 2 (π2p y ) 2 (σ2p z ) 1 ];
CN — [KK*(σ2s) 2 (σ*2s) 2 (π2p x ) 2 (π2p y ) 2 (σ2p z ) 2 ].
Избыток связывающих электронов в CN + , CN, CN — соответственно составляет 4, 5, 6.
Увеличение избытка связывающих электронов приводит к увеличению энергии связи
(прочности связи). При переходе от CN + к CN — длина связи уменьшается,
что обусловлено усилением прочности связи.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Образование сигма-, пи- и дельта-связей
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи.
Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью.
Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:

Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Взаимное перекрывание облаков, т.е. образование связи может происходить разными способами, ввиду их различной формы. Различают σ-, π- и δ-связи.
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.

σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Направленность ковалентной связи
- При образовании связи с помощью s — орбиталей, ввиду их сферической формы, не возникает какого-либо преимущественного направления в пространстве, для наиболее выгодного образования ковалентных связей.
- В случае же р – орбиталей, электронная плотность распределена неравномерно, поэтому возникает определенное направление, по которому образование ковалентной связи наиболее вероятно.
Гибридизация атомных орбиталей
Рассмотрим пример. Представим, что четыре атома водорода соединились с атомом углерода и образовалась молекула метана CH4.
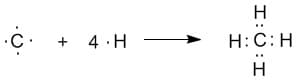
Рисунок показывает что происходит, но не объясняет, как ведут себя s- и р— орбитали, при образовании таких соединений.
Хотя р— орбиталь имеет две части, развернутые друг относительно друга, но она может образовывать только одну связь. В итоге, можно предположить, что в молекуле метана один атом водорода присоединяется к 2s- орбитали углерода, остальные – к 2р— орбитали.
Тогда, каждый атом водорода будет находиться по отношению к другому под углом 90°, но это не так. Электроны отталкиваются друг от друга и расходятся на большее расстояние.
Что же на самом деле происходит?
Происходит гибридизация атомных орбиталей, в результате которой все орбитали объединяются, перестраиваются и образуют 4 эквивалентные гибридные орбитали, которые направлены к вершинам тетраэдра.
Гибридизация — это смешение различных атомных орбиталей (например, s и p) и образование одинаковых по форме и энергии гибридных орбиталей (например, sp, sp 2 , sp 3 ).
Типы гибридизации атомных орбиталей
sp 3 -гибридизация
В нашем примере, каждая из гибридных орбиталей содержит некий вклад 2s- орбитали и некоторые вклады 2р— орбиталей.
Поскольку 4 гибридные орбитали образованы одной 2s— и тремя 2р— орбиталями, то такой способ гибридизации называют sp 3 -гибридизацией.

sp 3 -гибридизация орбиталей в молекуле метана
Как видно из рисунка, конфигурация гибридных орбиталей позволяет четырем атомам вдорода образовать ковалентные связи с атомом углерода, при этом орбитали будут располагаться относительно друг друга под углом 109,5°.
Такой же тип гибридизации присутствует в таких молекулах, как , например, NH3, H2O.
На одной из sp 3 -гибридных орбиталей, в молекуле NH3, находится неподеленная электронная пара, а три остальные орбитали используются для соединения с атомами водорода.
В молекуле H2O неподеленными электронными парами заняты две гибридные орбитали атома кислорода, а две другие используются для связывания с атомами водорода.

Гибридизация орбиталей молекул метана, аммиака, воды
sp 2 -гибридизация
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь. Например, в молекуле этилена связь реализуется следующим образом:
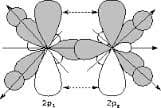
sp 2 -гибридизация атомов этилена
Плоское расположение трех связей вокруг каждого атома углерода дает основание предположить, что в данном случае имеет место sp 2 -гибридизация ( гибридные орбитали образованы одной 2s- и двумя 2р— орбиталями). При этом одна 2р— орбиталь остается неиспользованной (негибридной).
Орбитали будут располагаться относительно друг друга под углом 120°.
sp-гибридизация
Таким же образом, в молекуле ацетилена образуется тройная связь. В данном случае происходит sp-гибридизация атомов, т.е. гибридные орбитали образованы одной 2s- и одной 2р— орбиталями, а другие две 2р— орбитали являются негибридными.
Орбитали располагаются относительно друг друга под углом 180°
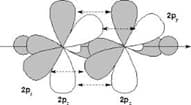
sp-гибридизация атомов ацетилена
Ниже в таблице приведены примеры гибридных орбиталей, их геометрическое расположение .
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp 2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp 3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4 — , TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp 2 d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4] 2 — |
| s,p,p,p,d | sp 3 d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp 3 d 2 | Октаэдрическое (угол 90°) | SF6, Fe(CN)6 3- , CoF6 3- |
Гибридные орбитали в пространстве располагаются различным образом:

Пространственное расположение гибридных орбиталей различных типов
Для объяснения структуры и магнитных свойств молекул (в том числе и комплексных соединений) были разработаны несколько теорий, основные из них:
- метод валентных связей (МВС);
- теория электрического кристаллического поля (ТЭКП);
- теория молекулярных орбиталей (ТМО).
Метод валентных связей
- Единичную химическую связь образуют два электрона с противоположными спинами, принадлежащими двум атомам. При этом происходит перекрывание волновых функций электронов и между атомами возникает зона со значительной электронной плотностью, что приводит к уменьшению потенциальной энергии системы, т.е. к образованию связи.
- Связь располагается в том направлении, в котором возможность перекрывания волновых функций электронов, образующих связь, наибольшая. Это означает, что угол между связями в молекулах должен быть близок к углу между образующими связи электронными облаками.
- Из двух орбиталей атома более прочную связь образует та, которая сильнее перекрывается орбиталью другого атома.
Теория электрического кристаллического поля
основана на электростатической модели, первоначально она была разработана для объяснения состояния ионов в кристаллах, затем была перенесена на комплексные соединения и рассматривает изменения в электронных оболочках иона-комплексообразователя, происходящие под действием лигандов.
Каждая из указанных теорий имеет ограничения, так, например, при объяснении механизма образования связи в комплексах (таких как: [Со(NH3)6] 3+ и [СоF6] 3- ) МВС предполагает, что координационная связь ковалентна, ТЭКП - полностью отвергает ковалентный характер связи и предполагает, что связь между ионом металла и лигандом целиком ионная.
Недостатки метода валентных связей:
1) Не объясняет существование частиц с неспаренными электронами: Не2 + ,свободных радикалов;
2) Не объясняет парамагнетизм некоторых молекул, например О2
Парамагнетики — вещества, которые намагничиваются во внешнем магнитном поле в направлении внешнего магнитного поля (J↑↑H) и имеют положительную магнитную восприимчивость. Парамагнетики относятся к слабомагнитным веществам, магнитная проницаемость незначительно отличается от единицы .
Диамагне́тики — вещества, намагничивающиеся против направления внешнего магнитного поля. В отсутствие внешнего магнитного поля диамагнетики немагнитны.
Ферромагнетики, вещества (как правило, в твёрдом кристаллическом состоянии), в которых ниже определённой температуры (точкиКюри Q) устанавливается ферромагнитный порядок магнитных моментов атомов или ионов (в неметаллических кристаллах) или моментов коллективизированных электронов (в металлических кристаллах, см. Ферромагнетизм). Среди химических элементов ферромагнитны переходные элементы Fe, Со и Ni (3 d-металлы) и редкоземельные металлы Gd, Tb, Dy, Но, Er
Теория (метод) молекулярных орбиталей
учитывает и ковалентный, и ионный характер химических связей. ТМО рассматривает распределение электронов в молекулах так же, как современная теория трактует распределение электронной плотности в атомах:
- Положения атомных ядер и орбит электронов вокруг них считают определенными; эти молекулярные орбитали (МО) располагаются в области наиболее вероятного нахождения электронов в пространстве.
- Вместо того, чтобы располагаться у одного атома, эти МО простираются во всей молекуле или в ее части.
- Расчет формы МО были проведены для простейших молекул.
Поскольку расчет МО на основании общих принципов затруднителен, то обычно используют приближенный метод линейной комбинации атомных орбит (МКАО). Естественно, что МО молекулы должны напоминать атомные орбиты (АО) атомов, из которых составлена молекула. Исходя из известных форм атомных орбит, можно ориентировочно охарактеризовать формы МО.
Основные положения метода молекулярных орбиталей
1)Образование химических связей является результатом перехода электронов с АО на новые, называемые МО, и обладающие энергией, определяемой всеми атомами молекулы.
2) Каждой молекулярной орбитали соответствует определенная энергия, приближенно характеризуемая энергией удаления электрона с данной молекулярной орбитали, энергией ионизации молекулы.
3) Электроны в молекуле не локализованы в межядерных пространствах, они могут перемещаться в электрическом поле нескольких ее ядер.
4) Состояние каждого электрона описывается одноэлектронной молекулярной волновой функцией, характеризуемой определенным набором квантовых чисел.
5) Распределение электронов по новым энергетическим уровням или МО производится в соответствии с принципом наименьшей энергии, правилами Паули и Хунда.
6)Если переход электронов на МО энергетически выгоден, то химическая связь возникает.
Линейные комбинации (сложение и вычитание) двух атомных s-орбит, дающих две молекулярные орбиты, приведены на рисунке 1.
Атомные Перекрывание Молекулярные

орбиты атомных орбит орбиты
 |
 |

вычитание
энергия перекрывания σ*-разрыхляющая
 |  |  |
 | ||
 | ||
 |
Одна МО возникает от сложения перекрывающихся орбиталей, другая – от их вычитания.
Молекулярная орбита, которая получается от сложения двух s-орбит, занимает пространство между двумя ядрами; ее называют связывающей МО; ей соответствует энергия, более низкая, чем каждой из двух s-АО, от которых она произошла. Молекулярная орбита, получающаяся путем вычитания перекрывающихся частей АО, не включает пространства между ядрами. Она имеет более высокую энергию, чем первоначальные АО, и называется разрыхляющей МО. Разность энергии связывающей и разрыхляющей МО можно оценить, если учесть, что электрон связывающей орбиты находится под воздействием обоих орбит ядер, а электрон разрыхляющей МО находится под воздействием только одного ядра.
Атомные Перекрывание Молекулярные

орбиты атомных орбит орбиты
 |  |

вычитание σ*-
энергия перекрывания разрыхляющая
 |
А В А В
 |
р р сложение
перекрывания А В
 |
 |
 |
перекрывания А В

энергия
А В А В

π *-разрыхляющая

сложение

перекрывания

А В
Комбинации атомных s-орбит дают молекулярные σ(сигма)-орбиты. Комбинация атомных р-орбит, как показано на рисунке 2 может дать либо σ-, либо π (пи)-молекулярную орбиту. В случае π-МО в молекуле можно провести плоскость, проходящую через оба ядра, в которой вероятность нахождения электрона равна нулю. Электроны на π-МО находятся только выше и ниже оси связи.
Для иллюстрации использования ТМО можно рассмотреть диаграмму энергии МО для нескольких простых молекул. На рис.3 показана диаграммамолекулы Н2. В отдельных атомах водорода на каждой атомной орбите находится один электрон. В молекуле Н2 оба электрона находятся на энергетически более низкой σ-связывающей МО. Молекула Н2 устойчивей, чем свободные атомы Н, так как оба электрона находятся в молекуле на орбите с более низкой энергией. Разница в энергии атомных орбит и связывающей молекулярной орбиты зависит от того, насколько атомные орбиты перекрываются в молекуле. Широкое перекрывание вызывает большее различие и, следовательно, сильную связь; малое перекрывание - малое различие; и в этом случае молекула будет характеризоваться значением энергии, лишьнемного более низким, чем отдельные атомы.
 |
 |
 |
энергия
 | |
 |  |
 |
Н . Н-Н Н .
Рис.3. Диаграмма уровней энергии молекулярных орбит молекулы водорода.
Ион Не2 + (дигелий-ион) представляет собой трехэлектронную систему; диаграмма уровня энергии его МО показана на рис.4. Поскольку на орбите может быть только два электрона, третий электрон должен идти на σ*-разрыхляющую МО. Этой орбите соответствует более высокая энергия, чем АО отдельных атомов Не; таким образом, помещение электрона на σ*-МО характеризуется потерей энергии вследствие образования менее устойчивой системы. Это согласуется с экспериментальным наблюдением, что энергия связи Не2 + равна только 57 ккал\моль по сравнению с 103 ккал\моль для молекулы Н2. Четырехэлектронная молекула Не2 не более устойчива, чем два свободных атома Не.
Диаграмма уровней энергии МО в общем виде для молекулы АВ показана на рисунке 5. Для этой молекулы может быть неограниченное числоМО, характеризующихся высокой энергией, так же как для атомов А и В может быть неограниченное число АО с высокой энергией; однако интерес вызывают орбиты с низкой энергией, на которых находятся электроны. Если имеют дело с двумя различными типами атомов, то энергии атомных орбит различны (например, 1s- орбитам А и В соответствуют различные значения энергии). У более электроотрицательного элемента атомные орбиты характеризуются более низкой энергией. Различие в энергии орбит атомов двух элементов (рис.5, величины b и d) является мерой ионности связи. В молекуле Н2 1s-орбитам двух атомов водорода соответствует одна и та же энергия, и, следовательно, связь не имеет ионного характера.
 |
 |
 |
энергия
 |  |
 | |
 |
 |
Не: Не : Не + Не +.
Рис.4. Диаграмма уровней энергии молекулярных орбит дигелий-иона.
Порядок связи
Порядок связи (n) равен половине разности числа электронов на связывающих (Nсв) и разрыхляющих (Nраз) МО:
Если Nсв= Nраз, то n=0 и молекула не образуется. С увеличением порядка связи в однотипных молекулах растет энергия связи.
Порядок связи для молекулы Н2: n=(2-0)/2=1, следовательно молекула существует
Порядок связи для частицы Не2 + : n=(2-1)/2=0,5; следовательно молекула существует
По возрастанию энергии МО орбитали двухатомных молекул первого периода и начала вторго периода (до N2) можно расположить в следующий ряд:
 |
 |
 |

энергия c
 |
 |
 |
2s
 |
 |
 |
 |
a σ1*
1s

b
 |
 |
а 1s
 |
Рис.5. Диаграмма уровней энергии молекулярных орбит молекулы АВ.
Задачи
1. В рядах следующих молекул и ионов выберите частицу, у которой наибольшая энергия связи:
2. Как теория МО объясняет диамагнетизм молекул N2 и F2?*
3. Составьте энергетическую диаграмму молекулы СО. Какая электронная формула отражает строение этой молекулы?
4. Составьте энергетическую диаграмму МО частиц NO + , NO и NO - , сравните их порядок и энергию связей.
* При наличии в молекуле неспаренных электронов она обладает парамагнитными свойствами, в случае отсутствия неспаренных электронов – молекула диамагнитна.
Задачи и функции аптечной организации: Аптеки классифицируют на обслуживающие население; они могут быть.
Как оформить тьютора для ребенка законодательно: Условием успешного процесса адаптации ребенка может стать.
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2 + одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
4.5.1. Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:

3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе молекулярных орбиталей ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).

Рис. 12. Энергетическая схема образования молекулы водорода Н2
Рассмотрение химических связей в методе молекулярных орбиталей заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1—3, объясним образование молекулы H2 с точки зрения метода молекулярных орбиталей. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E1 св ), а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр ), а находящиеся на ней электроны — разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую молекулярную орбиталь, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу молекулярных орбиталей образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода молекулярных орбиталей реакцию образования молекулы водорода из атомов записывают так:
2H[1s 1 ] = H2[(σ CB 1s) 2 ],
т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой молекулярной орбитали заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:

В молекуле водорода В = (2—0) : 2=1, водород одновалентен. Молекула Н2 диамагнитна (электроны спарены).
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н2 + (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь св 1s. Уравнение процесса:
H[1s 1 ] + H + = H2 + [(σ св 1s) 1 ], ∆H = – 259,4 кДж

Число связей в ионе H2 + равно ½ (связь одним электроном). Ион H2 + — парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не2 + (рис.14). Уравнение его образования
He[1s 2 ] + He + [1s 1 ] = He2 + [(σ CB 1s) 2 (σ разр 1s) 1 ], ∆H = – 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2—1) : 2 = 1 /2. Ион— парамагнитен (имеет неспаренный электрон).

Рис. 15 . Энергетическая схема образования двухатомных гомонуклеарных молекул элементов второго периода
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода. Рассмотренный принцип построения молекулярных орбиталей из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2рx-, 2рy– и 2рz-орбиталей.
Участием внутренних электронов 1s-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2s-орбиталь одного атома взаимодействует только с 2s-орбиталью другого атома (должна быть близость значений энергий взаимодействующих орбиталей), образуя МО σ2s св и σ2s разр . При перекрывании (взаимодействии) 2р-орбиталей обоих атомов образуются МО: σх св , σх разр , πу св , πу разр , πz св , πz разр
(рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть молекулярных орбиталей – три связывающих и три разрыхляющих. Молекулярные орбитали, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой , а из ру– и рz– – буквой . С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода молекулярных орбиталей.

Рис. 16. Энергетическая схема образования молекулы Li2
Пример 1. Молекула лития Li2. Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K:
2Li[K2s] = Li2[KK(σ CB 2s) 2 ]
Число связей равно 1.
Пример 2. Молекула бериллия Be2. Восемь электронов молекулы размещены на МО следующим образом:
Ве2[KK(σ CB 2s) 2 (σ разр 2s) 2 ]
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3. Молекула азота N2 (рис. 17). Распределение 14 электронов по МО записывается так:


Рис. 17. Энергетическая схема образования молекулы N2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O2 (рис. 18). Электроны размещаются по молекулярным орбиталям в последовательности:
В молекуле две валентные связи. Последние два электрона разместились на различных π-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.


Рис. 18. Энергетическая схема образования молекулы O2
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования молекулярных орбиталей гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.

Рис. 19 . Энергетическая схема образования двух атомных гетеронуклеарных молекул элементов второго периода
Пример 5.Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s 2 2p 2 , а кислорода 2s 2 2p 4 . Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали σ2s св , два – на орбитали σ2s разр , четыре – на орбиталях πy CB и πz CB , а девятый и десятый – на σх св . Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:

Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N2). Молекула диамагнитна – все электроны спарены.
Пример 6. Молекула NO. На МО молекулы оксида азота (II) должны разместиться 11 электронов: пять азота – 2s 2 2p 3 и шесть кислорода – 2s 2 2p 4 . Десять из них размещаются так же, как и электроны молекулы оксида углерода (II) (пример 5), а одиннадцатый разместится на одной из разрыхляющих орбиталей – πy разр или πZ разр (эти орбитали энергетически эквивалентны между собой). Тогда
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая —677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.

Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора 3s 2 3р 3 (учитывая правило Хунда, ) по квантовым ячейкам имеет вид:

Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:

Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 8. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp 2 -, sp 3 -гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Гибридизация орбиталей и пространственная конфигурация молекул

Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F + 2 и О + 2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N + 2 , чем в молекуле N2; существование молекулярного иона Не2 + и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σ CB 1s разр 1s CB 2s разр 2s CB 2px CB 2py =
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей 2рx-орбитали больше энергии связывающих 2ру– и 2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих 2ру– и 2рz-орбиталей больше энергии связывающей 2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).

Рис.20. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами . Так, электронная конфигурация молекулы O2 записывается следующим образом:
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Читайте также:

