Клеточные технологии в медицине кратко
Обновлено: 02.07.2024
Какими бы впечатляющими не были успехи генетики, теперь уже ясно, что наследственная информация реализуется на уровне клетки. Постоянно появляются новые данные об адгезивных молекулах, цитокинах, ростовых факторах, путях сигнальной трансдукции, роли внеклеточного матрикса, ионных каналах и рецепторах. Успехи клеточной биологии и смежных дисциплин создали надежный фундамент для разработки новых подходов в лечении различных заболеваний.
Возвращение к Вирхову
О том, что первой и важнейшей структурной единицей жизни является клетка, представляющая собой самую общую и самую постоянную форму живой материи, впервые заявил Р.Вирхов. Он с особой настойчивостью повторял, что клетка построена по принципу "постоянно повторяющегося устройства", не подлежащего дальнейшему разложению на части, поскольку только в клетке молекулы могут приобрести ту, строго определенную, структурную взаимосвязь, которая обеспечивает возникновение всех "феноменов жизни" и в первую очередь репродукции ("omnius cellula e cellula" - всякая клетка из клетки).
"Клетка, - указывал Р.Вирхов, - . есть последний морфологический элемент всех живых тел. Мы не имеем права искать настоящей жизнедеятельности вне ее. Каждое животное является суммой жизненных единиц, из которых всякая отдельно взятая содержит все необходимое для жизни".
Опираясь на эти универсальные, с его точки зрения, принципы организации живой материи, Р.Вирхов прямо заявил, что материальным субстратом и одновременно единственно возможным "местом" болезни в организме человека является клетка, а болезнь есть не что иное, как сумма поражения множества отдельных клеток. Установленная и полностью обоснованная Р.Вирховом необходимость тщательного всестороннего анализа патоморфологических изменений на клеточном уровне очень скоро получила всеобщее признание, позволив добиться значительных успехов в изучении заболеваний, совершенствовании их диагностики и лечения. Что же касается теории целлюлярной патологии Р.Вирхова как комплексной системы теоретических положений, то с момента своего появления она встретила и одобрение, и возражения, вплоть до полного отрицания.
Открытие внутриклеточных органелл, построенных по принципу "постоянно повторяющегося устройства" и обладающих "всеми признаками жизни", неклеточных форм жизни (вирусы), а главное феноменальные успехи генетики, энзимологии, биохимии и гистохимии, молекулярной биологии не только создали необходимую почву для появления нового направления в медицине - молекулярной патологии, но и, казалось бы, навсегда поставили крест на целлюлярной патологии.
Однако с течением времени становится все более очевидным, что целлюлярную патологию слишком рано списали в анналы истории. Первыми ушли в небытие спекуляции на тему о спонтанном образовании живых структур из неживого вещества. Недавняя расшифровка генома человека уточнила наследуемую программу развития организма из одной клетки-зиготы в сложно организованную многоклеточную систему. Стало ясно, что геном - это целостная система наследственной информации организма. Если бы геном был не только целостной, но и самостоятельной единицей, вся совокупность клеточных ингредиентов могла бы создаваться полностью de novo, при условии целостности генома и наличия биосинтетического аппарата. Однако ни ядро, ни органеллы как эндоплазматический ретикулум (аппарат Гольджи), ни плазматические мембраны или лизосомы не могут быть созданы абсолютно заново без наличия хотя бы фрагментов данных структур. Эти органеллы перед клеточным делением распадаются на фрагменты и затем собираются из них заново. Можно предположить, что предшествующие фрагменты играют роль матриц, которые определяют корректность сборки. Геном не в состоянии из отдельных молекул воссоздать эти матрицы, появившиеся в какой-то момент эволюции и получившие от него автономность. Такая функция под силу только клетке.
Каждый живой организм, будь он одноклеточный или многоклеточный, сообразует свою жизнедеятельность с двумя принципиальными обстоятельствами - взаимоотношением с окружающей средой и своей адекватностью этой среде, а также своим внутренним состоянием. Чтобы принимать решения о реакциях в ответ на изменения этих обстоятельств, организм использует сложные системы сигнализации. А вся совокупность сигнальных систем клеток многоклеточного организма образует единый информационный комплекс, позволяющий клетке вырабатывать поведение, соответствующее потребностям организма. Исходя из современных представлений о роли и месте клеток в живом организме, подходы к созданию и развитию клеточных технологий лечения больных должны учитывать множество разных факторов. Вместе с тем в последние годы сложились отчетливые представления о наиболее перспективных клеточных технологиях, использующих современные достижения клеточной биологии (первичные клеточные культуры, клеточная инженерия, тканевая инженерия).
Первичные клеточные культуры
Успехи в области клеточной и молекулярной биологии привели к значительному прогрессу в технологии клеточных культур. Использование систем in vitro стало не только основополагающим подходом для изучения механизмов функционирования клеток, но и ведущим инструментом для управления клеточными процессами, в частности для активного контроля пролиферации и дифференцировки. Первичные клеточные культуры наиболее полно отражают структурный и функциональный потенциал тех тканей, из которых они были выделены. С одной стороны, этот метод служит прекрасным инструментом для изучения фундаментальных основ межклеточных взаимодействий в исследуемом органе, с другой - первичные культуры позволяют наиболее эффективно проводить первичный скрининг разрабатываемых лекарственных средств на стадии доклинических испытаний.
Клеточная инженерия
Клеточная инженерия основывается на выделении определенных типов клеток, придании им in vitro с помощью генетических конструкций или сигнальных молекул специфических свойств и введении их в организм больного. Наиболее ярким примером клеточной инженерии является использование дендритных клеток для модуляции иммунного статуса.
Хотя дендритные клетки были описаны в середине XIX века как антигенпредставляющие клетки, объектом пристального изучения они стали только в 70-е годы XX века, когда было показано, что лимфоидные дендритные клетки являются сильными стимуляторами первичного иммунного ответа. Во-первых, они отличаются от других антигенпредставляющих клеток (В-лимфоциты, моноциты и макрофаги) тем, что их стимулирующий эффект на Т-лимфоциты в 10-100 раз сильнее. Во-вторых, они являются единственными антигенпредставляющими клетками, которые способны представлять наивным Т-клеткам неизвестные антигены и усиливать иммунный ответ.
Идет процесс накопления знаний о самих дендритных клетках (их получение, культивирование и активация), антигенах (их источники, приготовление и доставка) и об управлении дендритными клетками в организме реципиента (дозы, частота и пути введения). Кроме того, разрабатываются критерии оценки адекватности ответа иммунной системы на введение модифицированных дендритных клеток.
Дендритные клетки представляют собой и векторы, и мишени для изменения иммунного статуса организма. Они обладают уникальной способностью представлять антигены Т-лимфоцитам и таким образом участвуют в определении направленности иммунных реакций. В связи с этими свойствами возлагается много надежд на возможное их использование в модуляции иммунного ответа при опухолях, инфекционных и аутоиммунных заболеваниях. Клинические испытания клеточных вакцин на основе дендритных клеток, несмотря на обнадеживающие результаты при лечении опухолевых заболеваний, еще находятся в начальной фазе.
Основными этапами создания клеточных вакцин для лечения инфекционных заболеваний являются следующие:
Такая стратегия исследований по использованию дендритных клеток может привести к созданию новых лекарств и вакцин, которые позволят стимулировать иммунитет против различных инфекций и злокачественных новообразований или тормозить его при аутоиммунных заболеваниях и трансплантации органов и тканей. Возможности клеточной инженерии существенно расширяются в комбинации с генной инженерией. В выделенные от пациента клетки и размноженные in vitro фибробласты, лимфоциты, стволовые клетки и т.д. вводят соответствующий ген. Клетки тестируют и вводят пациенту (ex vivo).
Более 40% клинических испытаний способов генной терапии (свыше 450) проводится с использованием клеточных технологий. Из них в 40% случаев в качестве носителей гена используют стволовые гемопоэтические клетки. Популярность стволовых клеток связана с их способностью к самоподдержанию, что уменьшает риск элиминации введенного гена. Стволовые кроветворные клетки, несмотря на их малочисленность, легко выделяются из периферической крови и костного мозга взрослых и из пуповинной крови новорожденных, идентифицируются и достаточно хорошо сохраняются при лабораторных манипуляциях. Кроме того, они способны к дифференцировке в различные клетки крови и иммунной системы, а также в клетки других тканей.
Надежды исследователей связаны с возможностью использования для генной терапии других соматических стволовых клеток, в частности миобластов. Они легко встраиваются в мышечные фибриллы, становясь составной частью мышечной ткани. Поскольку генетически модифицированные миобласты в мышечной ткани взаимодействуют с нервами и сосудами, их можно использовать для лечения не только мышечных, но и нейродегенеративных и эндокринных заболеваний, а также гемофилии и ряда опухолей.
Тканевая инженерия
Тканевая инженерия является самостоятельным междисциплинарным направлением. При этом для замещения пораженных органов и тканей используют принципы биологии и инженерии, с помощью которых восстанавливают, поддерживают или улучшают функции органов и тканей. Тканевая инженерия отличается от стандартной терапии тем, что сформированная инженерным путем ткань интегрируется в организм пациента, осуществляя постоянное и специфическое лечение болезни. При создании новой ткани используют один из трех общих подходов.
Возможность гистотипического восстановления поврежденных тканей и органов представляет значительный интерес. Современные методы изоляции клеток и подходы к их культивированию предполагают использование как специализированных зрелых клеток, так и их предшественников на любых этапах дифференцировки. Многообещающие перспективы развития тканевой инженерии связаны с возможностью использования в качестве исходного материала не только ксено- и аллогенных источников, но и аутогенных клеток, размноженных вне организма и ретрансплантированных в составе реконструированной ткани. Такой подход в самом ближайшем будущем может стать реальной альтернативой классической трансплантологии.
Первым органом, который попытались воссоздать ex vivo, стала кожа человека. Все исследования, проводимые на клеточной модели кожи, имеют большое значение в таких областях медицины, как фармакология (при доклинических испытаниях лекарственных средств), косметология (при испытаниях косметических средств), токсикология, дерматология (при инфекционно-аллергических заболеваниях кожи), хирургия и травматология (при заживлении ран и пересадке кожи).
Эмбриональные стволовые клетки
Значительные перспективы для восстановления функции пораженных органов и тканей сулит техника, связанная с использованием стволовых клеток. Известно несколько видов стволовых клеток: эмбриональная стволовая клетка (из бластоцисты); стволовая клетка эмбриональных тканей; стволовая клетка дифференцированных тканей (соматическая стволовая клетка). Все стволовые клетки, независимо от происхождения и источника выделения, обладают тремя общими уникальными свойствами - способны к самоподдержанию в течение длительного времени; не специализированы, то есть не имеют каких-либо тканеспецифических маркеров, ответственных за выполнение специальных функций; способны к дифференцировке в любые специализированные клетки.
История их изучения берет начало с концепции стволовой клетки, предложенной русским гистологом А.Максимовым в 1908 г. применительно к кроветворной ткани. Середина 70-х годов ХХ века ознаменовалась крупным успехом в изучении клеточного состава костного мозга и открытии в его строме мезенхимальных (стромальных) стволовых клеток группой отечественных ученых во главе с А.Фриденштейном. В конце 90-х годов значительные успехи были достигнуты в изучении эмбриональных стволовых клеток.
После выделения плюрипотентных линий из предимплантационных эмбрионов опубликован огромный материал, касающийся биологии эмбриональных стволовых клеток и результатов направленной дифференцировки в специализированные клеточные типы. В опытах на линиях мышиных эмбриональных стволовых клеток получены кардиомиоциты, кроветворные клетки-предшественники, клетки желточного мешка, скелетные миоциты, гладкомышечные клетки, адипоциты, хондроциты, эндотелиальные клетки, меланоциты, нейроны, глия, островковые клетки поджелудочной железы, примитивная энтодерма.
Отличительными особенностями эмбриональных стволовых клеток являются их способность к бесконечной пролиферации симметричным делением в лабораторной культуре и выраженная клоногенность, то есть способность к образованию из одной первоначальной стволовой клетки целой линии генетически идентичных ей. В то же время огромный интерес представляют открытые недавно свойства пластичности стволовых кроветворных клеток и соматических стволовых клеток. Они дифференцируются в ограниченное число клеточных типов, то есть имеют потенциал мульти- или унипотентного созревания и не обладают плюрипотентностью - способностью давать начало всем клеточным типам, образующимся из трех зародышевых листков.
Исследования последних лет продемонстрировали не только возможность выделения соматических стволовых клеток человека, но и их направленную дифференцировку in vitro и in vivo.
Подавляющее большинство публикаций последнего времени посвящено эмбриональным стволовым клеткам как наиболее многообещающим для развития клеточных технологий. Выработан ряд критериев использования эмбриональных стволовых клеток в клинической практике: выделение эмбриональных стволовых клеток и получение их культур с направленной дифференцировкой; проведение теста на физиологическую функциональность эмбриональных стволовых клеток в культуре; проведение теста на функциональную эффективность на моделях; проведение теста на безопасность на животных; тестирование полученных клеток на возможность развития реакции отторжения.
Несмотря на тщательный подбор донора и реципиента по антигенам главного комплекса гистосовместимости, а также на успехи иммуносупрессивной терапии, вероятность иммунологического отторжения крайне велика. Пересадка эмбриональных стволовых клеток, подобно трансплантации органов, не излечивает больного, а продлевает его жизнь. Генноинженерные манипуляции, способные изменить иммунные характеристики эмбриональных стволовых клеток и снизить риск развития реакции "трансплантат против хозяина", не могут обеспечить полную безопасность пациенту. Риск появления генетических мутаций при генно-инженерных манипуляциях вполне реален. Не исключено, что эти мутации будет сложно обнаружить до трансплантации.
Предлагаемое в качестве альтернативы так называемое терапевтическое клонирование, когда генетическая информация стволовой клетки замещается генетической информацией от пациента, достаточно опасно, так как в таких "терапевтических" клонах велика вероятность возникновения аномалий, делающих невозможным их использование в лечении.
Для корректной дифференцировки эмбриональных клеток необходимы многочисленные факторы, например механическое натяжение, разнообразие электрических полей, комплекс структурного микроокружения, способствующих упорядоченной активации и экспрессии генов. Полное воспроизведение этих немолекулярных компонентов эмбрионального развития пока нереально. Трансплантация пациенту некорректно дифференцированных клеток представляет серьезный риск, связанный с высоким туморогенным потенциалом эмбриональных стволовых клеток.
До настоящего времени не доказано, что клетки, образованные из эмбриональных стволовых клеток, можно безопасно трансплантировать взрослому животному для восстановления функции поврежденной ткани или органа. Ситуация, сложившаяся к сегодняшнему дню с эмбриональными стволовыми клетками, напоминает эксперименты с генной терапией - большие надежды, большие проблемы и пока невысокий эффект.
Соматические стволовые клетки
Необходимость преодоления серьезных ограничений по использованию эмбриональных стволовых клеток была бы очевидной в отсутствие видимой альтернативы. Однако в последние годы наметился значительный прогресс в области исследований соматических стволовых клеток. Преимущества их использования вместо эмбриональных очевидны: соматические стволовые клетки получают из тканей самого пациента, поэтому проблемы иммунологического отторжения не существует. Стволовые клетки из дифференцированных тканей не вызывают образования тератом, а терапевтическое использование соматических стволовых клеток самого пациента не создает этических проблем.
Существует ряд проблем, связанных с использованием соматических стволовых клеток:
В связи с этим эмбриональные стволовые клетки кажутся более привлекательными, поскольку доказана их способность (в эмбриональном микроокружении) генерировать все клеточные типы. На практике, однако, чрезвычайно трудно получить в культуре из эмбриональных стволовых клеток тот тип клеток, который планируется. Одним из вариантов решения этой проблемы является получение стволовых клеток из пуповинной крови новорожденных и их хранение в банках стволовых клеток.
Заключение
Перечень примеров, наглядно демонстрирующих реальное значение клеточной биологии в решении актуальных проблем медицины XXI века, может быть продолжен. Вместе с тем уже сейчас становится очевидным, что дальнейший прогресс как самой клеточной биологии, так и медицинской науки в целом будет связан не только и не столько с дальнейшим накоплением фактического знания, сколько с его творческим осмыслением. Основная историческая заслуга Р.Вирхова состояла не в числе совершенных им конкретных открытий, а в создании научно достоверной теоретической концепции, определившей естествоиспытателям основное направление поиска и тем самым сыгравшей решающую роль в развитии медицины конца XIX - первой половины XX века. Сегодня аналитическая работа ученых явно превалирует над синтезом и осмыслением полученных данных, а потому необходимость теоретической концепции, подобной той, что в середине XIX века предложил Р.Вирхов, необходима, как никогда. Эта концепции должна быть построена на фундаменте нового знания и способна определить как направление, так и содержание дальнейшего развития современной патологии.
Открытие стволовой клетки и развитие связанных с этим открытием клеточных технологий в медицине наряду с расшифровкой двойной спирали ДНК и генома, безусловно, относятся к важнейшим событиям, произошедшим в биологии в ХХ веке. Именно клеточные технологии являются основой генной терапии, с которой связаны надежды на разработку индивидуальных схем лечения пациентов с самыми тяжелыми заболеваниями, в том числе наследственными. Клеточные технологии и генная терапия представляют собой наиболее универсальные современные подходы к лечению. Медицина ХХI века, безусловно, будет основана на фундаментальных достижениях клеточной биологии.
Направления деятельности ИСКЧ - разработка, коммерциализация, а также продвижение на российском и мировом рынках собственных инновационных лекарственных препаратов и высокотехнологичных услуг в сфере регенеративной медицины, медицинской генетики, генной терапии, биострахования и биофармацевтики.
ИСКЧ принадлежит крупнейший в стране банк персонального хранения стволовых клеток пуповинной крови – Гемабанк, а также банк репродуктивных клеток человека – Репробанк (персональное хранение и донация).
Компания вывела на рынок первый российский геннотерапевтический препарат для лечения ишемии нижних конечностей атеросклеротического генеза – Неоваскулген®, а также инновационную медицинскую технологию применения дермальных аутофибробластов для восстановления кожи с признаками возрастных и иных структурных изменений – SPRS-терапия.
ИСКЧ реализует социально-значимый проект по созданию общероссийской сети медико-генетических центров Genetico для предоставления услуг генетической диагностики и консультирования с целью раннего выявления и профилактики наследственных заболеваний, а также патологий с генетической составляющей (Этноген, PGD, Prenetix и др.).

Клеточные технологии – технологии, основанные на применении клеток - представляют собой одно из направлений регенеративной медицины, основной целью которой является регенерация и замещение клеток, тканей и органов для восстановления утраченных ими (вследствие врожденного дефекта, болезни, травмы, старения) функций и структуры. В основе клеточных технологий лежит применение живых клеток человека - аутологичных (собственных клеток человека) или аллогенных (полученных из тканей другого человека), стволовых и/или зрелых (специализированных).
Типы клеток
Стволовые клетки. Это недифференцированные клетки, способные к самообновлению и образованию нескольких типов дифференцированных потомков. Они являются ранними типами клеток в последовательной цепи строго упорядоченных процессов (таких как пролиферация клеток, их миграция, дифференцировка, созревание и апоптоз), обеспечивающих образование и поддержание клеточных линий взрослого человека.
Эмбриональные стволовые клетки (ЭСК) - присутствуют в организме только на ранних стадиях жизни эмбриона и происходят из единичных бластомеров, внутренней клеточной массы бластоцисты, морулы, зародышевых клеток. ЭСК не имеют ограничений в программе развития и обладают способностью воссоздавать любые ткани и органы человека путем деления и образования специализированных клеток. В настоящее время данный тип клеток используют исключительно для научно-исследовательских работ. В клеточных технологиях, применяемых для лечения человека, эти стволовые клетки, несмотря на их огромный терапевтический потенциал, не используют вследствие недостаточной изученности, а также этических проблем и риска развития новообразований.
Стволовые клетки (гемопоэтические) пуповинной крови (ГСК ПК). Их собирают из отсеченной пуповины после ее отделения от новорожденного. Данные клетки можно использовать для лечения онкогематологических заболеваний, болезней крови и иммунной системы как самого ребенка, так и его ближайших родственников.
Взрослые (другое название - региональные, тканеспецифичные) стволовые клетки. Это клетки, которые, по сравнению с ЭСК, появляются на более поздних стадиях формирования организма и присутствуют в каждой ткани взрослого человека. Основная функция взрослых СК - восстановление и поддержание тканей, в которых данные клетки присутствуют. В отличие от ЭСК эти СК имеют меньшую способность к самоподдержанию и меньший дифференцировочный потенциал. В коже, к примеру, такие СК называются стволовыми клетками дермы (СКД), которые дифференцируются в зрелые, специализированные клетки дермы - фибробласты, представляющие собой ключевое звено этой ткани, поскольку вырабатывают для нее все необходимые компоненты.
Таким образом, зрелые клетки отличаются от стволовых тем, что это – дифференцированные клетки, запрограммированные на ограниченное количество циклов деления, после чего они погибают, замещаясь новыми поколениями. СК же такого ограничения не имеют и могут делиться бесконечно или очень длительное время, поддерживая тем самым клеточные популяции данной ткани. Главная же задача зрелых (специализированных) клеток – продукция компонентов межклеточного матрикса ткани и участие в его обновлении. Примером зрелых клеток, помимо фибробластов, могут служить кератиноциты эпидермиса, адипоциты жировой ткани и пр.
Следует отметить еще одно звено в клеточной иерархии, которое находится между СК и зрелыми клетками – так называемые прогениторные клетки (другое название клетки-предшественники). Прогениторные клетки представляют собой дифференцирующиеся клетки, коммитированные в направлении клеточной линии, специализированной для данной ткани и обладающие высокой способностью к делению. Благодаря последнему происходит поддержание необходимой численности клеточной популяции в этой ткани. Наглядным примером такой клеточной иерархии может служить фибробластический дифферон кожи.
В костном мозге различают два типа региональных мультипотентных СК - гемопоэтические СК (ГСК), дающие начало всем клеткам крови и мезенхимные СК (ММСК), способные дифференцироваться в остео-, хондро-, адипо- и миогенном направлениях. В жировой ткани также присутствуют ММСК, , которые способны дифференцироваться в нескольких направлениях, основными из которых являются адипо и ангиогенное.
Наличие у взрослых СК мультипотентности (способности дифференцироваться в несколько типов клеток) позволило активно использовать данные клетки для лечения ряда заболеваний. Так, в настоящее время ММСК успешно применяют для лечения патологии опорно-двигательной и сердечно-сосудистой систем, урологических и иммунных заболеваний, заболеваний глаз (ретинопатии, дистрофии сетчатки), диабета, цирроза печени. При этом показано, что улучшение функции поврежденных органов и тканей сопровождается активацией входящих в их состав клеток: кардиомиоцитов при сердечной недостаточности, островковых клеток поджелудочной железы при сахарном диабете I типа после трансплантации ММСК; активизируются процессы заживления ожоговых ран и пр. Терапевтическое действие ММСК наблюдается за счет местных и системных механизмов, способных стимулировать регенерацию в поврежденных органах и восстанавливать их функцию.
В коже человека – объекте особо пристального внимания специалистов эстетической медицины – можно выделить следующие типы стволовых и дифференцированных клеток:
В эпидермисе – базальные эпидермальные СК, дифференцирующиеся в зрелые клетки эпидермиса - кератиноциты и мультипотентные эпителиальные СК волосяного фолликула (способные дифференцироваться в кератиноциты, себоциты, клетки волосяного фолликула).
В дерме - мультипотентные стволовые мезенхимные клетки (СКД), дифференцирующиеся в фибробласты.
В гиподерме: мультипотентные мезенхимные стволовые клетки – СКЖТ, дифференцирующиеся в адипо- и ангиогенном направлениях.
Клеточные технологии в лечении повреждений кожи
Среди наиболее перспективных и успешных областей применения клеточных технологий особо выделяется лечение повреждений кожи – уже десятки и даже сотни тысяч пациентов в мире получили терапию кожи клеточными препаратами. К примеру, препарат Apligraf®, США (дермальный эквивалент кожи, включающий аллогенные кератиноциты и дермальные фибробласты) использовали при лечении хронических язв более чем 250 тысяч пациентов; препарат Dermagraft®, США (клеточный препарат, включающий аллогенные дермальные фибробласты) – более 50 тысяч пациентов при лечении с хронических язв; Epicel®, США (препарат, включающий аутологичные кератиноциты) – около 2 тысяч пациентов при тяжелых ожоговых поражениях кожи.
К настоящему времени разработаны клеточные технологии, в основе которых лежит применение не только культивированных клеток (о которых речь шла выше) но и клеток, получение которых происходит без культивирования. Так, в частности, австралийская биотехнологическая компания Avita Medical изобрела прибор ReCell, который позволяет в течение 30 мин из небольшого биоптата кожи пациента получить суспензию, состоящую из 3-х популяций клеток (кератиноцитов, фибробластов, меланоцитов). Полученную клеточную суспензию можно использовать ex temporo для лечения ожогов, хронических ран и даже витилиго. Данная клеточная технология эффективно применяется в странах Европы, в Австралии, Новой Зеландии. В настоящее время она появилась и на российском рынке регенеративной медицины.
Активно ведутся разработки и в направлении лечения таких тяжелых заболеваний кожи, как буллезный эпидермолиз – генетически обусловленное заболевание, связанное с нарушением продукции коллагена VII типа, ответственного за сцепление дермы с эпидермисом. Первые положительные результаты показали, что трансплантация эпидермальных аутографтов (аутологичных стволовых эпидермальных клеток, генетически модифицированных посредством трансдукции в них ex vivo нормальной копии дефектного гена) привела к коррекции патологии и, вероятно, сможет эффективно помочь в борьбе с этим смертельным заболеванием.
Клеточные технологии в эстетической медицине
Известно, что фибробласты – основа морфофункциональной организации и гомеостаза кожи – отвечают за продукцию, организацию и обновление межклеточного матрикса дермы. Они контролируют состав и структуру матрикса путем регулируемого по принципу обратной связи синтеза коллагена, эластина и основного вещества, а также путем участия в разрушении этих компонентов.
Соответственно, нарушение физиологического баланса в популяции дермальных фибробластов приводит к значительным изменениям в структуре кожи. Ученые показали, что одним из способов эффективной коррекции развившихся возрастных изменений кожи является трансплантация культивированных аутологичных дермальных фибробластов (аутоДФ) пациента, выращенных в специальных лабораторных условиях, тем самым увеличивая количество функционально-активных клеток в тех областях кожи человека, которые требуют коррекции.
Ученые показали, что способность к делению фибробластов кожи взрослого человека в течение всей его жизни остается на довольно высоком уровне – первичные культуры, полученные даже от очень пожилых людей (95 лет), содержат до 14% митотически активных фибробластов. Это дает возможность из небольшого биоптата кожи взрослого человека, независимо от его возраста, получить необходимое для проведения терапии количество функционально-активных клеток. При этом в используемых культурах фибробластов дермы, также независимо от возраста, отмечается высокая продукция основных белков, синтезируемых данными клетками.

1. Максимов В.В., Лагарькова М.А., Киселев С.Л. Генная и клеточная терапия заболеваний сетчатки глаза // Гены и клетки. 2012. №3. С.12-20.
3. Мамаев С.В., Потемкин А.В., Цека О.С. Клеточные технологии // Медицина экстремальных ситуаций. 2012. №3 (41). С. 79-94.
4. Гольдштейн Д.В., Фатхудинов Т.Х. Актуальные вопросы клеточной терапии миокарда // Вестник РАМН. 2012. №4. С.16-24.
5. Кочегура Т.Н., Ефименко А.Ю., Акопян Ж.А., Парфенова Е.Е. Клеточная терапия сердечной недостаточности: клинический опыт, проблемы и перспективы // Гены и клетки. 2010. №2. С. 11-18.
7. Фриденштейн А.Я. Гистогенетический анализ внескелетного остеогенеза: дис. … док. биол. наук. Москва, 1960.
8. Владимирская Е.Б. Мезенхимальные стволовые клетки (мск) в клеточной терапии // Онкогематология. 2007. №1. С. 4-16.
9. Калинина Н.И., Сысоева В.Ю., Рубина К.А., Парфенова Е.В., Ткачук В.А. Мезенхимальные стволовые клетки в процессах роста и репарации тканей // Acta Naturae (русскоязычная версия). 2011. №4. С. 32-39.
12. Суббот А.М., Каспарова Е.А. Обзор подходов к клеточной терапии в офтальмологии // Вестник офтальмологии. – 2015. – Т. 131. – №. 5. – С. 74-81.
13. Борзенок С.А., Онищенко Н.А., Тонаева Х.Д., Комах Ю.А., Сускова В.С., Сусков С.И., Кост Е.А. Длительная нормотермическая консервация лимбальных трансплантатов как способ повышения количества и активности ММСК-подобных лимбальных клеток // Вестник трансплантологии и искусственных органов. 2014. Т. 14. №. 2. С. 77-85.
14. Тонаева Х.Д., Онищенко Н.А., Борзенюк С.А. Лимбальная трансплантация как способ индукции локальной иммунной толерантности при кератопластике высокого риска // Вестник трансплантологии и искусственных органов. 2011. 13(2). С. 95-102.
16. Борзенок С.А., Хубецова М.Х., Сабурина И.Н., Гаврилова Н.А., Комах Ю.А., Тонаева Х.Д., Островский Д.С., Ланевская Н.И., Кошелева Н.В., Зурина И.М. Применение 3D-клеточных технологий в лечении нейродегенеративных заболеваний глаз // Таврический медико-биологический вестник. 2017. Т. 20. №. 2. С. 11-16.
17. Борзенок С.А., Малюгин Б.Э., Тонаева Х.Д., Онищенко Н.А., Комах Ю.А., Ковшун Е.В. Способ выделения и органотипического культивирования аллогенного лимбального трансплантата // Патент РФ № 2475218. 2013г. Бюл. №5.
18. Бурунова В.В., Васильев М.П., Ярыгин Н.В., Ярыгин К.Н. Перспективы применения препаратов на основе мезенхимальных стволовых клеток в терапии посттрансплантационных осложнений, связанных с иммунной несовместимостью // Курский научно-практический вестник "Человек и его здоровье". 2017. №1. С. 81-87.
19. Pellegrini G., Traverso C.E., Franzi A.T., Zingirian M., Cancedda R., De Luca M. Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet. 1997. 349 (9057) P. 990-993.
20. Сабурина И.Н., Колокольцова Т.Д., Копаев С.Ю., Зурина И.М., Борзенок С.А. Опыт культивирования клеток переднего эпителия роговицы глазного яблока человека // Патологическая физиология и экспериментальная терапия. 2014. Т. 58. № 4. С. 120-126.
21. Rama P., Matuska S., Paganoni G., Spinelli A., De Luca M., Pellegrini G. Limbal stem-cell therapy and long-term corneal regeneration. N. Engl. J. Med. 2010. 363(2). P. 147-155.
24. Аветисов С.Э., Суббот А.М., Антохин А.И., Каспарова Е.А., Каспаров А.А., Павлюк А.С. Персонализированная клеточная терапия в офтальмологии (II): цитокиновый профиль аутогенного клеточного продукта // Гены и клетки. 2012. №1. С. 49-53.
25. Каспарова Е.А., Суббот А.М., Калинина Д.Б. Пролиферативный потенциал заднего эпителия роговицы человека // Вестник oфтальмологии. 2013. 129(3). С. 82-88.
26. Суббот A.M., Антохин А.И., Павлюк А.С. Механизмы клеточной терапии эндотелиальных поражений роговицы // Гены и клетки. 2010. №3. С. 50-52.
27. Gospodarowicz D., Mescher A.L., Birdwell C.R. Stimulation of corneal endothelial cell proliferation in vitro by fibroblast and epidermal growth factors Experimental eye research. 1977. Т. 25. №. 1. P. 75-89.
28. Giguere L., Cheng J., Gospodarowicz D. Factors involved in the control of proliferation of bovine corneal endothelial cells maintained in serum‐free medium Journal of cellular physiology. 1982. Т. 110. №. 1. P. 72-80.
29. Gospodarowicz D., Ill C. The extracellular matrix and the control of proliferation of corneal endothelial and lens epithelial cells Experimental eye research. 1980. Т. 31. №. 2. P. 181-199.
30. Gospodarowicz D., Vlodavsky I., Savion N. The role of fibroblast growth factor and the extracellular matrix in the control of proliferation and differentiation of corneal endothelial cells Vision research. 1981. Т. 21. №. 1. P. 87-103.
31. Engelmann K., Bоhnke M., Friedl P. Isolation and long-term cultivation of human corneal endothelial cells // Investigative ophthalmology and visual science. 1988. Т. 29. №. 11. P. 1656-1662.
32. Blake D.A., Yu H., Young D.L., Caldwell D.R. et al. Matrix stimulates the proliferation of human corneal endothelial cells in culture. Investigative ophthalmology and visual science. 1997. Т. 38. № 6. P. 1119-1129.
33. Joyce NC. Cell cycle control and replication in corneal endothelium. In: Reinhard T, Larkin F. Cornea and external eye disease. Springer Berlin Heidelberg. 2010. P. 69-86.
34. Mimura T., Shimomura N., Usui T., Noda Y., Kaji Y., Yamgami S., Amano S., Miyata K., Araie M. Magnetic attraction of iron-endocytosed corneal endothelial cells to Descemet's membrane. Exp. Eye. Res. 2003. №76. P. 745-751.
35. Mimura T., Yamagami S., Usui T., Ishii Y., Ono K., Yokoo S., Funatsu H., Araie M., Amano S. Long-term outcome of iron-endocytosing cultured corneal endothelial cell transplantation with magnetic attraction. Exp. Eye. Res. 2005. №80. P.149-157.
36. Koizumi N., Okumura N., Kinoshita S. Development of new therapeutic modalities for corneal endothelial disease focused on the proliferation of corneal endothelial cells using animal models. Experimental eye research. 2012. Т. 95. № 1. P. 60-67.
37. Okumura N., Ueno M., Koizumi N., Sakamoto Y., Hirata K., Hamuro J., Kinoshita S. Enhancement on primate corneal endothelial cell survival in vitro by a ROCK inhibitor. Investigative ophthalmology and visual science. 2009. Т. 50. № 8. P. 3680-3687.
39. Madden P.W., Lai J.N., George K.A., Giovenco T., Harkin D.G., Chirila T.V. Human corneal endothelial cell growth on a silk fibroin membrane. Biomaterials. 2011. Т. 32. №. 17. P. 4076-4084.
40. Казанцев А.Д., Островский Д.С., Борзенок С.А. Результаты разработки протокола выделения и культивирования заднего эпителия роговицы человека // Вестник Совета молодых учёных и специалистов Челябинской области. 2017. №4 (19). С. 50-52.
41. Казанцев А.Д., Островский Д.С., Герасимов М.Ю., Борзенок С.А. Изучение экспериментальных методов выделения и культивирования клеток эндотелия роговицы человека // Современные технологии в офтальмологии. 2017. №. 4. С. 105-108.
42. Schwartz S.D., Hubschman J.P., Heilwell G., Franco-Cardenas V., Pan C.K., Ostrick R.M., Lanza R. Embryonic stem cell trials for macular degeneration: a preliminary report. The Lancet. 2012. 379 (9817). P. 713-720.
43. Schwartz S.D., Regillo C.D., Lam B.L., Eliott D., Rosenfeld P.J., Gregori N.Z., Maguire J. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: follow-up of two open-label phase 1/2 studies. The Lancet. 2015. Т. 385. № 9967. P. 509-516.
Клеточные технологии представляют собой новый раздел медицины, основанный на использовании различных типов стволовых и иммунокомпетентных клеток в лечении различных заболеваний и повреждений органов и тканей. Благодаря развитию клеточных технологий стало возможным проводить лечение заболеваний, которые ранее считались инкурабельными или не имеющими эффективных методов лечения на данном этапе. Так, к примеру, клеточную терапию уже применяют при лечении очагов некроза, возникающих при ишемии миокарда, для восстановления хряща при травмах суставов, повреждениях скелетных мышц, восстановлении кожи при ожогах и т.д. [4–6].
Цель исследования: сравнительный анализ результатов зарубежных и отечественных исследований в области клеточных технологий и клеточной терапии в офтальмологии, представленных в доступной научной литературе.
Клеточная терапия при заболеваниях роговицы
Ожоги роговицы, часто сопровождающиеся ее неоваскуляризацией, являются частым противопоказанием к проведению кератопластики, так как наличие неоваскуляризации в разы повышает риск развития болезни трансплантата вследствие иммунного ответа. Основными клетками, вызывающими образование стойкого помутнения роговицы, являются стромальные кератоциты, которые переходят в активированное состояние под действием различных цитокинов и ростовых факторов.
Установлено, что клетки, залегающие в полисаде Фогта лимбальной зоны глазного яблока, фенотипически соответствуют ММСК костного мозга [8, 13, 14]. При культивировании этих клеток происходит выделение разнообразных цитокинов, интерлейкинов, ростовых факторов, в результате чего они рассматриваются как материал для проведения клеточной терапии методом трансплантации аллогенных фрагментов лимба, культивированных при нормотермии, в лечении глаукомной оптической нейропатии [15], дегенеративных заболеваниях глаз [16], персистирующих эрозий и язв роговицы в качестве индукторов локальной иммуносупрессии при пересадках роговицы и др. [14, 17, 18].
В 1997 г. G. Pellegrini et al. предложила предварительно выделить лимбальные стволовые клетки (ЛСК), размножить их в чашке Петри, после чего трансплантировать пациенту. Такая трансплантация культивированного ЛСК оказалась достаточно эффективной (положительный эффект был достигнут в 76% случаев) [19].
Благодаря совершенствованию техники культивирования ЛСК, позволяющей наращивать достаточное количество клеток из нескольких биоптатов менее 1 мм в диаметре, в качестве источника теперь можно использовать не только аллогенный, но и аутологичный материал из здорового парного глаза [13, 20].
Выявлено, что культуральная среда, полученная при культивировании ММСК, содержит большое количество цитокинов, интерлейкинов и факторов роста, которые положительно влияют на восстановление роговицы, в частности подавляют активацию кератоцитов и их миграцию [22].
В НИИ глазных болезней РАМН разработан и внедрен в практику метод лечения поражений тканей переднего отдела глаза, основанный на использовании лейкоцитов пациента, предварительно активированных in vitro полиадениловой-полиурациловой кислотой, реализуемый путем введения их непосредственно в зону патологического процесса [23, 24]. Данный метод хорошо себя зарекомендовал при герпетических поражениях роговицы и осложнениях факоэмульсификации катаракты в виде эндотелиальной дисфункции в раннем послеоперационном периоде [25, 26]. По мнению авторов, такой вид клеточной терапии обладает высокой терапевтической эффективностью, обусловленной применением сыворотки пациента, насыщенной цитокинами, среди которых имеются факторы роста (TGFβ1, TGFβ2, PDGF-AB, VEGF, ИЛ-1, -6, -4, -8, ИФ-α, ИФγ, ФНО-α), а также активированной лейкоцитарной клеточной фракции и тромбоцитов, которые обеспечивают пролонгированное высвобождение этих биологически активных веществ в месте введения, сводя к минимуму вероятность развития побочных явлений такого вида лечения [23, 24].
Офтальмологи уже более 40 лет исследуют проблему пролиферации клеток эндотелия роговицы. Одним из первых упоминаний таких исследований стала работа D. Gospodarowicz et al. (1977), в которой описано положительное влияние эпидермального фактора роста, фактора роста фибробластов, а также концентрации фетальной бычьей сыворотки на пролиферацию эндотелия роговицы крупного рогатого скота in vitro [27]. В последующих исследованиях (1980–1982 гг.) было показано, что культивация клеток на внеклеточном матриксе (полученном предварительной культивацией эндотелия роговицы крупного рогатого скота с последующим его удалением) приводит к той же быстрой пролиферации и последующей клеточной дифференцировке, что и культур, поддерживаемых на пластике и подвергающихся воздействию фактора роста фибробластов [28–30].
K. Engelmann et al. (1988) в своей статье описывает возможность выделения и долгосрочно культивирования эндотелия роговицы и отсутствия признаков старения субкультуры более чем в 20 поколениях, на что, по мнению автора, влияет добавление в культуру ламинина и хондроитина сульфата, позволяющих клеткам долгое время оставаться в виде монослоя [31].
D.A. Blake et al. (1997) выявили, что на пролиферативную активность клеток эндотелия in vitro влияют не только ростовые факторы, добавляемые к культуре (основной фактор роста фибробластов, фибронектин, ламелин, протеогликаны, I, III, IV, V и VIII типы коллагена, тромбоспондин, плазминоген, активаторы ткане- и урокиназы), их синергическое влияние при совместном применении, но и матрица, получаемая при предварительной культивации эндотелия роговицы крупного рогатого скота [32, 33].
В исследованиях последних 10–15 лет большое значение придается методам, позволяющим фиксироваться культивированным in vitro эндотелиальным клеткам роговицы к десцеметовой мембране при их введении в переднюю камеру глаза in vivo, где поток водянистой влаги смывает их с задней поверхности роговицы. С целью улучшения адгезии после интракамеральной инъекции используются сила притяжения (положение головы, оптимальное для прикрепления клеток, – роговицей вниз), введение порошка железа или суперпарамагнитных микросфер в клетки и последующее воздействие на роговицу локальным магнитным полем, но эти исследования не дошли до стадии клинических испытаний [34, 35].
В 2012 г. группа ученых из Японии показала, что ингибитор Rho-ассоциированной протеинкиназы (ROCK) Y-27632 конвертирует эндотелиальные клетки роговицы в фенотип, способный быстро адгезироваться к задней поверхности роговицы и восстанавливать высокую плотность эндотелия и прозрачность роговицы in vivo. Была также установлена эффективность применения глазных капель с ингибитором ROCK на ранних этапах повреждения эндотелия. Запущены клинические исследования [36–38].
Ведутся попытки создания биоинженерных аналогов десцеметовой мембраны с пластом эндотелиальных клеток. В качестве субстрата с этой целью группа австралийских ученых выбрала фиброин шелкопряда (Bombyx mori), который был подготовлен в виде прозрачных мембран толщиной 5 мкм [39].
Отечественными учеными с 2017 г. проводятся исследования возможности выделения и культивации клеток эндотелия роговицы с целью разработки оптимального протокола для длительного пассирования и культивирования [40, 41].
Клеточная терапия при заболеваниях сетчатки
По мнению В.В. Максимова, М.А. Лагарькова, С.Л. Киселева (2012), при заболеваниях сетчатки, вызванных утратой функции отдельных типов клеток или их гибелью, наиболее перспективным методом лечения может стать разработка методов получения и трансплантации функционально активных клеток. В качестве источника для получения клеток сетчатки могут быть использованы как стволовые клетки сетчатки взрослых, эмбриональные стволовые клетки (ЭСК), так и индуцированные плюрипотентные стволовые клетки (иПСК). Однако остается открытой проблема продолжительного культивирования и наработки достаточной клеточной массы, так как потенциал самообновления таких клеток значительно падает при увеличении времени культивации, что может быть связано с нарастанием доли асимметричных делений [1].
Также остаются открытыми проблема интеграции полученных и трансплантированных клеток в свои естественные тканевые ниши и последующее за этим правильное выполнение своих функций. Использование ЭСК имеет значительные преимущества в терапии заболеваний сетчатки в отличие от стволовых клеток, полученных от взрослых, так как ЭСК способны к неограниченному делению с сохранением своих свойств и имеют способность к органогенезу in vitro, что позволяет получить сетчатку для трансплантации в виде ткани на любом этапе ее развития [1].
Метод трансплантации клеток пигментного эпителия сетчатки, полученных из ЭСК человека, в 2012 г. в Институте глазной хирургии им. Жюля Штаина (США) дошел до стадии клинических испытаний. Путем направленной дифференцировки ЭСК человека возможно легко получить функциональный пигментный эпителий сетчатки методом сортировки клеток (с использованием автоматических сортеров) по степени накопления пигментных гранул. На доклиническом этапе была доказана безопасность данного метода и проведено множество опытов с трансплантацией пигментного эпителия сетчатки в глаза генетически модифицированных крыс и мышей с фоторецептор-специфической сверхэкспрессией мутантного гена elovl4 и использованием иммунодепрессантов или иммунодефицитных животных. В ходе этих экспериментов авторы доказали интеграцию клеток пигментного эпителия в сетчатку и их долговременное выживание, а также предотвращение дегенерации фоторецепторов и повышение остроты зрения [42, 43].
Группа ученых из Японии в 2017 г. описала 2 случая трансплантации клеток пигментного эпителия сетчатки, полученного из иПСК, пациентам с влажной формой макулодистрофии после удаления неоваскулярной мембраны. Перед трансплантацией клеточный пласт подвергается всесторонней проверке на наличие генетических поломок и аномалий, которые могут привести к опухолеобразованию, и, только удостоверившись в их отсутствии, применяли трансплантацию. На промежуточном этапе этого клинического исследования авторы доказали выживание индуцированных клеток пигментного эпителия сетчатки в течение первого года после трансплантации, улучшение остроты зрения и отсутствие осложнений. Наблюдения за пациентами продолжаются [44].
Отечественные исследователи обратили свое внимание на 3D-клеточные культуры ММСК и пигментного эпителия сетчатки, который они рассматривают как клеточный продукт, обеспечивающий безопасную и длительную нейропротекцию в лечении нейродегенеративных заболеваний органа зрения [16].
Заключение
Морские звезды могут отрастить новые тела, акулы — зубы, ящерицы — конечности. Однако человек на такое еще не способен. С целью восстановления поврежденных органов и тканей, лечения тяжелых заболеваний и сохранения молодости появились технологии регенеративной медицины, которые развиваются рекордными темпами и уже дают впечатляющие результаты.

Регенеративная медицина помогает человеку в сохранении и восстановлении здоровья, молодости и красоты.
Что такое регенеративная медицина
Это особый метод терапии, позволяющий восстановить поврежденные или пораженные болезнями ткани при помощи стволовых клеток человека и животных. Методика появилась около 25 лет назад и активно развивается.
Регенеративная медицина объединяет достижения практической медицины, генной инженерии и биологии.
Ученые считают, что она сможет полностью изменить жизнь людей в будущем.
Когда применяются методы регенеративной медицины
Направление применимо при заболеваниях и травмах, когда шансы не только на выздоровление, но и на выживание низки, когда иные методы лечения уже исчерпали себя. Это онкологические, наследственные и орфанные заболевания. Они часто затрагивают детей и людей среднего возраста.
Направление может применяться и в эстетических или косметологических целях (с целью устранения дефектов после травм и опухолей).
Последние достижения
Регенеративная медицина постоянно развивается: разрабатываются все новые методы лечения и коррекции общего состояния, восстановления поврежденных и утраченных органов. Разработки бывают неудачными, но далеко не всегда.
Гепатология
Лечение больных с тяжелыми формами печеночной недостаточности (циррозом, жировым гепатозом) — одно из ключевых направлений медицины. На экспериментальных моделях оказались эффективны технологии длительной восстановительной регенерации пораженных гепатоцитов при использовании мультипотентных мезенхимальных стромальных клеток (ММСК) костного мозга.
Также с высокой эффективностью опробованы выделенные из печени белковые факторы и инженерные тканевые конструкции билиарного тракта.
Диабет
Исследования обнаружили, что среди клеток жировой ткани имеются те, которые могут делиться и вырабатывать инсулин после пересадки в печень. Опыты проводились на грызунах. В результате печень брала на себя функцию поджелудочной железы и не просто облегчала течение сахарного диабета I и II типов, но и полностью избавляла человека от данного заболевания.
Сердечно-сосудистые болезни
Опробована методика пересадки стволовых клеток из работоспособного сердца свиньи для устранения деструктивных изменений миокарда после инфаркта.
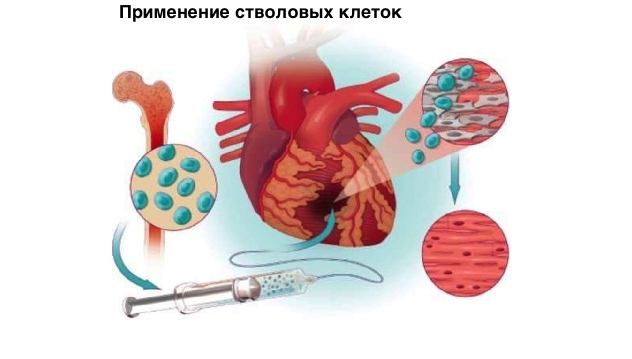
Стволовые клетки применяют в регенеративной терапии сердечных заболеваний.
Ввиду того что сердце свиньи аналогично по строению таковому у человека, появился шанс опробовать технологию на людях. Направление позволит устранить симптомы аритмии или сердечной недостаточности при длительном течении ишемической болезни сердца или несвоевременно оказанной помощи при инфаркте миокарда.
Облысение
Наследственное облысение до сих пор не поддается терапии. Активно проводятся исследования, основанные на клонировании волосяных фолликулов с их последующим внедрением в облысевшие области головы. Затем в зоне воздействия проводится стимуляция роста волос.
Нервные болезни
Эксперименты на грызунах показали, что даже парализованные конечности ввиду поражения нервных тканей позвоночника снова могут стать подвижными. В опытах ученые вводили мышам и крысам эмбриональные клетки в нервные ткани. В скором времени начнутся испытания методики на людях.
Глазные болезни
Внедрение стволовых клеток в роговицу позволяет устранить многочисленную группу врожденных и приобретенных дефектов. Технология разработана и с успехом применяется для лечения посттравматических и постинфекционных рубцов роговицы, ожогов.

Стволовые клетки помогут восстановить зрение.
Уретропластика
Дефекты многослойного эпителия мочевыделительных путей, полученные в ходе поражения опухолью или инородными телами, конкрементами, под влиянием пороков формирования и развития, поддаются терапии.
Трансинженерные системы показали высокую эффективность при использовании в целях регенерации пораженного уротелия. Медицина позволяет полностью восстановить проходимость протоков и функциональную активность эпителия.
Косметология
Для устранения морщин и других признаков старения кожи активно применяются не только плазма, обогащенная тромбоцитами, но и стволовые клетки. После внедрения в кожу они запускают процессы клеточной регенерации, синтез коллагеновых и эластиновых волокон. Кожа становится гладкой и эластичной, мелкие морщины разглаживаются.
Стоматология
Тканевая инженерия внедрена и в челюстно-лицевую хирургию. Препараты на основе аллогенных кератиноцитов и фибробластов организма человека и бычьего коллагена уже одобрены Управлением по санитарному надзору за качеством медикаментов и пищевых продуктов (FDA).
Подобные препараты позволяют восстановить целостность тканей десны и челюстей без использования травматичных лоскутных пересадок.

Стволовые клетки применяют для регенерации зуба и восстановления костной ткани.
Клеточные и тканевые технологии
Сейчас уже доступны такие методы генной терапии, как выращивание и клонирование отдельных тканей, частей и даже целых органов. Создание новых участков может происходить как внутри, так и вне тела человека. При этом риск отторжения минимален.
Биопринтинг (3D-печать) органов и тканей
Печать органических 3D-моделей основана на послойном построении трехмерных структур биологических тканей. На первом этапе принтер печатает материал с учетом разнообразия тканей в клеточном строении. Затем модель помещается в инкубатор, где в течение короткого периода выращивается.
3D-биопринтинг уже опробован. Изготовлены ткани кожных покровов, сердца и кровеносных сосудов, костей.
Выращивание органов
Органоиды используются и для:
- изучения органогенеза;
- моделирования опухолей;
- изучения течения заболевания;
- оценки воздействия лекарственных средств.
Сложность технологии позволяет выращивать только простые по строению органы. К ним относятся влагалище, мочевой пузырь, сосуды.
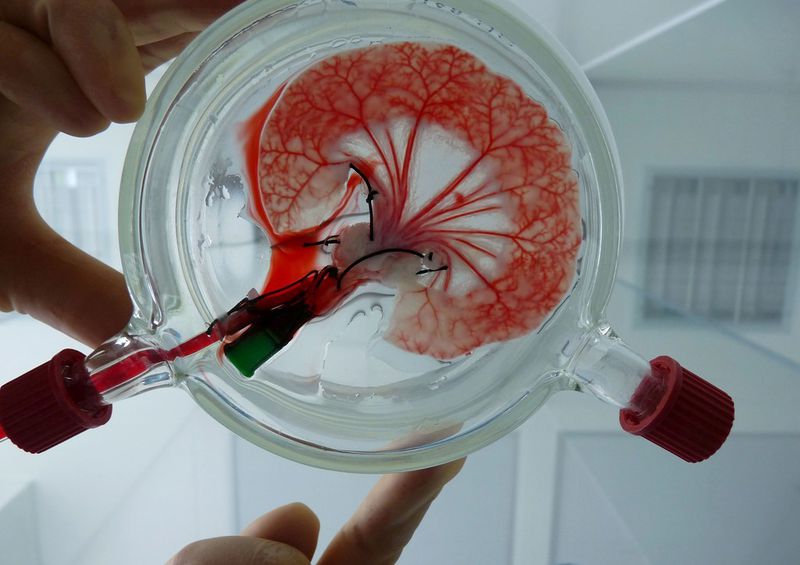
Выращивание органов и тканей из органоидов клетки в лабораторных условиях.
Технологии ксенотрансплантации
Ксенотрансплантация — это пересадка тканей или органов от одного биологического вида другому. Несмотря на сходство между человеком и приматами, приоритетные разработки затрагивают исключительно свиней. Свиньи — это неограниченный и доступный ресурс органов для человека.
Восстановление органов человека
Данное направление активно развивается уже на протяжении десятилетий. Ключевыми достижениями являются:
- Индукция роста костей. Добавление костных опилок (от самого человека или животных) в очаги перелома или разрушения костей стимулирует регенерацию молодой соединительной ткани.
- Восстановление функции поджелудочной железы. Пересадка иммунных клеток жировой ткани в печень позволяет им секретировать гормон — инсулин.
Уже прослежены отдаленные результаты оперативных вмешательств (давностью до 8 лет).
Технологии донорства органов
После пересадки от одного человека другому органы приживаются не всегда. Например, почки остаются только в 75% случаев.
С помощью редактирования генома наука создала CAR-T-клетки, которые подавляют иммунный ответ организма и позволяют приживаться практически любому органу. Так стала возможна аллотрансплантация — пересадка органов иммунологически несхожему организму.
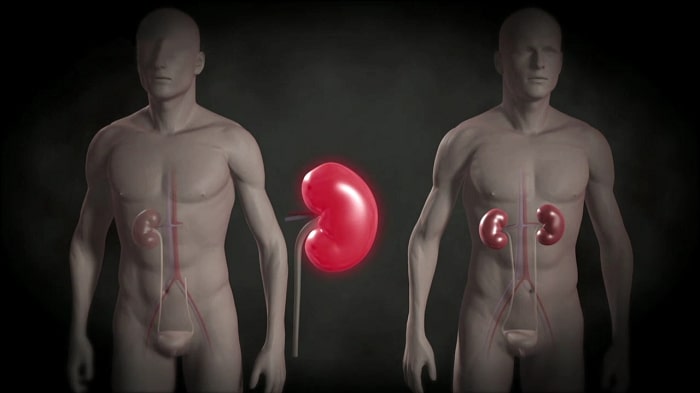
Технология аллотрансплантации позволяет осуществлять пересадку органов от одного организма другому того же вида.
Технологии протезирования
Регенеративная медицина может не только создавать полноценные искусственные протезы некоторых хрящей и суставов, сосудов, полостных органов, но и выращивать их внутри организма.
Активно применяются следующие аутологичные регенеративные концентраты:
- CGF-плазма, обогащенная факторами роста, противовоспалительными факторами и тромбоцитами;
- lipogems (концентраты на основе жировой ткани больного).
Введение данных веществ через небольшой прокол (реже — надрез) к очагу поражения позволяет полностью восстановить разрушенные структуры. Уже возможно восстановление слуха (кохлеарный имплантат) и зрения (бионический глаз).
Переливание молодой крови и парабиоз
На рубеже XX в. ученые смогли соединить кровеносные системы 2 животных разного возраста (молодого и пожилого). Такую модель назвали гетерохроническим парабиозом. Через некоторое время возрастная особь стала более активной, продолжительность ее жизни увеличилась.
Переливание плазмы человека мышам приводит не только к увеличению продолжительности их жизни, но и к снижению частоты нейродегенеративных заболеваний и патологий опорно-двигательного аппарата. Направление считается молодым в науке, в скором времени возможны новые открытия.
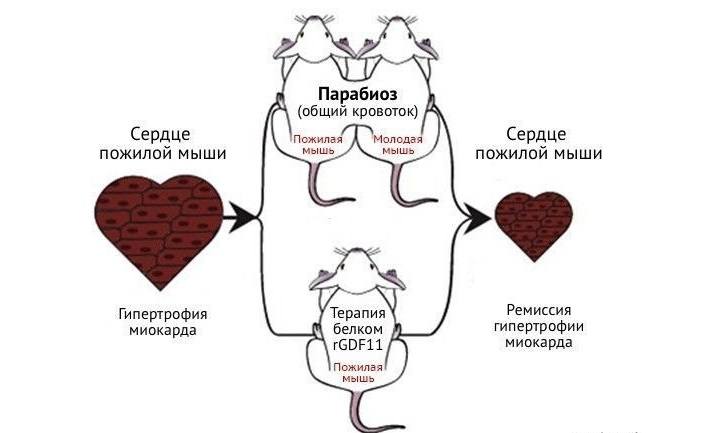
Модель гетерохронического парабиоза, использованная на мышах.
Компания Ambrosia
Компания-стартап Ambrosia недавно применила явление парабиоза на практике. В ходе исследования лицам до 25 лет переливали плазму крови людей старше 35 лет. У некоторых испытуемых было зафиксировано снижение темпов или исчезновение некоторых признаков старения. Специалисты практиковали и введение их собственной пуповинной крови.
В начале 2019 года FDA выпустила пресс-релиз, где высказала обеспокоенность в отношении использования данного метода. Ambrosia прекратила свою деятельность.
Стартап Elevian
Проект Elevian занимался продлением молодости. Специалисты подошли к долголетию с научно обоснованной точки зрения. Ученые выделили молекулу GDF-11 у молодых мышей. После введения данного компонента в кровь возрастных грызунов отмечалось восстановление поврежденных тканей сердечной мышцы, центральной нервной системы, легких и почек. Ученые ставят перед собой задачу восстановить естественную способность организма человека к регенерации, которая была эволюционно утрачена.
Вопрос о безопасности новых технологий
Регенеративная терапия — это метод лечения высокого риска. Направление слишком молодое, чтобы говорить не только о его эффективности, но и о безопасности для здоровья и жизни. История развития фармакологии показала, что ошибки при разработке лекарств могут проявиться даже через десятилетия. Бурно развивающейся отрасли нужно минимум 25-30 лет, чтобы оценить эффективность и безопасность.
Ограничения и запреты
Выделяют 2 типа стволовых клеток:
- эмбриональные (могут стать любой тканью);
- взрослые (дифференцированные).
Взрослые клетки эффективны в целях терапии рака и заболеваний крови, но имеются в организме в ограниченном количестве. Их сложно изъять, а сама процедура имеет ряд сложностей. Самый ценный источник стволовых клеток — эмбрионы (абортированные или на ранней стадии развития). Однако юридические и моральные аспекты запрещают подобную практику в большинстве стран.
Перспективы лечения стволовыми клетками
Регенеративная медицина помогла вылечить детей от лейкоза, эффективно побороть гемофилию, восполнить посттравматические дефекты или нарушения развития органов. Уже сегодня проводятся операции по пластике половых органов, восстановлению сенсорных функций, устранению нарушений функций сердца.
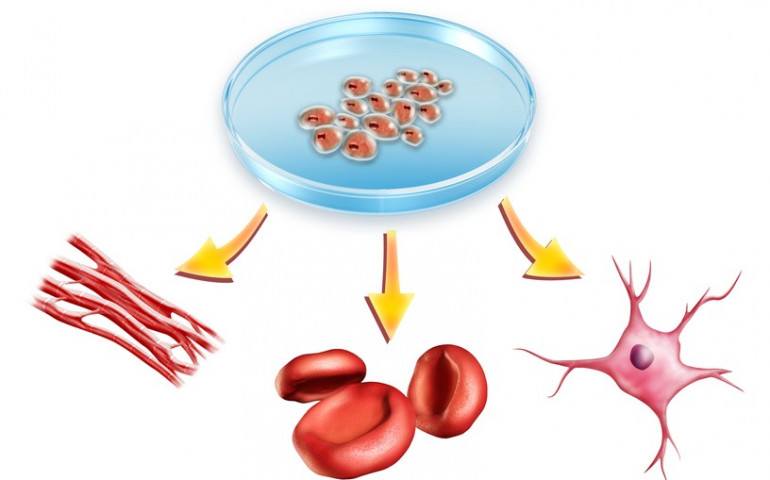
Стволовые клетки не только помогают заместить старые клетки новыми, но и могут восстановить поврежденную ткань.
Ученые ставят перед собой практически непреодолимую цель — сделать человека здоровым и бессмертным, избавить его от физических и моральных страданий.
Прогнозы на ближайшее будущее
Сперва ученые пытались внедрять стволовые клетки напрямую в ткани для восстановления миокарда или регенерации центральной нервной системы. Затем начались оправданные вмешательства внутрь клетки и генома.
В ближайшие 5-10 лет регенеративная медицина будет развиваться опережающими темпами. Главное — обеспечить для этого единство научных подходов, инвестиций и государственных интересов, а также должное регулирование всех действий.
Читайте также:

