История открытия газовых законов кратко
Обновлено: 17.05.2024
1. Кем и когда проводился опыт, в чем состояла его цель
Исследования по расширению воздуха при нагревании проводил Г. Амонтон. Позднее аналогичные опыты ставили А. Вольта, Д. Дальтон, Дж. Пристли, Т. Соссюра и др.
Считается, что первые удовлетворительные измерения при исследовании теплового расширения газов получил в 1801 г. английский физик и химик Джон Дальтон (1766–1844 гг.). Он обнаружил, что кислород, водород и углекислый газ при нагревании вели себя одинаково.
Рис. 1. Схема установки Дальтона
Аналогичный вывод получил Ж. Л. Гей-Люссак в 1802 г. Но его утверждение было более определенным, чем высказывание Д. Дальтона. Видимо, поэтому закон о тепловом расширении газов называют не именем Д. Дальтона, а именем Ж. Л. Гей-Люссака.
Прибор, которым пользовался Гей-Люссак, показан на Рис. 2. Газ, тщательно осушенный, находится в баллончике. В трубке находится капля ртути, запирающая газ. Трубки расположены горизонтально, поэтому изменения давления при расширении не происходит.
Рис. 2. Схема установки Гей-Люссака
Пятнадцатью годами раньше Гей-Люссака (в 1787 г.) исследования этого вопроса были, без какой бы то ни было публикации, предприняты французским физиком Жаком Шарлем (1746–1823 гг.). Шарль нашел, что кислород, азот, углекислый газ и воздух расширяются одинаково в интервале температур между 0 и 100 ºС. Гей-Люссак знал о работах коллеги и настоял на том, чтобы второй газовый закон носил имя Жака Александра Сезара Шарля. Следует отметить, что в некоторых странах, в том числе и в России, этот закон известен все же как закон Гей-Люссака. В публикациях по истории науки приоритет открытия третьего газового закона – закона изменения давления газа в зависимости от температуры – обычно не обсуждается. Исследованием этой зависимости, как и зависимости объема газа от температуры, занимались многие ученые, изучавшие свойства газов в XVII–XVIII столетиях. История открытия закона теплового расширения газов связана с историей изобретения и усовершенствования термометров.
Усовершенствованием воздушного термометра Г. Галилея занимался Г. Амонтон – французский физик, член Парижской академии наук (1699 г.). В 1702 г. он сконструировал термометр, очень похожий по своей принципиальной схеме на современный газовый. Термометр Г. Амонтона представлял собой U-образную стеклянную трубку, более короткое колено которой заканчивалось резервуаром, содержащим воздух. В длинное колено наливалась ртуть в количестве, необходимом для поддержания постоянства объема воздуха в резервуаре. По высоте столба ртути определялась температура воздуха в резервуаре.
Рис. 3. Термометр Амантона
Интересно отметить, что, работая с этим инструментом, именно Амонтон нашел прямо пропорциональную зависимость между температурой и давлением газа и пришел к понятию абсолютного нуля, который по его данным соответствовал температуре в –239,5 °С (1703 г.).
В 1954 X Генеральная конференция по мерам и весам установила термодинамическую температурную шкалу с одной реперной точкой — тройной точкой воды, температура которой принята 273,16 К (точно), что соответствует 0,01 °C, так что по шкале Цельсия абсолютному нулю соответствует температура −273,15 °C.
2. Приборы и материалы, необходимые для постановки опыта, принципиальная схема опытной установки
Установки для опытов по исследованию зависимости давления газа от температуры при постоянном объеме были достаточно сложными.
Рис. 4. А – газовый термометр постоянного давления (Regnault). Б – газовый пирометр
Рассмотрим принципиальную схему экспериментальной установки для исследования зависимости давления газа от температуры при постоянном объеме. Основной частью такой установки является большая колба, в которой находился газ. Колба помещается в сосуд с водой. Об изменении давления газа можно судить по показаниям ртутного манометра, соединенного с колбой. Температура газа измеряется с помощью ртутного термометра.
Рис. 5. Современная установка для проверки закона Ж. Гей-Люссака в условиях школьной лаборатории
Ж. Шарль исследовал зависимость давления от температуры для следующих газов: кислород, азот, углекислый газ и воздух.
3. Порядок проведения опыта
Наполнив колбу тающим льдом, Шарль измерял давление, соответствующее температуре 0 ºС. Затем температура воды в большом сосуде менялась, что приводило к изменению высоты столба ртути в манометре. Подогревая воду в сосуде, окружающем колбу, Шарль отмечал температуру газа по термометру, а соответствующее давление – по манометру.
Попытки ученых исключить вредное воздействие побочных эффектов на ход эксперимента и приводили, как правило, к усложнению конструкции установки.
4. Основные результаты опыта
Опыты Ж. Шарля показали следующие результаты.
Приращение давления газа некоторой массы при нагревании на 1 ºС составило определенную часть αpтого давления, которое имел газ при температуре 0 ºС. Таким образом, приращение давления оказалось пропорциональным приращению температуры.
Величину αp называют температурным коэффициентом давления. Исследовав ряд газов, Шарль получил для них примерно одинаковое значение температурного коэффициента давления, а именно величину, равную примерно 1/273 ºС –1 .
Таким образом, давление некоторой массы газа при нагревании на 1 ºС при неизменном объеме увеличивается на 1/273 часть давления, которое эта масса газа имела при 0 ºС.
5. Объяснение результатов опыта
В современной формулировке этот закон звучит следующим образом:
При неизменном объеме отношение давления данной массы газа к его абсолютной температуре есть величина постоянная.
Математически закон Ж. Шарля можно записать в виде:
Закон Шарля может быть записан в виде:
где P0 – давление газа при T = T0 = 273,15 К (то есть при температуре 0 °С). Коэффициент, равный 1/273,15 К –1 , называют температурным коэффициентом давления.
На рисунке представлена зависимость давления данной массы газа от его температуры. Для различных температур газа расположение кривой зависимости на координатной плоскости различно. Изохоры, изображающие зависимость P от T для газа, который подчиняется закону Шарля, представляют собой прямые линии, располагающиеся на графике тем выше, чем меньше объем.
Рис. 6. Зависимость объема данной массы газа от его температуры для различных значений давления газа при изобарном процессе
Закон Шарля справедлив только для идеального газа. Он применим с определенной степенью точности к реальным газам при низких давлениях и невысоких температурах (например, атмосферный воздух, продукты сгорания в газовых двигателях и пр.)
Объяснение закону, установленному Шарлем, может быть дано с позиций молекулярно-кинетических представлений о строении вещества.
С точки зрения молекулярной теории возможны две причины увеличения давления данного газа: во-первых, может увеличиться число ударов молекул за единицу времени на единицу площади; во-вторых, возможно увеличение импульса, передаваемого при ударе стенки сосуда одной молекулой. И та, и другая причина требуют увеличения скорости молекул (при этом объем данной массы газа остается неизменным). Отсюда становится ясным, что повышение температуры газа как макрохарактеристики соответствует увеличению скорости беспорядочного движения молекул как характеристики микромира.
При очень высоких давлениях увеличивается взаимодействие между молекулами газа и наблюдаются отклонения от линейного закона Шарля.
Закон Шарля выводится как частный случай из уравнения Менделеева–Клапейрона:
где R – универсальная газовая постоянная (R = 8,31441 Дж/моль∙К), ν – число молей вещества, P – давление газа, V – объем газа, T – температура газа.
Он может быть получен как следствие основного уравнения молекулярно-кинетической теории идеального газа:

Опыты показывают, что основные макроскопичекие параметры газа (объем, температура, давление) тесно взаимосвязаны. При исследовании этой связи были открыты закономерности, названные газовыми законами. Рассмотрим кратко данную тему.
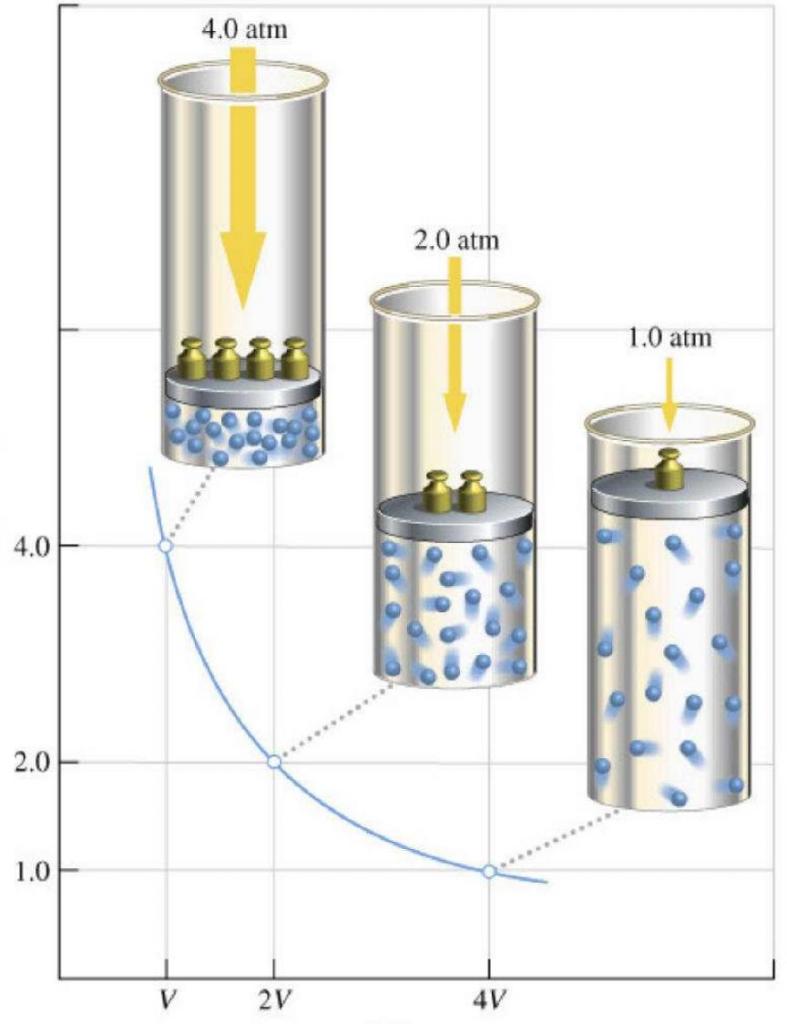
Закон Бойля-Мариотта
Исторически первым открытым газовым законом стал закон Бойля-Мариотта. В 1660 г Р. Бойль (и несколько позже Э. Мариотт) установил, что газ ведет себя подобно сжатой пружине, и увеличивает давление пропорционально уменьшению объема. Таким образом, для фиксированного количества газа при фиксированной температуре произведение давления и объема остается постоянным:
Выполнение этого закона совершается не мгновенно. При быстром увеличении давления объем уменьшается менее, чем пропорционально давлению, но через некоторое время происходит дополнительное уменьшение объема. Позже было установлено, что происходит это потому, что при быстром сжатии газа повышается температура. Если же газ сжимать медленно, чтобы температура оставалась постоянной, то отклонений от закона не наблюдается.
Таким образом, закон Бойля-Мариотта выражает зависимость давления от объема газа при фиксированной температуре. График этой зависимости называется изотермой и в координатах $V–p$ представляет собой гиперболу, располагающуюся тем выше, чем выше температура. В других координатах изотерма является горизонтальной или вертикальной прямой.
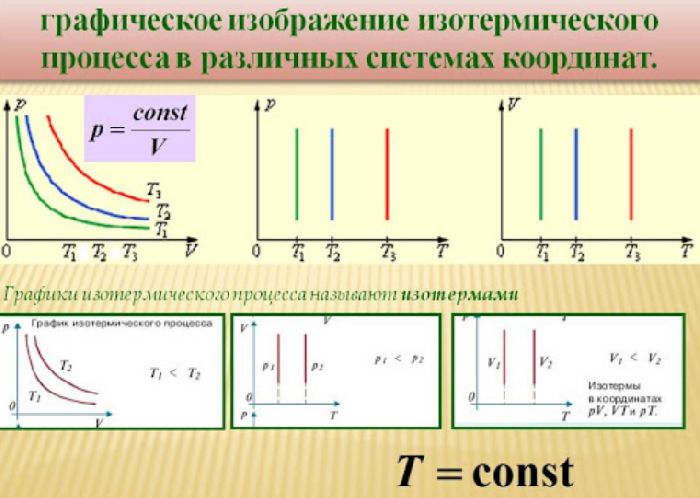
Рис. 1. Примеры изотерм в разных координатах.
Закон Шарля
Хронологически вторым открытым газовым законом является закон, открытый Ж. Шарлем в 1787 г.
Было установлено, что давление фиксированного количества газа при фиксированном объеме изменяется прямо пропорционально его температуре. Отношение этих величин постоянно:
Данный процесс называется изохорным, и его график в координатах $Т-p$ является наклонной прямой, направленной из начала координат. Прямая поднимается тем круче, чем меньше объем газа. В других координатах график изохоры является горизонтальной или вертикальной прямой.
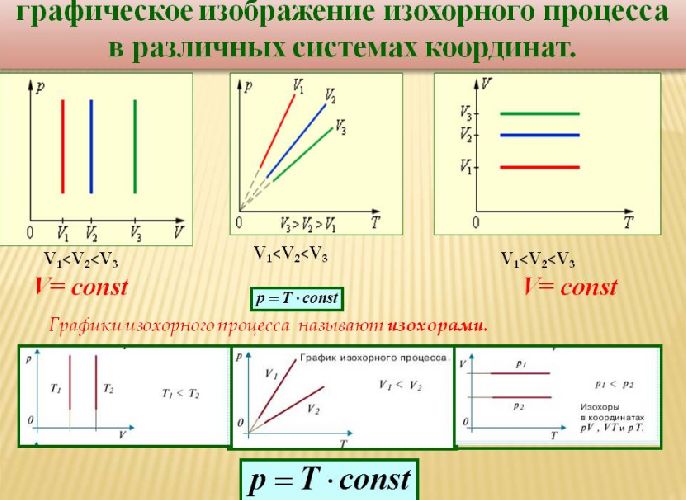
Рис. 2. Примеры изохор в разных координатах.
Закон Гей-Люссака
В 1802 г Ж. Гей-Люссаком был опубликован третий газовый закон, описывающий изменение состояния фиксированного количества газа при постоянном давлении. Он гласит, что объем фиксированного количества газа при постоянном давлении пропорционален температуре. Отношение этих величин постоянно:
Такой процесс был назван изобарным, и его график в координатах $Т-V$ является наклонной прямой, направленной из начала координат. Прямая поднимается тем круче, чем меньше давление газа. В других координатах график изобары является горизонтальной или вертикальной прямой.
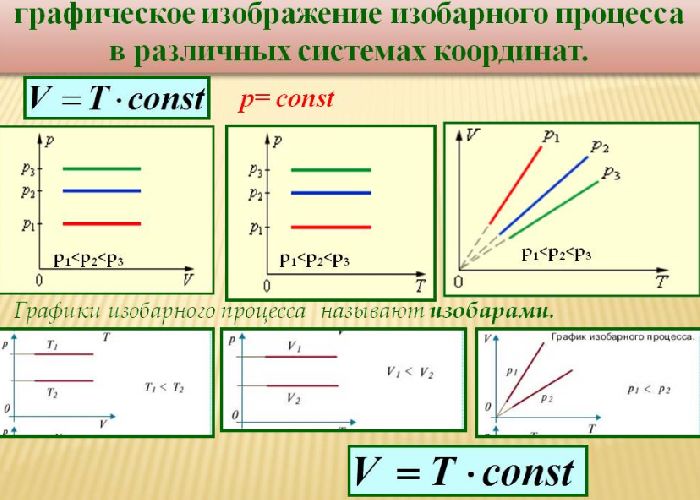
Рис. 3. Примеры изобар в разных координатах.
Уравнение Менделеева-Клапейрона
В 1834 г Э. Клапейрон, исследуя три перечисленных закона, и обобщая их, получил уравнение, названное его именем, и связывающее все три макроскопических параметра газа:
Это уравнение хорошо подходило для описания изменений для фиксированного количества определенного газа. Однако, константа, входящая в него, оказывалась для каждого газа разной, зависящей от исследуемого количества. Необходимо было получить более универсальную формулу.
Основой такой универсальной формулы явился закон, открытый в 1811 г. А.Авогадро. Он гласит, что равные объемы газов при равных давлениях и температурах содержат одинаковое число молекул.
В 1874 г Д. Менделеев установил, что постоянная, присутствующая в уравнении Клапейрона, прямо пропорциональна этому числу. А значит, можно ввести универсальный коэффициент пропорциональности R, физический смысл которого состоит в том, что это количества тепла, которое надо передать одному молю газа для того, чтобы нагреть его на 1К. С использованием этой универсальной газовой постоянной, уравнение приняло вид:
- $p,V,T$ – макроскопические газовые параметры;
- $m$ – масса газа;
- $М$ – молярная масса газа (масса моля газа, содержащего $N_A=6×10^$ молекул);
- $R$ – универсальная газовая постоянная, равная $R=8.31 $.
Уравнение состояния газа в таком виде связывает макроскопические термодинамические параметры идеального газа (объем, температуру, давление) с его физическими параметрами (массой и молярной массой), и называется уравнением Менделеева-Клапейрона. Основные газовые законы являются его следствием.
Что мы узнали?
Газовые законы связывают два макроскопических термодинамических параметра газа. Третий параметр, а также вид газа и его количество предполагается фиксированным. Обобщением газовых законов является уравнение Менделеева-Клапейрона, в котором термодинамические параметры связываются с физическими параметрами газа.
Ученые начали исследовать поведение газов при различных внешних условиях со второй половины XVII века. В течение почти двух веков были экспериментально открыты основные газовые законы в физике, анализируя которые Эмиль Клапейрон в 1834 году записал универсальное уравнение состояния. Рассмотрим подробнее в статье эти законы.
Идеальные газы
Прежде чем переходить к описанию законов газов в физике, дадим характеристику модели, на которую они опираются. Речь идет о модели идеального газа. Согласно ей, рассматриваемое агрегатное состояние материи состоит из невзаимодействующих друг с другом частиц (атомов и молекул), которые полагают безразмерными. Частицы движутся со скоростями несколько сотен метров в секунду в разных направлениях. Их средняя кинетическая энергия характеризует температуру всей системы, а столкновения со стенками сосуда приводят к появлению давления в ней.
Поведение реальных газов, которые находятся при не слишком больших давлениях и температурах в несколько сотен кельвин, хорошо согласуется с предсказаниями описанной модели. Например, земной воздух можно считать идеальной смесью газов.
Закон Бойля-Мариотта

Рассматривая с точки зрения термодинамики газы, газовый закон Роберта Бойля и Эдма Мариотта следует назвать в первую очередь, поскольку он был экспериментально открыт раньше всех остальных законов (вторая половина XVII века). Он гласит, что при постоянной температуре в закрытой газовой системе любое изменение объема приводит к обратно пропорциональному изменению давления. Математически закон записывается в следующих двух формах:
График закона Бойля-Мариотта называется изотермой. Она представляет собой гиперболическую зависимость функций P(V) или V(P).
Законы Шарля и Гей-Люссака
Оба закона газов в физике были открыты примерно в одно и то же время (конец XVIII - начало XIX веков) французами Шарлем и Гей-Люссаком.
Закон Шарля описывает поведение газовой системы во время изобарного процесса, то есть перехода между равновесными состояниями при постоянном давлении. Закон гласит, что при увеличении температуры в указанных условиях объем растет прямо пропорционально. Математически его записывают следующим образом:
Закон Шарля можно получить экспериментально, если в цилиндр под подвижный поршень закачать некоторый объем газа, а затем нагревать систему и фиксировать в ней температуру и объем.
Третий основной газовый закон носит фамилию Гей-Люссака. Он описывает поведение системы во время изохорного процесса, то есть при постоянном объеме. Если в предыдущем случае газ закачивался в цилиндр с подвижным поршнем, то в законе Гей-Люссака объем цилиндра фиксирован. Изменяются лишь давление и температура. Математически его выражают так:
Видно, что эта зависимость ничем не отличается от предыдущей. Только в данном случае вместо величины V стоит P.
Графики изобары (P=const) и изохоры (V=const) представляют собой прямые линии с положительным наклоном, поскольку увеличение объема (давления) всегда приводит к возрастанию абсолютной температуры. Важно запомнить, что приведенные в этом пункте формулы справедливы только в том случае, если в них использовать температуру в единицах абсолютной шкалы, то есть в кельвинах.
Закон или принцип Авогадро
В начале того же XIX века итальянец Амедео Авогадро, исследуя поведение разных газов, взятых в разных количествах, пришел к удивительному заключению. Ученый показал экспериментально, что разные газы при одинаковых давлениях и температурах занимают объем, пропорциональный количеству вещества в молях. В виде формулы этот принцип представляется так:
Важный вывод, который можно сделать из этого закона газов в физике, заключается в отсутствии в нем зависимости от химического состава. Отметим, что на принципе Авогадро основан закон парциальных давлений для смеси идеальных газов, который носит фамилию Дальтона.
Закон Клапейрона-Менделеева

Он также называется законом состояния газов и обобщает экспериментальный опыт всех предыдущих законов. Соответствующее уравнение впервые записал Эмиль Клапейрон в 1834 году, а Менделеев ввел постоянную универсальную для газов R. Уравнение Клапейрона-Менделеева имеет вид:
Каждый школьник может получить из него любой из перечисленных выше законов газов в физике, если зафиксирует две соответствующие переменные.
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессомназывают изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева – Клапейрона:
![]()
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами.
Обозначив константу буквой , запишем функциональную зависимость давления от объема при изотермическом процессе:
![]()
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах и соответственно.

Рис.1. Графики изотермических процессов в различных координатах
Закон Гей-Люссака (изобарный процесс)
Изобарным процессомназывают изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
![]()
Для двух состояний газа этот закон запишется в виде:
![]()
Этот закон также следует из уравнения Менделеева – Клапейрона:
![]()
Графики зависимости параметров газа при постоянном давлении называются изобарами.

Рассмотрим два изобарных процесса с давлениями и . В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).
Определим вид графика в координатах .Обозначив константу буквой , запишем функциональную зависимость объема от температуры при изобарном процессе:
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах является прямая, проходящая через начало координат (рис.2, в). В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары на рис.2, в) показаны пунктиром.

Рис.2. Графики изобарных процессов в различных координатах
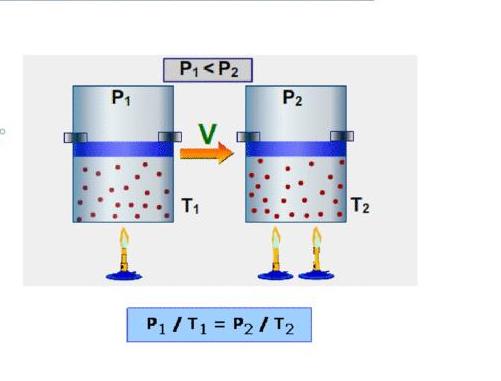
Закон Шарля (изохорный процесс)
Изохорным процессомназывают изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
![]()
Для двух состояний газа этот закон запишется в виде:
![]()
Этот закон также можно получить из уравнения Менделеева – Клапейрона:
![]()
Графики зависимости параметров газа при постоянном давлении называются изохорами.

Рассмотрим два изохорных процесса с объемами и . В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).
Для определения вида графика изохорного процесса в координатах обозначим константу в законе Шарля буквой , получим:
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).

Рис.3. Графики изохорных процессов в различных координатах
Примеры решения задач
| Задание | До какой температуры нужно изобарически охладить некоторую массу газа с начальной температурой , чтобы объем газа уменьшился при этом на одну четверть? |
| Решение | Изобарный процесс описывается законом Гей-Люссака: |
![]()
По условию задачи объем газа вследствие изобарного охлаждения уменьшается на одну четверть, следовательно:
![]()
![]()
откуда конечная температура газа:
![]()
![]()
.
![]()
| Задание | В закрытом сосуде находится газ под давлением 200 кПа. Каким станет давление газа, если температуру повысить на 30%? |
| Решение | Так как сосуд с газом закрытый, объем газа не меняется. Изохорный процесс описывается законом Шарля: |
![]()
По условию задачи температура газа повысилась на 30%, поэтому можно записать:
![]()
Подставив последнее соотношение в закон Шарля, получим:
![]()
![]()
Па.
![]()
| Задание | В кислородной системе, которой оборудован самолет, имеется кислорода при давлении Па. При максимальной высоте подъема летчик соединяет с помощью крана эту систему с пустым баллоном объемом . Какое давление установится в ней? Процесс расширения газа происходит при постоянной температуре. |
| Решение | Изотермический процесс описывается законом Бойля-Мариотта: |
откуда давление, установившееся в системе:
![]()
![]()
Читайте также:

