Использование днк технологий в медицине кратко
Обновлено: 05.07.2024
Методология прикладного использования ДНК-технологий ДНК-технология или генная (генетическая) инженерия — направление исследований в генетике, в рамках которого разрабатывают приемы, позволяющие по заранее намеченному плану перестраивать геном организмов
Использование ДНК-технологий для разработки вакцин
Использование ДНК-технологий для разработки вакцин Перспективным направлением является создание трансгенных растений, несущих гены белков, характерных для бактерий и вирусов, вызывающих инфекционные заболевания. При потреблении сырых плодов и овощей, несущих такие
Использование клематисов в озеленении
Глава 27 Микробиология — основа новейших технологий
Глава 27 Микробиология — основа новейших технологий Всякая наука черпает свои права на существование в возможности так или иначе оказаться полезной человечеству в качестве науки прикладной. В. Оствальд Прошло уже достаточно времени с тех пор, как человек начал
Революция в медицине
Революция в медицине Для того чтобы антибиотик можно было использовать как лекарственное средство, он должен удовлетворять многим требованиям: действовать только на болезнетворные микроорганизмы, быть стабильным, легко усваиваться организмом, а после выполнения своей
Применяется ли в медицине искусственное охлаждение?
Применяется ли в медицине искусственное охлаждение? Идея замораживания организмов с постоянной температурой тела (животных и людей) с целью добиться полной нечувствительности перед последующим хирургическим вмешательством не нова. Еще в 1862 г. А. О. Вальтер установил,
Применение ферментов в медицине
Применение ферментов в медицине Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Кроме того, ферменты используют в качестве
Применение гормонов в медицине
Применение гормонов в медицине Гормоны применяют для восполнения их дефицита в организме при гипофункции эндокринных желез (заместительная терапия): 1. инсулин – при сахарном диабете;2. тироксин – при гипофункции щитовидной железы;3. соматотропин – при гипофизарной
Краткий исторический очерк о медицине
Краткий исторический очерк о медицине Весь мир согласится с тем, что Гиппократа можно считать самым выдающимся врачом античного мира, а некоторые считают его даже и самым великим врачом современности. Возможно, это и правильно. Он жил в V в. до н. э. и был, по словам
Обращение к нетрадиционной медицине
1.3. Сопоставление естественных и производственных технологий
1.3. Сопоставление естественных и производственных технологий Сопоставление определений производственных технологий и естественных процессов позволяет заключить, что лишь первые имеют отношение к проблемам, рассматриваемым технологией. Действительно, в 1901 г. в статье
1.5. Экзотрофия как модель для анализа естественных технологий
1.5. Экзотрофия как модель для анализа естественных технологий В биологии решение даже наиболее важных и общих проблем часто зависит от счастливого выбора подходящих экспериментальных моделей, т.е. объектов исследования. Примерами могут служить гигантский аксон
Глава 4. ЭВОЛЮЦИЯ ЕСТЕСТВЕННЫХ ТЕХНОЛОГИЙ НА ПРИМЕРЕ ЭКЗОТРОФИИ
Глава 4. ЭВОЛЮЦИЯ ЕСТЕСТВЕННЫХ ТЕХНОЛОГИЙ НА ПРИМЕРЕ ЭКЗОТРОФИИ Экзотрофия, и в том числе пищеварение, была охарактеризована как некоторая естественная технология. В этой главе такая технология будет рассмотрена в эволюционном аспекте.Было бы привлекательно думать, что
4.7. Принцип эффективности как основа естественных технологий
4.7. Принцип эффективности как основа естественных технологий Насколько известно, наибольшие затруднения встречаются не тогда, когда требуется объяснить появление признака, полезного в данных условиях, а в тех случаях, когда необходимо понять исчезновение структуры или
Глава 8. ОБЩИЕ ПРИНЦИПЫ ЕСТЕСТВЕННЫХ ТЕХНОЛОГИЙ
Глава 8. ОБЩИЕ ПРИНЦИПЫ ЕСТЕСТВЕННЫХ ТЕХНОЛОГИЙ Признание естественных технологий влечет за собой многочисленные теоретические и практические следствия, касающиеся биологии, промышленности, сельского хозяйства, медицины и т.д. Наука становится технологичной, а
10.2. Использование земельных ресурсов
10.2. Использование земельных ресурсов Почвенный покров Приморского края и масштабы его деградации[2]Приморский край входит в южно-таежную лесную Амуро-Уссурийскую и лесостепную Амуро-Ханкайскую области и горную Южно-Сихотэ-Алиньскую провинцию. Горы занимают около 72 %

- получать рекомбинантные РНК и ДНК;
- выделять гены из организма (клеток);
- осуществлять манипуляции с генами и вводить их в другие организмы.
Плазмида — внехромосомная молекула ДНК бактерий или дрожжей, как правило, кольцевая, способная к автономной репликации. В генной инженерии используется как вектор.
Значение генной инженерии для медицины
Продукты генной инженерии как‑то исподволь, но прочно вошли в медицинскую практику: лекарства для лечения редких болезней, рекомбинантный инсулин, вакцины против вируса гепатита В — без них современному врачу трудно представить себе мир. Генно-инженерными методами производят некоторые высокоселективные аллергены для кожных проб, некоторые реагенты для иммуноферментного анализа и многое другое. На этапе доклинических испытаний медикаментов приносятся в жертву миллионы генетически измененных животных.
Ниже в порядке усложнения технологии и степени отрыва от реальности представлены основные примеры применения генной инженерии в медицине.
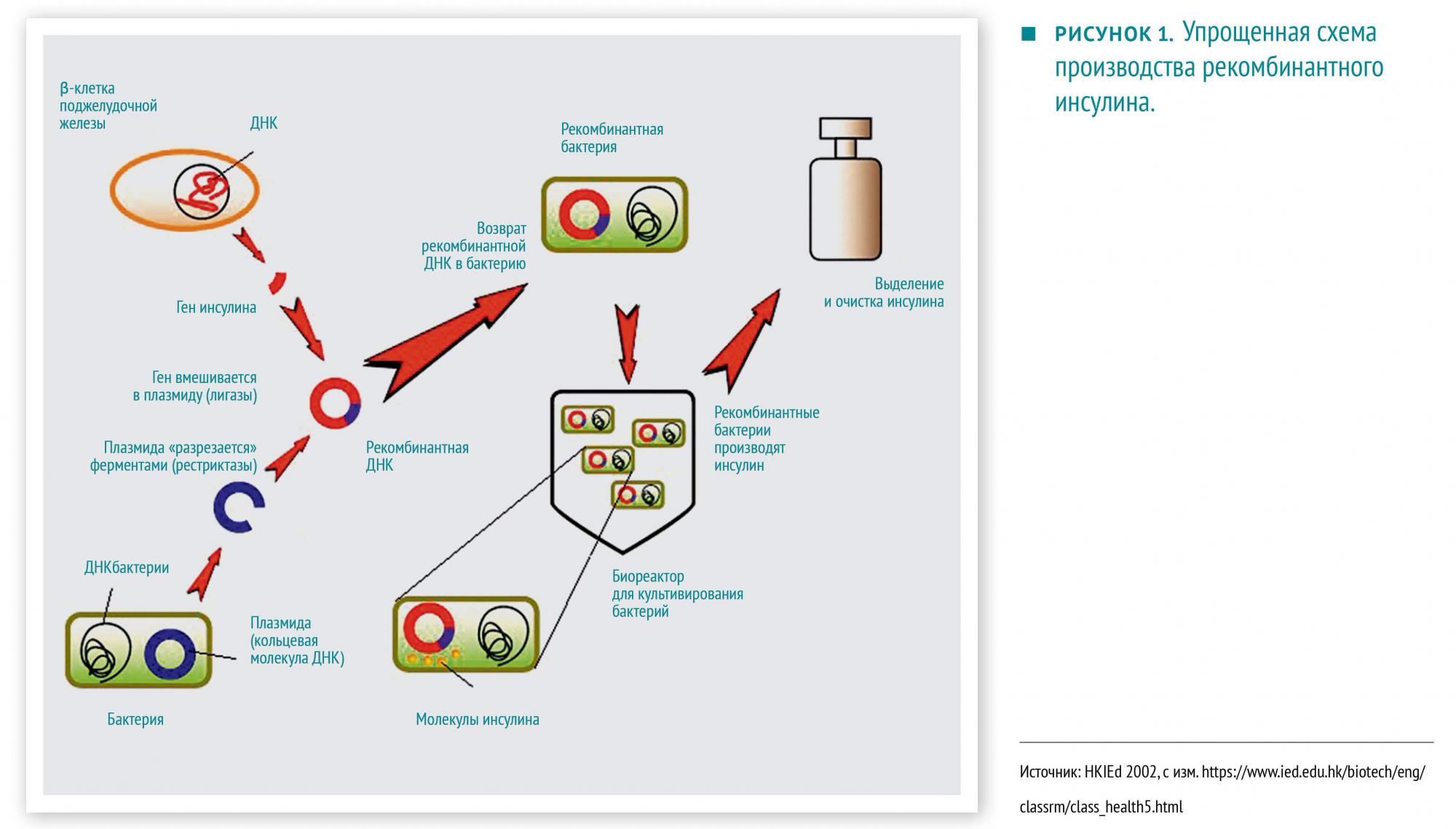
Сегодня на вооружении у врачей есть ряд препаратов, для которых критически важно точное соответствие аналогам в организме. Это препараты заместительной терапии при эндокринологических заболеваниях, гематологических болезнях (эритропоэтин, гранулоцитарный колониестимулирующий фактор, факторы свертывания крови, некоторые моноклональные антитела и др.), вирусных инфекциях (интерфероны), инфаркте миокарда и ишемическом инсульте (фибринолитики) и многих других.
- Идентичность веществ по структуре человеческим. Инсулин, производившийся из поджелудочных желез свиней и крупного рогатого скота, отличался от человеческого по одной и трем аминокислотам, соответственно, это часто приводило к нежелательным реакциям.
- Более низкая цена и удобное производство. Для получения 200 г сухого вещества того же инсулина требуется поджелудочных желез от более чем 6000 коров (или свиней). То же количество может быть произведено бактериями, содержащимися в 1000 л культуральной жидкости.
- Отказ от специфического сырья, которое полностью не очищается, например, гипофизы трупов использовались для получения соматотропного гормона, а моча женщин в менопаузе — традиционный источник фолликулостимулирующего и лютеинизирующего гормонов.
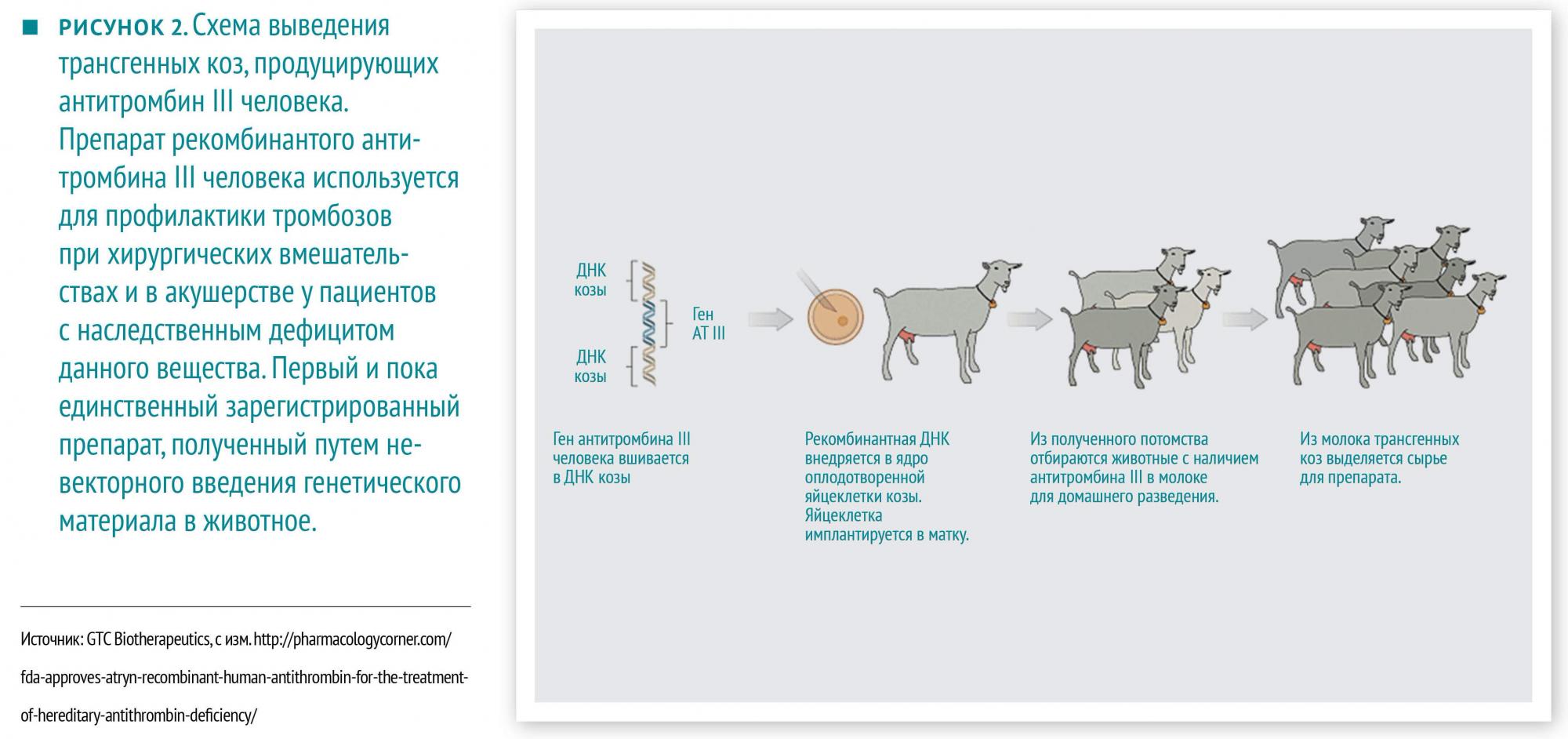
Дальнейшее развитие данной отрасли науки привело к появлению генной терапии. Тут уже всё по‑взрослому, хотя пока и экспериментально. Устраняются посредники типа бактерий, коз и бананов. Как правило, так пытаются лечить тяжелые и редкие наследственные или спорадически возникающие заболевания, патогенез которых обусловлен дефектом какого‑либо одного гена, например, первичные иммунодефициты. При этом другие методы лечения неэффективны или труднодоступны, и терять, в общем, нечего. Результаты впечатляющие, но и цена нежелательных реакций высока.
В начале 2000‑х гг. в Англии и Франции проводились клинические испытания генной терапии Х-сцепленного тяжелого комбинированного иммунодефицита, при котором нарушен синтез общего рецептора нескольких цитокинов, отвечающих за дифференцировку и пролиферацию лимфоцитов. При отсутствии аллогенной трансплантации гемопоэтических стволовых клеток дети умирают от тяжелых инфекций в 1‑й год жизни. В ходе испытаний 20 маленьким пациентам были трансплантированы собственные (то есть дефектные) стволовые клетки костного мозга, в которые был введен ретровирусный вектор, несущий ген нормального белка рецептора и вирусный промотор. Блестящие результаты — восстановление функций иммунной системы, отсутствие рецидива в течение всего периода наблюдения (4–11 лет) — были омрачены развитием Т-клеточного острого лимфобластного лейкоза у 5 детей (известно, что один ребенок погиб). Выяснилось, что ген белка и вирусный промотор у всех 5 заболевших встроились в ДНК рядом с протоонкогенами, т. е. генами, при усилении экспрессии которых возможно неконтролируемое деление клеток. Встраивание генного материала в ДНК хозяина в наше время в основном дело случая.
Первые ошибки были учтены, в настоящее время исследователи выбирают неонкогенные вирусы с известными местами встраивания в человеческую ДНК, или плазмиды.
В общем, в генной инженерии остается достаточно технологических трудностей, иммунологического несоответствия, опасности инфицирования человека вирусами животных с потенциальным появлением новых болезней. Всего этого упрямые и беспринципные ученые не очень‑то и боятся. Понятно, что у человечества хватит мозгов, чтобы как‑то решить эти проблемы, остается надеяться, что хватит ума не наделать новых.
Трансфекция клеток
Методы генной терапии
Существует два основных подхода, различающиеся природой клеток-мишеней: 1. Фетальная, при которой чужеродную ДНК вводят в зиготу (оплодотворённую яйцеклетку) или эмбрион на ранней стадии развития; при этом ожидается, что введённый материал попадёт во все клетки реципиента (и даже в половые клетки, обеспечив тем самым передачу следующему поколению). В нашей стране она фактически запрещена ; 2. Соматическая, при которой генетический материал вводят уже родившемуся в неполовые клетки и он не передаётся половым клеткам. Генная терапия in vivo основана на прямом введении клонированных (размноженных) и определенным образом упакованных последовательностей ДНК в определённые ткани больного. Особенно перспективным для лечения генных болезней in vivo представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения лёгочных заболеваний (муковисцидоз, рак лёгких). Разработке программы генной терапии предшествует много этапов. Это и тщательный анализ тканеспецифической экспрессии соответствующего гена (т. е., синтеза на матрице гена какого-то белка в определённой ткани), и идентификация первичного биохимического дефекта, и исследование структуры, функции и внутриклеточного распределения его белкового продукта, а также биохимический анализ патологического процесса. Все эти данные учитываются при составлении соответствующего медицинского протокола.
Прямая доставка и клеточные носители терапевтических генов
Судьба гена после его попадания в клетку
Заключение
Обзор данных позволяет прийти к заключению, что, несмотря на усилия многих лабораторий мира, все уже известные и испытанные in vivoи in vitro векторные системы далеки от совершенства . Если проблема доставки чужеродной ДНК in vitro практически решена, а ее доставка в клетки-мишени разных тканей in vivo успешно решается (главным образом путем создания конструкций, несущих рецепторные белки, в том числе и антигены, специфичные для тех или иных тканей), то другие характеристики существующих векторных систем – стабильность интеграции, регулируемая экспрессия, безопасность – все еще нуждаются в серьезных доработках. Прежде всего, это касается стабильности интеграции. До настоящего времени интеграция в геном достигалась только при использовании ретровирусных либо аденоассоциированных векторов. Повысить эффективность стабильной интеграции можно путем совершенствования генных конструкций типа рецептор-опосредованных систем либо путем создания достаточно стабильных эписомных векторов (то есть ДНК-структур, способных к длительному пребыванию внутри ядер). В последнее время особое внимание уделяется созданию векторов на базе искусственных хромосом млекопитающих. Благодаря наличию основных структурных элементов обычных хромосом такие мини-хромосомы длительно удерживаются в клетках и способны нести полноразмерные (геномные) гены и их естественные регуляторные элементы, которые необходимы для правильной работы гена, в нужной ткани и в должное время. Генная и клеточная терапия открывает блестящие перспективы для восстановления утраченных клеток и тканей и генно-инженерного конструирования органов, что, несомненно, существенно расширит арсенал методов для медико-биологических исследований и создаст новые возможности для сохранения и продления жизни человека .
Александр Панчин, м.н.с. Института проблем передачи информации им. А.А. Харкевича РАН, аспирант факультета биоинженерии и биоинформатики МГУ.
В первой части статьи рассказано, как появились первые методы чтения генетических последовательностей, в чем они заключались и как геномика двигалась от чтения отдельных генов к чтению полных геномов, в том числе полных геномов конкретных людей.

Рис. 1. Снимки упорядоченных структур, составленных из молекул ДНК, под электронным микроскопом
Сегодня появляются все новые и более совершенные методы секвенирования, которые можно разбить на две группы. Старые методы основаны на всевозможных изощренных способах получения большого количества одинаковых молекул ДНК на определенном носителе, для усиления сигнала при чтении молекулы ДНК. Самые поздние методы основаны на разработке сверхточных приборов, способных анализировать одиночные молекулы.

Рис. 2. Три цикла полимеразной цепной реакции. Темно-красным и темно-зеленым показаны праймеры.
Полимеразная цепная реакция (ПЦР):
Рис. 3. Технология 454. Используются шарики размером 44нм, на которых размножаются молекулы ДНК.

Рис. 4. Illumina Solexa - кластеры ДНК.

Рис. 5. Технология Helicos. Каждая светящаяся точка – отдельный нуклеотид!
Секвенирование с помощью Helicos.
Но и это, оказалось, не предел. В 2009 г. появляется революционно новый метод чтения ДНК с использованием того же инструмента, который использует клетка при делении – ДНК-полимеразы, фермента, который удваивает ДНК. Прибор, разработанный в лаборатории Стивена Тернера [7], действительно уникален. На дно специальных ячеек, расположенных на прозрачном стекле, прикрепляются одиночные молекулы ДНК-полимеразы (рис. 6). Область ничтожного размера прямо вокруг закрепленного фермента просвечивается с помощью специального лазера. В ячейку добавляют нуклеотиды всех четырех типов, помеченные разными светящимися маркерами. Область, которую анализирует лазер, столь мала, что молекула в норме не задерживается в ней долго, уплывает и не оставляет сигнала. Если же во время удвоения ДНК молекула удерживается полимеразой, то молекула задерживается в сканируемой области и оставляет сигнал. После присоединения нуклеотида светящаяся метка отваливается и уплывает. Таким образом, скорость чтения у такого прибора становится равной скорости работы полимеразы.

Рис. 6. Технология SMART Pacific Biosciences – чтение одиночных молекул во время их происоединения к нарастающей цепи ДНК с помощью ДНК-полимеразы.
Видео Pacific Biosciences можно посмотреть на сайте компании.
Таким образом, за последние 10 лет произошел переворот в возможности чтения геномов. Цена секвенирования тысячи нуклеотидов упала с менее $1 по методу Сенгера в 1990-х до 5 центов с технологией 454 в 2005, затем в том же году до 0,2 цента с технологией Illumina и, наконец, 0.05 цента – с технологией Helicos. Цена чтения ДНК с самыми последними секвенаторами компаний Complete Genomics и Pacific Biosciences, которые, вероятно появятся на рынке в этом и следующем году, еще неизвестна, но прогнозы весьма оптимистичны.
Возникает вопрос: а что дала и сможет дать людям геномика? Ответ прост: очень много.
Прочитанные геномы дают основу для построения эволюционных деревьев, что поможет разобраться в том, как именно шла эволюция живых организмов на нашей планете. Когда стоимость чтения геномов животных приблизится к порогу $1000 за геном, станет возможным прочитать геномы всех живых организмов, исследовать любые родственные взаимоотношения между любыми группами живых организмов и разработать новую систематику.
Во-вторых, мы узнаём все больше и больше о роли наших генов. Благодаря сравнению генома человека и человекообразных обезьян мы узнали, что не количество генов делает нас отличными от остальных животных, а их качество, особенности. Сравнивая геномы разных животных, мы можем узнать, за что отвечает каждый из генов, а может быть – даже улучшить тот или иной ген, чтобы вывести новый, более приспособленный организм. Генетические данные активно используются при создании медицинских препаратов или новых сельскохозяйственных культур.
Последние исследования по изучению одиночных мутаций в генах показывают связь между определенными генетическими вариациями и различными заболеваниями и особенности тела и психики человека. Так существуют гены, определяющие то, станем ли мы лысеть, какой у нас цвет глаз, рост, насколько нам грозит диабет или определенная форма рака, есть ли у нас предрасположенность к спорту, полезно ли для нас принятие кофе, алкоголя или аспирина. С 2007 года стали появляться компании, такие как 23AndMe (их генетическая диагностика за $399 – лучшее изобретение 2008 года по регтингу журнала Time), Navigenics или DecodeMe, которые используют так называемые ДНК-чипы для определения генетических характеристик подобного рода. Возможность читать целые геномы многократно улучшит предсказательные способности таких проектов, надежность, детализированность и точность предсказаний, адекватность рекомендаций (рис. 7).

Рис. 8. Наши знания о человеке в начале эпохи геномики
Сегодня мы еще не умеем изменять гены взрослых людей, но можем предотвратить многие генетические заболевания, если будем знать причину и заблаговременно начнем профилактику или лечение. Так, исследования гена, связанного с прогрессирующей формой миопатии, процессов при его прочтении в клетке, позволили разработать лекарства, спасающие тех, кто в противном случае был бы обречен. Изучение функций генов открывает дорогу персональной фармакогеномике – индивидуальному подходу к лечению. Людей с разными генами следует лечить по-разному: кому-то поможет одно лекарство, кому-то другое, и это важно знать.
Безусловно, такие возможности породят новые социальные, этические и философские проблемы. Медицинские страховые компании могут захотеть информацию о геноме клиентов, чтобы решить, выгодно ли им дать страховку – сделать им скидку для человека, который генетически обещает быть здоровым или заставить потенциального больного платить за страховку больше? Правильно ли это? Не следует ли спортсменам соревноваться в разных категориях по аллеям генов, связанных с физической подготовкой, так же как боксеры легкого веса не дерутся с тяжеловесами? Можно ли использовать генетическую информацию, чтобы отдать предпочтение тому или иному сотруднику компании в повышении или устройстве на работу? В США подобная дискриминация уже запрещена, однако армия США проводит свои генетические анализы. Уже сегодня знания о возможных опасных для здоровья генах помогают выбирать самых здоровых зародышей при экстракорпоральном оплодотворении, но можно ли менять гены будущих людей в зиготе (сперматозоиде или яйцеклетке) или в оплодотворенной яйцеклетке?
В любом случае, как показывает история последних десятилетий, развитие этих технологий неизбежно, как неизбежно то, что когда-нибудь они станут доступны (если не обязательны) для всех. Нам же остается готовиться к грядущим переменам и участвовать в них.
Читайте также:

