Химические процессы в верхних слоях атмосферы кратко
Обновлено: 30.06.2024
В атмосфере протекает множество природных процессов, физических явлений, определяющих облик земли, влияющих на все стороны существования человечества. В атмосфере наблюдаются:
- теплообмен;
- испарение и выделение влаги;
- массоперенос;
- присутствие примесей;
- оптические феномены;
- акустические явления;
- электрические разряды;
- магнитные поля;
- распространение электромагнитных колебаний;
- протекание всевозможных химических реакций;
- сгорание небесных тел;
- другие процессы.
Кроме того атмосфера постоянно взаимодействует с Землей, на нее влияют рельеф поверхности, наличие крупных акваторий, хозяйственная деятельность человека, случайные флуктуации различных геофакторов.
Природные явления в атмосфере подчиняются фундаментальным законам физики и химии в классической интерпретации.
Определение и генезис атмосферы
Чтобы изучать объект, надо ему дать определение, и, хотя бы в общих чертах представлять, как он возник. Под атмосферой в науке понимают окружающий нашу планету воздушный слой, удерживаемый гравитацией Земли. Формирование атмосферы зависело от становления Земли, она возникла, примерно 4,5 млрд. лет, когда планета преобразовалась в твердое тело.
В результате активной вулканической деятельности происходил постоянный выброс из недр Земли азотсодержащих газов, оксида углерода, углеводородов, в основном метана, воды в парообразной фазе.
Под влиянием ультрафиолетовых частот солнечного излучения вода разлагалась на свои составные элементы, аммиак продуцировал азот и водород. Водород поднимался в верхние слои, более тяжелые кислород и азот накапливались около земли.
Газовая оболочка земли ─ итог миллиардов лет геологической эволюции нашей планеты и деятельности экосистем. Они в свою очередь сами зависят от атмосферы, находясь с ней в сложной взаимосвязи. Состав сегодняшней атмосферы сформировался на основе динамического равновесия геохимических факторов и жизнедеятельности организмов.
Свойства и состав атмосферы по мере удаления от Земли меняются по вертикали, постепенно приближаясь к межзвездному веществу. Значимые изменения начинаются на высоте 11−12 тыс. км., воздушный слой до этой условной отметки называют тропосфера, он оказывает самое непосредственное влияние на планету и жизнь ее обитателей. Общая масса атмосферы оценивается в 5,2─5,3.10 18 кг.
Состав газовой оболочки земли
Атмосфера является колоссальным химическим реактором для веществ, находящихся в ней. Из-за быстро меняющихся условий система находится в метастабильном состоянии. Тем не менее, основные компоненты, их концентрации остаются постоянными, по мнению, ученых в течение последних 50-ти млн. лет.
В первом приближении состав воздуха содержит:
| Основные газы | Концентрация, % |
|---|---|
| Азот (N2) | 78,1 |
| Кислород(O2) | 20,9 |
| Аргон (Ar) | 0,9 |
| Водяной пар | до 0,1% |
В микроскопических долях, измеряемых в PPB (particles per billion), количество данных частиц на миллион частиц воздуха в объеме присутствуют:
- углекислый газ (CO2) – 383
- неон (Ne) − 18,2
- гелий (He) − 5,2
- метан (CH4) − 1,7
- криптон (Kr) − 1,1
- водород (H2) − 0,6.
Содержание этих веществ разнится от времени года и региона. Молекулярная масса воздуха 29 g/mol. В атмосфере присутствуют бесчисленные следы еще тысяч химических соединений.
Превосходящий по содержанию другие элементы азот образовался в процессе окисления первоначальной смеси аммиака (NH4) и водорода кислородом. Содержание последнего начало возрастать, так как 3 млрд. лет назад активизировался фотосинтез вследствие появления большой массы растительного мира.
Инертные газы пополнили газовую оболочку Земли благодаря активности вулканов, и распаду радиоактивных элементов. Содержание благородных газов в атмосфере меньше, чем в космическом пространстве, видимо, они туда мигрируют. СО2 появился из недр извергающихся вулканов и, как продукт разложения биомассы.
Структура атмосферы по высоте
Атмосфера неоднородна по вертикали, поэтому ее физические параметры зависят от высоты, прежде всего, распределения температуры и массы.
Различают несколько наиболее важных областей, на которые делят атмосферу:
-
. Примыкающий к Земле слой до 12 км толщиной (в тропической зоне до 18), где сконцентрировано порядка 80% массы, и находится весь водяной газ. В тропосфере зарождаются туманы, облака, возникают осадки, грозовые явления. Следует подчеркнуть, солнечные лучи легко преодолевают тропосферу, нагревая поверхность земли. Сам нижний слой газовой оболочки нагревается от Земли. Поэтому температура с увеличением высоты падает. . Характеризуется низкими температурами на высоте 20 км, примерно, минус 56°С. Интересно, что, начиная с 25-ти километровой отметки, температура в стратосфере растет, достигая на 50 км положительных значений. Сказывается поглощение квантов энергии ультрафиолетового спектра, нагревающей воздух. . Температура около 90 км достигает 90°С, главенствует турбулентное перемешивание. Среда достаточно однородна, тяжелые и легкие газы не разделены.
Выше мезосферы располагается термосфера, подразделяющаяся на ионосферу и экзосферу. Для ионосферы присущи высокая степень разреженности воздуха и чрезвычайно сильная ионизация. Носители зарядов ─ атомарный кислород, электроны, реактивный свободный радикал окись азота (NO). Отмечаются случайные скопления электронов, называемые электронными облаками. Именно в этой области возникают знаменитые полярные сияния. Температура в ионосфере поднимается до 1000°С на высоте 800 км.
Экзосфера, начинающаяся выше 1000км, плавно трансформируется в межпланетное пространство. Разреженность газа здесь столь высока, а скорость его частичек огромна, что они облетают землю по эллиптической траектории, словно микроскопические спутники. Некоторые частички обладают второй космической скоростью и покидают земную атмосферу, рассеиваясь во Вселенной.
Физические процессы в атмосфере
При всех обстоятельствах в атмосфере, как и везде, действуют фундаментальные законы нашей Вселенной ─ закон сохранения массы и энергии, а также две базовые константы — скорость света и постоянная Планка.
Через газовую оболочку вокруг земли происходит взаимодействие планеты и космоса, заключающееся в обмене материей и энергией. Свое влияние мироздание осуществляет через физические поля, во многом определяющие свойства, состав, структуру атмосферы.
- Электромагнитные колебания.
- Гравитационное воздействие.
- Магнитные поля
- Потоки элементарных частиц, которые на основе принципа корпускулярно-волнового дуализма можно рассматривать как сверхвысокочастотный диапазон электромагнитных волн.
Атмосфера и солнечные лучи
Солнце имеет критически важное значение для выживаемости человечества, поэтому важно изучать его влияние на атмосферу и какие при этом происходят процессы.
В атмосферу поступает электромагнитный спектр солнечного излучения, от радиоволн до жестких рентгеновских лучей. Начинает он свою деятельность выше 1500 км, вступая в схватку с атомами водорода. Солнечные лучи отнимают у него единственный электрон, превращая в одинокий положительно заряженный ион, он же элементарная частица протон. Поскольку атмосфера на таких уровнях разрежена атакующая солнечная радиация почти не теряет энергии.
Но, проникнув на высоту 300 км, она встречает стойких бойцов. Ей последовательно противостоят атомы кислорода, азот, окись азота, последний рубеж держит О2. На высоте около 120 км солнечная армия остается без свирепого ультрафиолета с длиной волны 100─1020 А (ангстрем). Он растратил энергию на ионизацию, и его поглотили.
Одновременно задерживаются рентгеновское излучение(30-100 А). Часть рентгеновских лучей поддерживает ионизацию ионосферы в промежутке 90─130 км. Другая часть формирует ценой жизни нижний уровень ионосферы на высотах в районе 60 км. Полностью победить нейтральные частицы не удается, помимо ионизации идет обратный процесс их рекомбинации из ионов и электронов.
Ниже 100 км молекулы кислорода, подвергаясь диссоциации, поглощают электромагнитные волны длиннее 1020 А до 1760. Ниже 80 км, распадаясь на атомы, кислород не пропускает волны до 1925 А.
Несколько иной механизм взаимодействия газовой оболочки и солнечных лучей возникает на высотах от 20 до 30 км (зависит от широты). Там возникают условия для образования слоя озона (О3) путем соединения атомарного и молекулярного кислорода. К счастью для биоценоза озон эффективно поглощает солнечные лучи с длиной волны до 3100 А. Они примыкают к видимой части спектра, относятся к мягкому ультрафиолету, но для жизни остаются смертельно опасны. Их энергия идет на распад молекул озона.
Озоновая проблема
Над некоторыми областями земной поверхности отмечено уменьшение толщины озонового слоя, самое большое над Антарктидой. Это серьезная опасность для биологических существ.
Озон погибает, не только противостоя, ультрафиолету, но и чисто химическим путем. Различают водородный, азотный и галогенный цикл реакций, приводящих к уничтожению озона. Интенсивное развитие химической промышленности, особенно использование фреонов, привело к большим выбросам галогенов, прежде всего, хлора, нарушившими устоявшееся равновесие. Галогенный цикл начал уничтожать озон, приводя к образованию озоновых дыр. Впрочем, существуют иные мнения, связывающие вопрос исчезновения озона с циклическим характером природных процессов.
Что видят глаза в атмосфере
Без воды нет биологической жизни, но без нее невозможно представить и атмосферу. В разных модификациях люди могут непосредственно наблюдать ее в атмосфере. Ниже всех располагается туман ─ микроскопические капельки влаги, а при низких температурах льда. Он стелется по земле. В небе мы каждый день видим облака, состоящие из воды. Их классифицируют следующим образом.
| Название облаков | Высота над землей, км |
|---|---|
| Слоистые, кучевые, дождевые | 0,4- 6 |
| Высоко-кучевые, высоко-слоистые | до 7,5 |
| Перистые | 15 — 18 |
| Перламутровые | 24 — 30 |
Слоистые облака это, по сути, туман, воспаривший вверх. Они могут образовываться на высоте от 30 метров. Кучевые облака отличаются белоснежностью, формируются в холодной части циклона. Дождевые облака обладают большой плотностью, темным до черного цветом. Ждите дождя.
Высоко-кучевые образования напоминают соединенные пластины, по краям видно свечение. От них к нам прилетают, кружатся отдельные снежинки. Сквозь облака просматривается Солнце с венчиком.
Перистые облака ─ волокнообразные формирования, напоминающие меридиональную разметку на карте. Состоят из кристалликов люда, поэтому преломленные лучи света рождают оптические иллюзии ─ гало.
Перламутровые облака наблюдаются в полярных широтах. Пары воды собираются вокруг центров конденсации. Такие ядрышки появляются в атмосфере из-за активности вулканов, в частности, выбросов сернокислотного аэрозоля.
На высоте 60─120 км происходит сгорание из-за трения о воздух метеоритных тел ─ космических пришельцев. Образуется метеорный газ, его возбужденные атомы и ионы излучают свечение.
Высоко, до уровня 1000 км, атомарные и молекулярные кислород, азот, водород, гелий, щелочные металлы соударяются с частичками солнечного ветра (элементарные частицы). Возникает полярное сияние.
Акустика и атмосфера
Воздух под воздействием возбудителя колеблется, распространяя звук, передавая акустическую информации. Без атмосферы мы бы не могли наслаждаться пением птиц, восхищаться чарующими мелодиями. Мы бы не слышали друг друга.
Химические процессы в атмосфере
Химические превращения в воздухе обусловлены двумя факторами. В первом случае поглощение энергии электромагнитного спектра солнечного излучения (фотохимия) приводит к распаду и появлению новых химических связей. Изменения второго типа происходят из-за столкновений молекул. Эти закономерности изучает химическая кинетика.
Химические процессы, идущие в атмосфере, условно можно поделить на вызванные естественными причинами и антропогенной природы.
Химические превращения естественного происхождения
В большинстве своем химические реакции в атмосфере возбуждаются под влиянием квантов солнечного света. Если энергия фотона достаточна для разрушения валентных связей внутри молекулы, она распадается. Процесс называется фотодиссоциация. Такой энергией обладает высокочастотное (жесткое) излучение ультрафиолетовой части солнечного спектра.
Особенно активно разрушается кислород с выделением его атомарной формы. Для инициирования процесса нужна не очень высокая энергия 495 кДж/моль, поэтому молекулярный кислород поглощает значительную долю ультрафиолета. На высоте более 400 км практически нет молекулярного кислорода, только его атомарная форма. Иное дело азот. Обладая высокой энергией связи, его молекула чрезвычайно устойчива и в атмосфере концентрация атомов азота пренебрежимо мала.
Пары воды в основном находятся вблизи земной поверхности, куда ультрафиолетовое излучение достигает слабо, растратив себя на разрушение субстанций в верхних слоях. Но малое количество молекул воды на больших высотах также диссоциирует с образованием водорода и гидроксильной группы.
Поскольку в воздушной оболочке земли много кислорода в ней доминируют окислительно-восстановительные реакции. По механизму протекания это многостадийные процессы с формированием и участием промежуточных ионов, способных к химическим
реакциям.
Многие газы, находящиеся в атмосфере, хорошо растворяются вводе, поэтому атмосферная влага имеет большое значение. В химии образования капель и туч большую роль в качестве окислителя играет озон.
Помимо продуктов распада основных элементов, из которых состоит атмосфера (О2 и N2), в реакции вступают другие газы, поступающие в атмосферу по естественным причинам.
- вулканические извержения;
- жизнедеятельность биоценоза;
- испарения болот;
- земная кора;
- мировой океан.
Наиболее заметную роль в химических превращениях в воздухе играют гидроксильная группа. Гидроксил получается при фотохимической реакции разложения озона (О3). За свою короткую жизнь (менее 1 секунды) он вступает в реакции с газами, куда входят Н, С, О, N, S, превращая их в соединения (СО2, Н2SO4, другие), более легко удаляемые из атмосферы.
Химические процессы, возникающие из-за деятельности человечества
Хозяйственная деятельность человека приводит к появлению в атмосфере повышенных концентраций веществ по сравнению с естественным равновесным состоянием.
Проблема загрязнения окружающей среды из-за вредных выбросов в атмосферу является одним из опаснейших вызовов человечеству, угрожающих его существованию. Отмечается три главных источника загрязнения воздуха.
- Отходы промышленности.
- Сжигание теплоносителей в котельных.
- Выхлопные газы двигателей автомобильного транспорта.
Вследствие работы теплоэлектростанций в окружающую среду попадает сернистый газ, углекислый. Металлургические заводы загрязняют среду обитания окислами азота, хлором, сероводородом, аммиаком, соединениями фосфора, ртути, многими иными небезопасными субстанциями.
Это первичные загрязнители, они вступают реакции, образуя вторичные. С большой интенсивностью сернистый газ (SO2) переходит в серный ангидрид (SO3), который взаимодействуя с влагой, дает серную кислоту (H2SO4). Если серный ангидрид вступит в реакцию с аммиаком (NH4) в небе мы будем иметь кристаллики сульфата аммония. Выпадающая с осадками серная кислота образует кислотные дожди, сжигающие окрестную листву, вызывающие респираторные заболевания у людей.
При неполном сгорании органического топлива в пространство выбрасывается оксид углерода (СО), знаменитый угарный газ. Он вступает в реакции со многими веществами, образуя продукты, создающие парниковый эффект.
Алюминиевые, заводы, предприятия, производящие удобрения, стекольные фабрики выбрасывают фторсодержащие вещества в газовой фазе. Они сами по себе вредны для здоровья, дальнейшие превращения загрязняют окружающую среду токсическими веществами еще сильнее. Тоже самое с хлором, активно участвующим в образовании паров соляной кислоты. Получаются угрожающие здоровью населения мышьяковистые, фосфорные соединения, вещества содержащие сурьму, свинец, редкие металлы.
Аэрозольное загрязнение
Особый класс представляют взвешенные в воздухе частицы, называемые аэрозолями. Как правило, они получаются в результате взаимодействия частиц между собой и парами воды. В больших количествах их продуцируют теплоэлектростанции ТЭС, химический состав отличается большой вариативностью, можно найти соединения железа, редких металлов, кремния, селена, других элементов периодической таблицы.
Частички взвеси могут также носить органическое происхождение, в частности в пыли находятся ароматические углеводороды (бензол и другие). Кроме того в атмосфере присутствуют свободные радикалы, насыщенные и ненасыщенные углеводороды, чьи гомологические цепочки могут содержать до 13-ти атомов углерода.
Эта масса подвергается процессам окисления, полимеризации, формирует соединения с иными загрязнителями под воздействием солнечной энергии. Углеводороды образуют вещества с оксидами азота, серы, перекисями. Зрительно аэрозоли воспринимаются как смог, дымка, мгла.
Заключение
Возникновение биологической материи, тем более высокоорганизованных форм возможно при сочетании многих факторов. Одной из основополагающих субстанции является подходящая для жизнедеятельности окружающая газовая среда. Атмосфера подательница жизни, ее защитница и фактор эволюции.
В тоже время она хрупка, по незнанию, неразумию, можно легко нарушить ее сбалансированное состояние, тогда мы получим карающего без разбора мстителя. Одна из насущных задач человечества научиться жить в согласии со всем мирозданием и с важнейшей для нас ее частью атмосферой. Человек не навреди миру, в котором живешь.
Необходимо обратить внимание на то, что все данные реакции экзотермические.
Реакции атмосферных ионов
Образующиеся молекулярные ионы обладают очень большой реакционной способностью, быстро реагируют с любыми другими частицами при столкновении, эти реакции также носят экзотермический характер. Но так как при высоком разряжении отдача избыточной энергии маловероятна, то более вероятна рекомбинация иона с электроном, сопровождающаяся диссоциацией:
Такие реакции называются реакциями диссоциативной рекомбинации. Атомарный азот в верхних слоях атмосферы образуется исключительно в результате такой реакции.
Перенос заряда.Когда молекулярный ион сталкивается с какой-либо нейтральной частицей, между ними может произойти перенос электрона: N2 + (г) + О2 (г) ® N2 (г) + О2 + (г). Это возможно, если Е1(O2) + (г) + О2(г) ® О (г) + О2 + (г);
Реакции переноса заряда играют большую роль во многих областях химии, особенно в биохимии. Реакции переноса заряда не сопровождаются разрывом химических связей, осуществляется только перенос электрона от одной частицы к другой. Но существует класс реакций в атмосфере, в ходе которых частицы обмениваются атомами:
O + (г) + N2 (г) ® N (г) + NО + (г) ;
N2 + (г) + О (г) ® N (г) + NО + (г) .
Эти реакции являются экзотермическими и протекают очень легко, при этом образуется молекулярный ион NО + (г). Поскольку энергия ионизации NО самая низкая из всех частиц, находящихся в верхних слоях атмосферы, то NО + (г) не может ничем нейтрализоваться и этот ион является преобладающим в данной области. Таким образом, молекулы N2, О2 и NО отфильтровывают большую часть опасного (жесткого) ультрафиолетового излучения на высоте около 100 км.
На высоте более 30 км фотодиссоциация кислорода остается (реакция 1). В мезосфере и стратосфере концентрация молекулярного кислорода превышает концентрацию атомарного кислорода, поэтому образующиеся атомы часто сталкиваются с молекулами О2, что приводит к образованию озона:
Эта реакция обратима и если частица О3 * не отдает избыточную энергию при столкновении с другой (N2 и О2), то молекула распадется. Чем ниже к Земле, тем больше концентрация газов N2 и О2, тем чаще столкновение и стабилизация озона. Но опять же, чем ниже, тем меньше диссоциация О2 на атомы, так как отфильтровано излучение с длиной волны 242 нм. Максимальная скорость образования озона на высоте 50 км, так как мало атомов кислорода и, следовательно, мало озона.
Обобщенный процесс циклического образования и разложения озона:
О2 (г) +О (г) + М (г) ® О3 (г) + М * (г) + выделение тепла ;
О (г) + О (г) + М (г) ® О2 (г) + М * (г) + выделение тепла .
М * - любая частица в столкновении.
Результатом данного процесса является превращение ультрафиолетового излучения Солнца в тепловую энергию. Озоновый цикл обеспечивает повышение температуры в стратосфере (рис. 7.1). В этот цикл вовлекаются многие химические реакции; общим результатом является разложение озона, например:
NO является катализатором процесса. Когда в этот цикл вторгаются дополнительные порции оксида азота, значительно уменьшается концентрация озона. Так, при полете сверхзвуковых самолетов в двигателях достигается такая высокая температура, что становится возможной реакция: N2 (г) +O2 (г) ® 2 NО (г), в результате которой оксид азота выбрасывается в стратосферу, существенно снижая концентрацию озона.
Разрушение озона обусловлено также влиянием фторхлорметанов:
За этим следует разложение CFxCl3–x и т.д. Расчеты показывают, что скорость образования атомарного хлора максимальна на высоте 30 км.
Cl(г) + О3 (г)® ClО(г) + О2 (г) (разрушение озона)
Оксид хлора, реагируя с атомарным кислородом, вновь дает атомарный хлор: ClО (г) + О (г) ® Cl (г)+ О2(г); снова Cl(г) + О3 (г)® ClО(г) + О2 (г). обрыв цепи может происходить при взаимодействии хлора с молекулами водорода, метана, воды, пероксида водорода. В итоге имеем суммарную реакцию: О (г) + О3 (г) ® 2 О2(г).
Фреоны очень хорошо сохраняются в атмосфере, плохо растворимы в воде, не горят, имеют низкие температуры кипения, поэтому хорошо испаряются на воздухе. Из тропосферы часть фреонов может уходить с водой и, не гидролизуясь, скапливаться в океане, который становится своеобразным резервуаром фреонов.
* Ядерные взрывы. Разогрев до 6000 К и быстрое охлаждение (замораживание NO). 1 Мт при взрыве дает от 1000 до 12000 тонн оксидов азота (2,5·10 32 молекул).
* Сверхзвуковые самолеты (18 г NO на 1 кг топлива). 1 млн тонн оксидов азота в год выбрасывают двигатели сверхзвуковых самолетов.
* Использование минеральных азотных удобрений.
* Сжигание топлива дает до 3 млн тонн оксидов азота в год.
В химии и фотохимии атмосферы участвуют пять основных азотсодержащих газов: N2, NH3, NO, NO2, N2O. В конденсированной фазе азот присутствует в форме иона аммония (NH4 + ) и нитратного иона (NO3 – ). Возможные взаимодействия можно описать следующей схемой:
O + NO + M ® NO2 + M ;
где М - третье вещество, принимающее избыток энергии. Цикл взаимодействий на основе соединений азота в тропосфере дополняется образованием азотной кислоты: 4 NO2 + 2 H2O + O2 ® 4 HNO3 или по реакции диспропорционирования 3 NO2 + H2O « 2 HNO3 + NO.
Атомарный кислород и озон способны вступать в реакции с различными органическими веществами, в результате чего получаются свободные радикалы. Так, для олефинов возможна следующая реакция:
O3 + R–CH=CH–R ® RCHO + RO * + HCO * ,
где RO * и HCO * - свободные радикалы. Образующийся альдегид RCHO может подвергаться фотодиссоциации по реакции: RCHO + hn ® R + HCO * . Кроме альдегидов фотохимически активны также кетоны, пероксиды и ацилнитраты, которые под воздействием солнечной радиации также образуют свободные радикалы. Последующая цепь взаимодействий может быть представлена схемой, где ROO * - пероксидный радикал:
ROO * + NO ® NO2 + RO * ;
RH + RO * ® ROH + R * ;
Эта цепь превращений с участием свободных радикалов является основой для образования смога, содержащего ассоциации молекул альдегидов, кетонов, оксидантов и соединений типа пероксиацетилнитратов (ПАН).
CH3 – C – O – O – NO2 - это газ, сильно раздражающий слизистую оболочку глаз и отрицательно действующий на ассимиляционный аппарат растений.
Другим веществом, также сильнодействующим на слизистую оболочку глаз, присутствующим в смоге, является пероксибензолнитрат (ПБН), имеющий следующую структуру: О
Антропогенная деятельность и вулканические извержения приводят к накоплению в атмосфере SO2. Фотодиссоциация диоксида серы невозможна, так как длина волн, которые достигают нижних слоев атмосферы, где происходит накопление SO2, слишком велика, жесткое коротковолновое излучение уже отфильтровано. Однако фотодиссоциация NO2 и кислорода дает на данной высоте достаточное количество атомарного кислорода и озона (см. выше) и тогда возможен процесс: SO2 + О + М ® SO3 + М. Эффективность этой реакции возрастает по мере увеличения отношения концентрации SO2 к концентрации NO2. Окислению SO2 до SO3 могут способствовать следы металлов, проявляющих каталитическое действие на данную реакцию (например, марганец). Соединяясь с водой, оксид серы (VI) образует серную кислоту, которая с металлами или аммонием (NH4 + ) дает сульфаты.
Переносу диоксида серы на дальние расстояния способствует строительство высоких дымовых труб. Это возможно и снижает степень локального загрязнения, но увеличивает время пребывания SO2 в воздушной среде и степень его превращения в серную кислоту и сульфаты. Таким образом, сернистый газ в сочетании с парами воды (туман) является главным компонентом так называемого сернистого смога (смог лондонского типа).
Кислотные дожди.В результате антропогенного загрязнения атмосферы сернистым газом и оксидами азота происходит, как показано выше, образование серной и азотной кислот, выпадающих на Землю вместе с осадками. Кислотность обычной дождевой воды за счет частичного растворения во влаге углекислого газа равна 5,6: рН = 5,6. Но известны случаи выпадения кислых дождей с рН = 2,3 (кислотность лимонного сока!). Такие осадки наносят существенный ущерб качеству воды в природных водоемах, качеству почвы, приводят к разрушению изделий из металлов, архитектурных сооружений, мрамора и бетона.
Ежегодно с осадками выпадают миллионы тонн кислот, что ведет к радикальному изменению химии природной среды. Частицы сульфатов размером 0,1 - 1 мкм, присутствующие в атмосфере, рассеивают свет, ухудшая видимость, что отрицательно воздействует на организм человека. В условиях повышенной влажности и гигроскопичности некоторых сульфатов: (NH4)2SO4, NH4HSO4 – рассеивание света возрастает.
С учетом этого для описания изменения концентрации вещества во времени в любой точке атмосферы ________ модель следующего вида:
Модель турбулентной диффузии
С – концентрация компонента в данной точке пространства,
Кх, Ку, Кz – горизонтальные и вертикальные составляющие коэффициента турбулентной диффузии
- производная изменения концентрации по направления – скорость уноса приходит по направлению, т.е. скорость турбулентной диффузии по направлению
R – общая скорость изменения концентрации за счет химических процессов
Д – то же за счет физических процессов (сухого и влажного оседания)
М – общая скорость изменения концентрации за счет поступления вещества в атмосферу от всех источников.
Применение данного уравнения к реальным процессам весьма затруднительно из-за значительных неопределенностей турбулентного движения примесей и соответственно неопределенности численных значений К и скорости турбулентной диффузии.
Тем не менее при определенных упрощениях данная модель используется для получения аналитических зависимостей изменения концентрации химических веществ в атмосфере, которые лежат в основе расчетов при оценке уровня загрязнения атмосферы химическими веществами.
Химические процессы в верхних слоях атмосферы
Верхние слои атмосферы в значительной мере определяют условия жизни на Земле, поскольку играют роль защитного барьера на пути излучения высокой энергии (чувствительной для живых организмов).
Один из важнейших процессов, протекающих в верхних слоях – диссоциации кислорода с образованием атомарного кислорода, который играет очень большую (основную) роль в химических превращениях в верхних слоях атмосферы. Энергия необходимая для диссоциации = 502 кДж/моль и соответствует верхней границе диапазона излучения 240 нм.
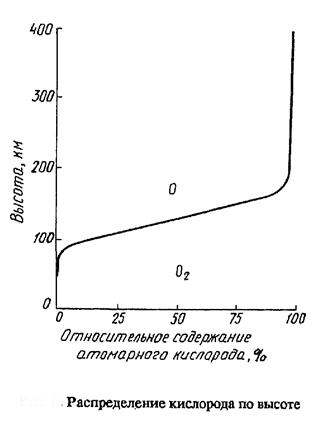
Вследствие этого с высоты ~ 100 км кислород находится как в молекулярной так и атомарной формах. Относительно содержания атомарного кислорода иллюстрирует график – на высоте ~ 130 км содержание атомарной и молекулярной форм примерно одинаково.
На высоте 80-90 км и выше (в мезо и термосферы)коротковолновые УФ излучения вызывают ионизацию основных компонентов – N2, O2, O, поглощая наиболее коротковолновые излучения ионизирубются:
Образующиеся ионы могут участвовать в реакциях нескольких типов:
- диссоциативной рекомбинации (захват электроном молекулярных ионов и распад на атомы):
- в реакциях с переносом заряда (взаимодействие с другой молекулой)
либо возможны реакции:
Следствием наличия в верхних слоях атомарных N и О является образование NO, который также участвует в реакциях рассмотренных типов:
1) способен поглощать радиацию:
2) ион NO + также может диссоциативно рекомбинировать:
3) способен участвовать в реакциях с переносом заряда (принимать заряд)
Ион NO + распадается лишь в результате диссоциативной рекомбинации. В реакциях другого типа он вследствие низкой активности не участвует и поэтому является основные ионным компонентом верхней части термосферы (ионосферы).
На более низких высотах (30-50 км - тратосфера) коротковолновое излучение еще достаточно интенсивно (хотя основная его часть поглощена выше) и также способно вызвать диссоциацию О2 (по реакции (1)):
[правило Хунда (Гунда) – в свободной квантовой ячейке электроны располагаются так, чтобы их суммарный спин был максимальный (отталкивание между неспаренными электронами меньше чем между спаренными, поэтому триплетный более энергетически выгоден чем синглетный)]
В зависимости от величины энергии поглощенного кванта один или оба образующихся атом кислорода могут находится в возбужденном состоянии O ( 1 Д). Метастабильный O ( 1 Д) очень активная частица с временем жизни в стратосфере около 110 сек. Его дезактивация (тушение) происходит в результате столкновения и химической реакции с молекулами О2 или других газов (очевидно, преимущественно азота), а так же с молекулой Н2О. Эти реакции протекают с высокой скоростью, в каждом случае образуется атомарный О в основном состоянии:
Наряду с О ( 3 р) продуктом реакции является синглетный метастабильный молекулярный кислород в низшем (из возможных) электронно возбужденном состоянии [энергия которого превышает энергию основного состояния лишь на 94 Дж]. Синглетный не отличается высокой реакционной способностью. Для него характерен излучательный переход в основное состояние и время жизни достаточно велико [он образуется еще несколькими путями – о чем чуть позже]
C другими молекулами б)
(перенос избыточной энергии к другой молекуле)
Образуется возбужденная частица (например, молекула ), для которой характерно тепловое (или излучательное) рассеяние энергии возбуждения
С Н2О в) К=2,9*10 -11
Параллельно может идти также реакция с образование гидроксильных радикалов
К=2,2*10 -10 см/моль
Очень важная в химии атмосферы
Атомарный кислород в основном состоянии О( 3 р) выполняет очень важную роль, так как участвует в образовании озона как в стратосфере, так и в тропосфере.
В принципе озон – высокотоксичный газ, его токсичность примерно на порядок выше, чем у SO2. Он к тому же сильнейший окислитель, поэтому в воздухе тропосферы озон представляет высокую опасность для всего живого. Но в стратосфере озон, как отмечалось, выполняет очень важную функцию и снижение его концентрации на этой высоте несет серьезную опасность.
Для характеристики содержания озона в атмосфере используют специальную систему измерения – единицу Добсона (е.Д.). Название это получено от названия спектрометра Добсона, который первоначально применяли для измерения концентрации озона. Спектрометр позволял достаточно точно определить общее содержание озона в столбе воздуха над наблюдателем (над прибором).

АТМОСФЕРА
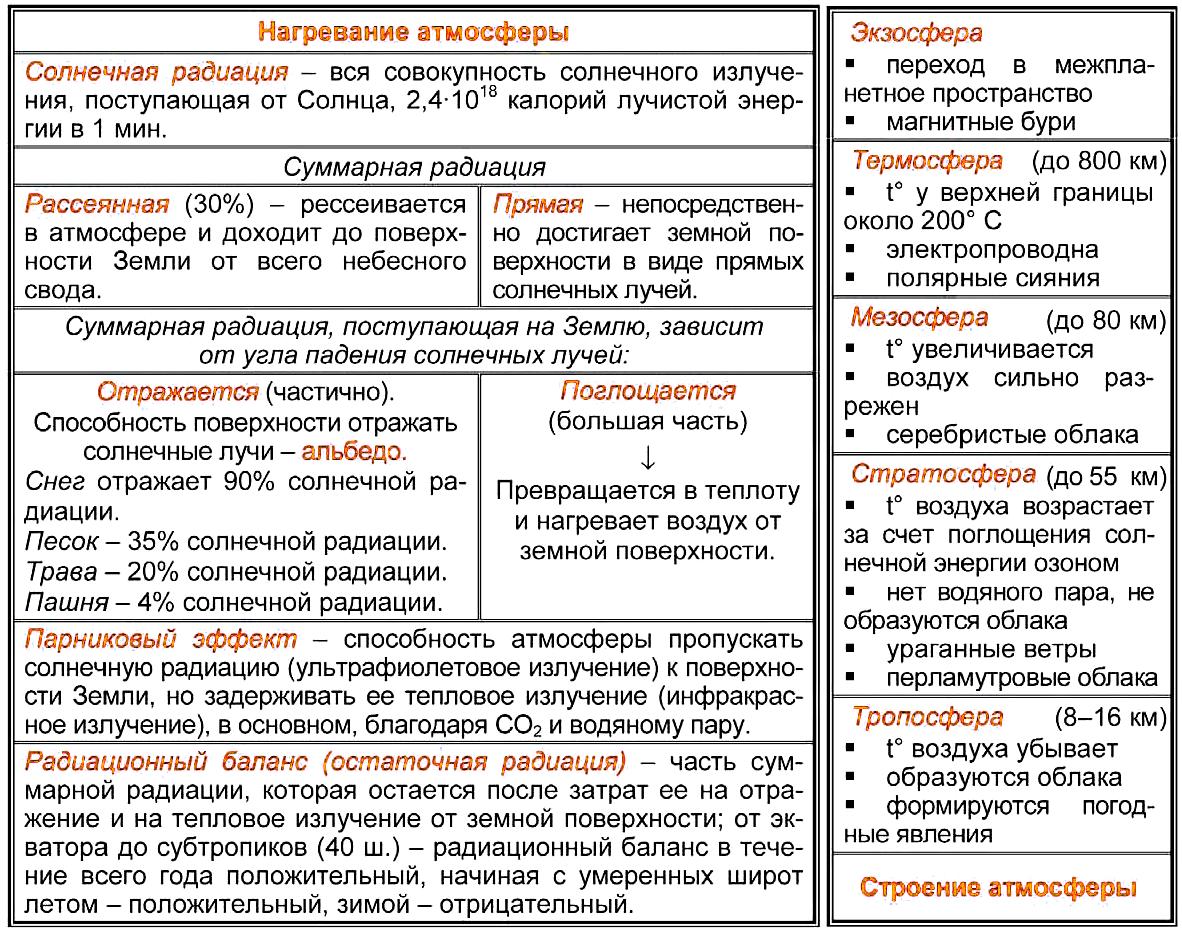
Атмосфера — газовая оболочка, окружающая планету Земля и вращающаяся вместе с ней. Совокупность разделов физики и химии, изучающих атмосферу, принято называть физикой атмосферы. Атмосфера определяет погоду на поверхности Земли, изучением погоды занимается метеорология, а длительными вариациями климата — климатология.
Толщина атмосферы 1500 км от поверхности Земли. Суммарная масса воздуха, то есть смеси газов, составляющих атмосферу: около 5,3 * 10 15 т. Молекулярная масса чистого сухого воздуха составляет 29. Давление при 0°С на уровне моря 101 325 Па, или 760 мм. рт. ст.; критическая температура 140,7 °С; критическое давление 3,7 МПа. Растворимость воздуха в воде при 0 °С — 0,036 %, при 25 °С — 0,22 %.
Атмосферное давление — давление атмосферного воздуха на находящиеся в нем предметы и земную поверхность. Нормальным атмосферным давлением является показатель в 760 мм рт. ст. (101 325 Па). При повышении высоты на каждый километр давление падает на 100 мм.
Строение атмосферы.
Физическое состояние атмосферы определяется погодой и климатом. Основные параметры атмосферы : плотность воздуха, давление, температура и состав. С увеличением высоты плотность воздуха и атмосферное давление уменьшаются. Температура меняется также в зависимости от изменения высоты. Вертикальное строение атмосферы характеризуется различными температурными и электрическими свойствами, разным состоянием воздуха. В зависимости от температуры в атмосфере различают следующие основные слои : тропосферу, стратосферу, мезосферу, термосферу, экзосферу (сферу рассеяния). Переходные области атмосферы между соседними оболочками называют соответственно тропопауза, стратопауза и т.д.

Тропосфера — нижний, основной, наиболее изученный слой атмосферы, высотой в полярных областях 8—10 км, в умеренных широтах до 10—12 км, на экваторе — 16—18 км. В тропосфере сосредоточено примерно 80—90 % всей массы атмосферы и почти все водяные пары. При подъеме через каждые 100 м температура в тропосфере понижается в среднем на 0,65 °С и достигает —53 °С в верхней части. Этот верхний слой тропосферы называют тропопаузой. В тропосфере сильно развиты турбулентность и конвекция, сосредоточена преобладающая часть водяного пара, возникают облака, развиваются циклоны и антициклоны.
Стратосфера — слой атмосферы, располагающийся на высоте 11—50 км. Характерно незначительное изменение температуры в слое 11—25 км (нижний слой стратосферы) и повышение ее в слое 25—40 км от —56,5 до 0,8 °С (верхний слой стратосферы или область инверсии). Достигнув на высоте около 40 км значения 273 К (0 °С), температура остается постоянной до высоты 55 км. Эта область постоянной температуры называется стратопаузой и является границей между стратосферой и мезосферой.
В стратосфере задерживается большая часть коротковолновой части ультрафиолетового излучения (180—200 нм) и происходит трансформация энергии коротких волн. Под влиянием этих лучей изменяются магнитные поля, распадаются молекулы, происходит ионизация, новообразование газов и других химических соединений. Эти процессы можно наблюдать в виде северных сияний, зарниц, и других свечений. В стратосфере почти нет водяного пара.
Мезосфера начинается на высоте 50 км и простирается до 80—90 км. Температура воздуха до высоты 75—85 км понижается до 88 °С. Верхней границей мезосферы является мезопауза.
Термосфера (другое название — ионосфера) — слой атмосферы, следующий за мезосферой, — начинается на высоте 80—90 км и простирается до 800 км. Температура воздуха в термосфере быстро и неуклонно возрастает и достигает нескольких сотен и даже тысяч градусов.
Экзосфера — зона рассеяния, внешняя часть термосферы, расположенная выше 800 км. Газ в экзосфере сильно разрежен, и отсюда идет утечка его частиц в межпланетное пространство (диссипация).
Структура атмосферы
До высоты 100 км атмосфера представляет собой гомогенную (однофазную), хорошо перемешанную смесь газов. В более высоких слоях распределение газов по высоте зависит от их молекулярных масс, концентрация более тяжелых газов убывает быстрее по мере удаления от поверхности Земли. Вследствие уменьшения плотности газов температура понижается от 0 °С в стратосфере до -110 °С в мезосфере.
На высоте около 2000—3000 км экзосфера постепенно переходит в так называемый ближнекосмический вакуум, который заполнен сильно разреженными частицами межпланетного газа, главным образом атомами водорода. Но этот газ представляет собой лишь часть межпланетного вещества. Другую часть составляют пылевидные частицы кометного и метеорного происхождения. Кроме этих чрезвычайно разреженных частиц, в это пространство проникает электромагнитная и корпускулярная радиация солнечного и галактического происхождения.
На долю тропосферы приходится около 80 % массы атмосферы, на долю стратосферы — около 20 %; масса мезосферы — не более 0,3 %, термосферы — менее 0,05 % от общей массы атмосферы. На основании электрических свойств в атмосфере выделяют нейтросферу и ионосферу. В настоящее время считают, что атмосфера простирается до высоты 2000—3000 км.
В зависимости от состава газа в атмосфере выделяют гомосферу и гетеросферу. Гетеросфера — это область, где гравитация оказывает влияние на разделение газов, т.к. их перемешивание на такой высоте незначительно. Отсюда следует переменный состав гетеросферы. Ниже ее лежит хорошо перемешанная, однородная по составу часть атмосферы называемая гомосферой. Граница между этими слоями называется турбопаузой, она лежит на высоте около 120 км.
Состав атмосферы
Атмосфера Земли — воздушная оболочка Земли, состоящая в основном из газов и различных примесей (пыль, капли воды, кристаллы льда, морские соли, продукты горения), количество которых непостоянно. Основным газами являются азот (78 %), кислород (21 %) и аргон (0,93 %). Концентрация газов, составляющих атмосферу, практически постоянна, за исключением углекислого газа CO2 (0,03 %).
Также в атмосфере содержатся SO2, СН4, N, СО, углеводороды, НСl, НF, пары Hg, I2, а также NO и многие другие газы в незначительных количествах. В тропосфере постоянно находится большое количество взвешенных твердых и жидких частиц (аэрозоль).
Читайте также:

