Гетерогенная система в химии это кратко
Обновлено: 05.07.2024
19.1. Фазы
При описании многих физических и химических систем используется понятие фаза.
Фазой системы может быть газ или смесь газов, жидкость (или жидкий раствор), твердое вещество (или твердый раствор). В любом случае, чтобы представлять собой отдельную фазу, такая составная часть системы должна быть однородной. Каждое из твердых веществ и каждая из несмешивающихся жидкостей представляют собой отдельную фазу.
Система, образованная водой и таящим льдом, состоит из двух фаз, так как, хоть по составу вода и лед одинаковы, у них разное строение, кроме того, между ними есть граница раздела. Воздух, соляная кислота, подкисленный серной кислотой водный раствор перманганата калия – системы, состоящие из одной фазы; здесь нет границ раздела, и в любой части такой системы состав и строение одинаковы.
В приведенном определении понятия " фаза" есть некоторые особенности, не дающие считать это определение исчерпывающим. Это, прежде всего, требование одинаковости состава и строения фазы. Оно относится только к фазам равновесных систем. Если в системе происходит химическая реакция, или просто растворение твердого вещества в жидкости, то фаза может быть и не однородна. Кроме того, сравниваемые объемы однородной фазы не должны быть соизмеримы с размером частиц (молекул, ионов), из которых состоит данная фаза – в противном случае, любая фаза окажется неоднородной. Другие проблемы, связанные с понятием " фаза" , рассматриваются в ВУЗах при изучении курса физико-химического анализа.
По числу фаз системы делят на гомогенные и гетерогенные.
| Гомогенная система – система, состоящая из одной фазы. Гетерогенная система – система, состоящая из двух или большего числа фаз. |
Фаза может быть сплошной или дисперсной (раздробленной на множество отдельных частиц). Сплошной фазой принято считать фазу, из любой точки которой можно попасть в любую другую точку, не пересекая межфазную границу.
Гомогенная система может быть образована лишь сплошной фазой.
Гетерогенная система может быть образована, как сплошными, так и дисперсными фазами.
Вода с помещенной в нее цинковой пластиной представляет собой гетерогенную систему, состоящую из двух сплошных фаз; если же в ту же воду насыпать цинковую пыль, или просто поместить отдельные гранулы цинка, то в такой системе одна из фаз будет дисперсной.
Сплошные фазы гетерогенных систем (а иногда и гомогенных) часто называют срe дами, например: " жидкая среда" , " твердая среда" , " водная среда" и т. п.
19.2. Дисперсные системы
Гетерогенные системы, содержащие дисперсные фазы называют дисперсными системами. При этом сплошная фаза дисперсной системы называется дисперсионной средой.
Названия некоторых дисперсные систем с различными агрегатными состояниями дисперсионной среды и дисперсной фазы приведены в таблице 2.
Туманы и дымы носят общее название – аэрозоли. Именно они (в данном случае туманы) образуются при выпускании в воздух содержимого аэрозольных баллончиков. Дымы образуются не только при горении топлива, но и в результате многих других химических реакций, например, при взаимодействии хлороводорода с аммиаком.
К эмульсиям относится обычное молоко и множество технических эмульсий, например, применяемых для смазки и охлаждения режущего инструмента (эмульсии машинного масла в воде).
Примером грубодисперсной суспензии служит строительный " раствор" (суспензия песка и цемента в воде), а мелкодисперсной – масляная краска (суспензия пигмента в олифе). При затвердевании строительного раствора и " высыхании" масляной краски они превращаются в дисперсные системы с твердой дисперсионной средой. К этой же группе дисперсных систем относятся некоторые сплавы и многие горные породы.
Примеры жидких пен – мыльная, пивная, квасная и другие пены. Твердыми пенами являются пенопласт, пенополиэтилен, пенополиуретан, некоторые строительные материалы-утеплители. В отличие от них, обычная банная губка является дисперсной системой с двумя взаимопроникающими дисперсионными средами. В виде дисперсных систем с жидкой дисперсной фазой и твердой дисперсионной средой выпускаются некоторые лекарственные средства.
Пользуясь терминологией, приведенной в этом параграфе, следует помнить о том, что она не всегда правильно используется, особенно в технике. Так строительный " раствор" – отнюдь не раствор, а грубодисперсная суспензия. Фотографическая " эмульсия" – отнюдь не эмульсия, а дисперсная система с твердой дисперсной фазой (в черно-белой фотографии – бромидом серебра) и твердой дисперсионной средой, основным компонентом которой является животный белок коллаген. Водоэмульсионная краска (правильное название – водно-дисперсионная) не является эмульсией, а представляет собой дисперсию в воде твердых частичек пигмента и связующего.
19.3. Коллоидные растворы
Истинные растворы – гомогенные системы. Частицы, из которых они состоят, перемешаны на атомно-молекулярном уровне. Кроме таких растворов существуют внешне однородные системы, содержащие очень мелкие частицы другой фазы, тем не менее не являющиеся отдельными молекулами или ионами. Такие гетерогенные системы носят название коллоидных растворов (более новое название – лиозоли).
Частицы в коллоидных растворах невозможно отделить фильтрованием. Если они и отстаиваются, то очень медленно (иногда для этого требуется несколько лет). Обычные центрифуги также, как правило, не позволяют разделить коллоидный раствор. Иногда это удается с использованием так называемых " ультрацентрифуг" – центрифуг с очень большой скоростью вращения. Такая устойчивость коллоидных растворов связана не только с незначительными размерами твердых частиц (примерно от 10 до 1000 Е), но и с довольно сложными электрофизическими явлениями на их поверхности, приводящими к взаимному отталкиванию коллоидных частиц.
| Фаза, гомогенная система, гетерогенная система, сплошная фаза, дисперсная фаза, дисперсная система, дисперсионная среда, аэрозоль, эмульсия, суспензия, жидкая пена, твердая пена, коллоидный раствор (лиозоль). |
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.

Термическое разложение солей на газообразные и твердые продукты - типичный пример гетерогенной реакции:
СаСО3 -> СаО + СО2,
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Zn + H2SO4 -> ZnSO4 + Н2.
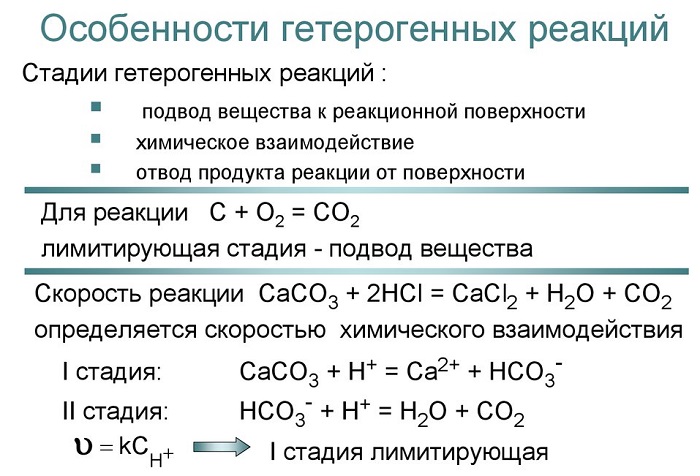
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.

Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
- Твердое тело– газ. Сжигания угля иллюстрирует реакцию газа и твердого вещества: твердый углерод взаимодействует с газообразным кислородом, при этом получается углекислый газ;
- Несмешивающиеся жидкости. При взаимодействии толуола и азотной кислоты, а это несмешивающиеся жидкости, происходит гетерогенная реакция 2 типа;
- Газ – жидкость. Примером можно назвать процесс орошения, когда диспергированная в виде капель жидкость пролетает через газ;
- Жидкость – твердое вещество. Серная кислота и оксид цинка – пример реакции между жидкостью и твердой фазой.
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.

Рассмотрим их подробнее.
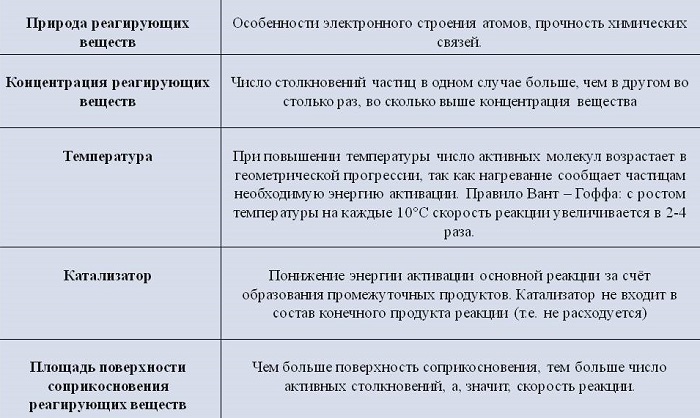
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.

Гетерогенность системы варьируется от ее определения в одной области знаний к другой. Тем не менее, эта концепция имеет много общего в кулинарии и химии.

Например, пицца с ее поверхностью, заполненной ингредиентами, как та, что на изображении выше, представляет собой гетерогенную систему. Точно так же салат, смесь орехов и хлопьев, или газированный напиток также считаются гетерогенными системами..
Обратите внимание, что его элементы отличаются простым зрением и могут быть разделены вручную. Как насчет майонеза? Или молоко? На первый взгляд они однородны, но микроскопически они являются гетерогенными системами; точнее, они являются эмульсиями.
В химии ингредиенты состоят из реагентов, частиц или исследуемого вещества. Фазы являются только физическими агрегатами этих частиц, которые обеспечивают все качества, которые характеризуют фазы. Таким образом, жидкая фаза спирта "ведет себя" иначе, чем у воды, и даже больше, у жидкой ртути..
В некоторых системах фазы распознаются так же, как насыщенный раствор сахара, с кристаллами на заднем плане. Каждый из них сам по себе может быть классифицирован как гомогенный: вверху фаза, образованная водой, а внизу твердая фаза, состоящая из кристаллов сахара..
В случае системы вода-сахар речь не идет о реакции, но о насыщении. В других системах трансформация материи присутствует. Простым примером является смешивание щелочного металла, такого как натрий, и воды; Это взрывоопасно, но вначале кусок металлического натрия окружен водой.
Как и в случае с майонезом, в химии существуют гетерогенные системы, которые макроскопически проходят сквозь гомогенные, но в свете мощного микроскопа они показывают свои истинные гетерогенные фазы..
- 1 Характеристики гетерогенной системы
- 1.1 Степень наблюдения
- 2.1 Насыщенные растворы (жидкость-жидкость, жидкость-твердое вещество, жидкость-газ)
- 2.2 Растворы с осажденными солями
- 2.3 Фазовые переходы
- 2.4 Твердые вещества и газы
- 3.1 Фильтрация
- 3.2 Декантация
- 3.3 Скрининг
- 3.4 Imaging
- 3.5 Центрифугирование
- 3.6 Сублимация
Характеристики гетерогенной системы
Каковы характеристики гетерогенной химической системы? В общих чертах они могут быть перечислены следующим образом:
-Они состоят из двух или более фаз; другими словами, это не однородно.
-Как правило, он может состоять из любой из следующих пар фаз: твердое-твердое, твердое-жидкость, твердый газ, жидкость-жидкость, жидкость-газ; и, кроме того, все три могут присутствовать в одной и той же системе твердое-жидкость-газ.
-Его компоненты и фазы различимы, в первую очередь, с первого взгляда. Поэтому достаточно наблюдать за системой, чтобы сделать выводы из ее характеристик; такие как цвет, вязкость, размер и форма кристаллов, запах и т. д..
-Обычно это включает термодинамическое равновесие или высокое или низкое сродство между частицами в фазе или между двумя различными фазами..
-Физико-химические свойства варьируются в зависимости от региона или направления системы. Таким образом, значения, например, температуры плавления, могут колебаться от одной области неоднородного твердого тела к другой. Кроме того, (наиболее распространенный случай) цвета или тона меняются по всему телу (жидкости или газа) при сравнении.
-Они представляют собой смеси веществ; то есть это не относится к чистым веществам.
Степень наблюдения
Любая однородная система может считаться неоднородной, если масштаб или степень наблюдения изменены. Например, графин, наполненный чистой водой, представляет собой однородную систему, но, поскольку наблюдаются его молекулы, их миллионы со своими собственными скоростями..
С молекулярной точки зрения система продолжает оставаться гомогенной, потому что это только молекулы H.2О. Но при дальнейшем уменьшении масштаба наблюдения до атомных уровней вода становится неоднородной, поскольку она состоит не из одного типа атомов, а из водорода и кислорода..
Поэтому характеристики гетерогенных химических систем зависят от степени наблюдения. Если вы рассмотрите микроскопическую шкалу, вы можете найти многогранные системы.
Твердое тело A, по-видимому, однородное и серебристого цвета, может состоять из нескольких слоев различных металлов (ABCDAB . ) и, следовательно, быть гетерогенным. Следовательно, A является гомогенным макроскопически, но гетерогенным на микро (или нано) уровнях.
Кроме того, одни и те же атомы являются гетерогенными системами, поскольку они состоят из вакуума, электронов, протонов, нейтронов и других субатомных частиц (например, кварков)..
классификация
Принимая во внимание степень макроскопического наблюдения, которая определяет видимые характеристики или измеримое свойство, химические гетерогенные системы можно классифицировать следующими способами:
Насыщенные растворы (жидкость-жидкость, жидкость-твердое вещество, жидкость-газ)
Насыщенные растворы представляют собой тип гетерогенной химической системы, в которой растворенное вещество не может продолжать растворяться и образует фазу, отдельную от фазы растворителя. Пример кристаллов воды и сахара попадает в эту классификацию.
Молекулы растворителя достигают точки, в которой они не могут принимать или растворять растворенное вещество. Затем дополнительный раствор, будь то твердый или газообразный, быстро перегруппируется с образованием твердого вещества или пузырьков; то есть система жидкость-твердое тело или газообразная жидкость.
Раствор также может быть жидкостью, которая смешивается с растворителем до определенной концентрации; в противном случае они будут смешиваться во всех концентрациях и не будут образовывать насыщенный раствор. Под смешиванием понимается, что смесь двух жидкостей образует единую однородную фазу.
Если, с другой стороны, жидкий раствор не смешивается с растворителем, как в случае со смесью масла и воды, раствор насыщается при добавлении наименьшего количества. В результате образуются две фазы: одна водная, а другая маслянистая..
Растворы с осажденными солями
Некоторые соли устанавливают баланс растворимости, потому что взаимодействия между их ионами очень сильны и перегруппируются в кристаллы, что вода не может диссоциировать.
Этот тип гетерогенной системы также состоит из жидкой и твердой фаз; но, в отличие от насыщенных растворов, растворенное вещество представляет собой соль, которая не требует больших количеств для осаждения.
Например, при смешивании двух водных растворов ненасыщенных солей, одного из NaCl и другого из AgNO3, нерастворимая соль AgCl выпадает в осадок. Хлорид серебра устанавливает баланс растворимости в растворителе, наблюдая беловатое твердое вещество в водном контейнере.
Таким образом, характеристики этих растворов зависят от типа образовавшегося осадка. В целом, соли хрома очень цветные, а также марганец, железо или какой-либо комплекс металлов. Этот осадок может быть кристаллическим, аморфным или желатиновым твердым веществом.
Фазовые переходы
Глыба льда может образовывать однородную систему, но при таянии образует дополнительную фазу жидкой воды. Следовательно, фазовые переходы вещества также являются гетерогенными системами..
Кроме того, некоторые молекулы могут выходить с поверхности льда в паровую фазу. Это потому, что не только жидкая вода представляет давление пара, но и лед, хотя в меньшей степени.
Гетерогенные системы фазовых переходов относятся к любому веществу (чистому или нечистому). Таким образом, все твердые вещества, которые тают, или жидкость, которая испаряется, принадлежат к этому типу системы.
Твердые вещества и газы
Очень распространенным классом гетерогенных систем в химии являются твердые вещества или газы с несколькими компонентами. Например, пицца на изображении попадает в эту классификацию. И если бы вместо сыра, паприки, анчоусов, ветчины, лука и т. Д. Он содержал бы серу, уголь, фосфор и медь, то у него было бы другое гетерогенное твердое вещество..
Сера выделяется из-за своего желтого цвета; уголь для того, чтобы быть черным телом; фосфор красный; и блестящая и металлическая медь. Все они прочные, поэтому система состоит из фазы, но состоит из нескольких компонентов. В повседневной жизни примеры систем такого типа неисчислимы.
Кроме того, газы могут образовывать гетерогенные смеси, особенно если они имеют разные цвета или плотности. Они могут тянуть очень маленькие частицы, как это происходит с частицами воды внутри облаков. Когда они увеличиваются в размерах, они поглощают видимый свет, и в результате облака становятся сероватыми.
Примером гетерогенной системы твердого газа является дым, который состоит из очень маленьких частиц углерода. По этой причине дым неполного сгорания черноватый.
Методы фракционирования
Фазы или компоненты гетерогенной системы могут быть разделены с использованием различий в их физических или химических свойствах. Таким образом, исходная система фракционируется до тех пор, пока не останутся только гомогенные фазы. Некоторые из наиболее распространенных методов являются те, которые следуют.
фильтрация
Фильтрация используется для отделения твердого вещества или осадка от жидкости. Таким образом, две фазы удается разделить, хотя и с определенным уровнем загрязненности. По этой причине твердое вещество обычно подвергают промывке, а затем сушат в печи. Эту процедуру можно выполнить с помощью вакуума или просто под действием силы тяжести..
декантирование
Этот метод также полезен для отделения твердого вещества от жидкости. Он немного отличается от предыдущего тем, что твердое вещество обычно имеет твердую консистенцию и полностью оседает на дне контейнера. Для этого просто наклоните горловину емкости под соответствующим углом, чтобы из нее вытекла жидкость..
Аналогично, декантация позволяет разделить две жидкости, то есть систему жидкость-жидкость. В этом случае мы используем разделительную воронку.
Двухфазная смесь (две несмешивающиеся жидкости) переносится в воронку, а жидкость с более низкой плотностью будет располагаться сверху; в то время как более высокая плотность, в нижней части, в контакте с выходным отверстием.
![]()
Верхнее изображение представляет разделительную или декантирующую воронку. Этот стеклянный материал также используется для экстракции жидкость-жидкость; то есть извлекать растворенное вещество из исходной жидкости, добавляя другую жидкость, в которой она еще более растворима.
просеивание
Скрининг используется для разделения твердых компонентов разных размеров. Очень часто можно найти на кухне сито или сито для очистки зерна, очистки пшеничной муки или удаления твердых остатков густых соков. В химии, он может быть использован для отделения небольших кристаллов от других более крупных величин.
намагничивание
Этот метод используется для твердотельных систем, где один или несколько компонентов притягиваются магнитом. Таким образом, исходная гетерогенная фаза очищается, когда магнит удаляет ферромагнитные элементы. Например, намагниченность используется для отделения белой жести от мусора.
центрифугирование
Центрифугирование отделяет взвешенное твердое вещество от жидкости. Он не может быть отфильтрован, потому что частицы плавают равномерно, занимая весь объем жидкости. Чтобы разделить обе фазы, некоторое количество гетерогенной смеси подвергается центробежной силе, которая осаждает твердое вещество в нижней части центрифужной пробирки..
сублимация
Метод сублимационного разделения применяется только для летучих твердых веществ; то есть для людей с высоким давлением пара при низких температурах.
При нагревании гетерогенной смеси летучее твердое вещество уходит в газовую фазу. Примером его применения является очистка образца, загрязненного йодом или хлоридом аммония.
примеров
До сих пор было упомянуто несколько примеров гетерогенных химических систем. В дополнение к ним, дополнительные и другие, не входящие в химический контекст, перечислены ниже:
-Гранит, камни реки, горы или любая скала с прожилками многочисленных цветов.
-Минералы также считаются гетерогенными системами, поскольку они образованы несколькими типами твердых структур, состоящих из ионов. Его качества являются продуктом взаимодействия между ионами кристаллической структуры и примесями..
-Безалкогольные напитки. В них существует равновесие жидкость-газ, которое, когда внешнее давление уменьшается, растворимость растворенного газа уменьшается; по этой причине наблюдается много пузырьков (газообразный раствор), поднимающихся к поверхности жидкости, когда они не покрыты.
-Любая реакционная среда, которая включает реагенты в разных фазах и которая также нуждается в магнитной мешалке, чтобы гарантировать более высокую скорость реакции.
-Гетерогенные катализаторы. Эти твердые вещества обеспечивают участки на их поверхности или поры, где ускоряется контакт между реагентами, и они не вмешиваются и не подвергаются необратимому превращению в реакции..
меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы.
Примеры:
-жидкие или твердые растворы (растворы — гомогенные (однородные) системы, т.е. каждый из компонентов распределен в массе другого в виде молекул, атомов или ионов)
· Гетероге́нная систе́ма — неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела.
Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ).
18) Скорость химических реакций. Зависимость скорости химических реакций от концентрации, температуры, давления,наличия катализаторов.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
· Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул
реагирующих веществ - скорость реакции возрастает.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
· Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
Это правило математически выражается следующей формулой: vt 2 = vt 1 γ ,
где vt 1 , vt 2 - скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°
· Катализаторы. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами.
Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
· Гомоге́нная систе́ма — однородная система, химический состав и физические свойства которой во всех частях одинаковы или
меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы.
Примеры:
-жидкие или твердые растворы (растворы — гомогенные (однородные) системы, т.е. каждый из компонентов распределен в массе другого в виде молекул, атомов или ионов)
![]()
· Гетероге́нная систе́ма — неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела.
Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ).
18) Скорость химических реакций. Зависимость скорости химических реакций от концентрации, температуры, давления,наличия катализаторов.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
· Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул
реагирующих веществ - скорость реакции возрастает.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
· Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа).
Это правило математически выражается следующей формулой: vt 2 = vt 1 γ ,
где vt 1 , vt 2 - скорости реакции соответственно при начальной ( t 1 ) и конечной ( t 2 ) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°
· Катализаторы. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами.
Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
Читайте также:


