Эквивалентность теплоты и работы кратко
Обновлено: 02.07.2024
У первого начала интересная и длинная история. Здесь, однако, излагается только конец ее.
Принцип эквивалентности между теплотой и работой. Много лиц участвовало в открытии первого начала, но мы можем остановиться только на Ю. Р. Майере (1814 - 1878) и Дж. П. Джоуле (1818 - 1889).
Майер по образованию и профессии врач. Майера поразила светлая венозная кровь у жителей острова Ява (1840). У европейцев она темная. Он объяснил это различие: вследствие высокой температуры тропиков организм должен вырабатывать меньше теплоты для покрытия ее потерь, чем при более низкой температуре в Европе. Поэтому в условиях тропиков артериальная кровь должна меньше раскисляться, чем в условиях европейского климата.
На первый взгляд может показаться, что наблюдения Майера не имеют никакого отношения к действию тепловых машин. Но это не так: Майер следовал за Лавуазье.
Для нахождения этой величины надо провести опыты с любой закрытой системой. Она должна совершить цикл, обмениваясь теплотой и работой с другими системами.
После окончания цикла в самой системе изменений нет и быть не может. Таким образом, система только превращает теплоту и работу друг в друга. После окончания цикла сама система выпадает из термодинамического рассмотрения. В этом удобство циклов. Но без системы невозможны превращения теплоты и работы.
Пусть никто не вздумает вычислять механический эквивалент теплоты, рассматривая некруговые процессы.
Майер вычислил (1842) механический эквивалент теплоты для цикла. Сам Майер опытов не проводил. Он воспользовался результатами работ, которые были выполнены не позже 1823 г. Вся подготовительная работа для открытия закона была закончена за 20 лет до Майера.
Не было только одного, но самого важного и необходимого - понимания смысла полученных результатов.
Закрытой системой был воздух. В начальном своем состоянии он имел давление 1 кгс/см² и температуру 0° С. Система находилась в состоянии незаторможенного внутреннего механического равновесия и незаторможенного внутреннего термического равновесия. Воздух в начальном своем состоянии занимал объем один кубический метр. Воздух находился в сосуде, герметически закрытом подвижным поршнем. Поршень передвигался без трения. Сосуд и поршень образовывали границы системы. Припишем сосуду и поршню исчезающе малую массу, стало быть, исчезающе малую общую теплоемкость.
Цикл состоял из трех стадий. Первая стадия. Понижают температуру воздуха на 1° С при постоянном давлении. Система отдает термостатам количество теплоты, равное общей теплоемкости воздуха при постоянном давлении. Подвешенный груз производит над системой работу. Ее количество вычисляют по уравнению (4). Изменение (уменьшение) объема равно, как установил еще (1802) Гей-Люссак, 1/273 первоначального объема воздуха.
Вторая стадия. Воздух в приборе Гей-Люссака расширяется до первоначального объема. Баллоны в приборе различной емкости: больший - 272/273 м³, меньший - 1/273 м³. В больший баллон помещают весь воздух, который участвовал в первой стадии, при температуре - 1° С. Меньший баллон эвакуирован. После открытия крана и перепуска воздуха с дальнейшим установлением незаторможенного внутреннего механического равновесия и такого же термического равновесия температура воздуха после расширения останется равной - 1°С.
Чтобы вычислить механический эквивалент теплоты, Майеру нужен был только результат опыта Гей-Люссака. Но Майер объяснил также этот опыт. Объемная работа при расширении газа в опыте равна нулю, по постановке самого опыта. Природа газа такова, что (см. главу 4) при адиабатическом расширении газа без совершения работы температура газа не изменяется.
Высказанное положение тем более точно, чем меньше плотность газа. Оно становится совсем точным при исчезающе малой плотности газа. Если опыт Гей-Люссака понят, то для его проведения годится уже описанный сосуд с поршнем. Надо только позаботиться об адиабатическом протекании опыта. Надо дать газу расшириться без противодействующей силы на внешней поверхности поршня. После окончания второй стадии воздух имеет температуру - 1° С и объем один кубический метр.
Третья стадия. Стопорят поршень и повышают (конечно, при постоянном объеме) температуру воздуха на 1° С, Объемная работа равна нулю. Количество же теплоты, полученной системой, равно общей теплоемкости воздуха при постоянном объеме. После окончания третьей стадии воздух имеет температуру 0° С и объем один кубический метр. Цикл закончен.
На первой стадии цикла система отдала количество теплоты, равное общей теплоемкости воздуха при постоянном давлении. На второй стадии система не получала и не отдавала теплоты - адиабатический процесс.
На третьей стадии система получила количество теплоты, равное общей теплоемкости воздуха при постоянном объеме. Суммарно в цикле система отдала теплоту. Суммарное количество отданной теплоты равно разности между теплоемкостью воздуха при постоянном давлении и теплоемкостью воздуха при постоянном объеме.
Только на первой стадии процесса объемная работа отлична от нуля. На второй стадии количество объемной работы равно нулю из-за расширения без противодействующей силы; на третьей стадии - из-за постоянства объема. На первой стадии объем воздуха уменьшился. Подвешенный груз опустился и совершил работу над системой. Суммарно: в цикле система отдала термостатам теплоту, подвешенный груз опустился и совершил работу над системой.
В распоряжении Майера были данные Делароша и Берара о теплоемкости воздуха при постоянном давлении. Теплоемкость воздуха при постоянном объеме Майер вычислил по уравнению Лапласа для скорости звука в воздухе.
Таким образом, Майер мог найти и значение механического эквивалента теплоты. Ему надо было только разделить суммарное для всего цикла количество работы, совершенной над системой, на суммарное для всего цикла количество отданной системой теплоты. Как все это остроумно и красиво!
Современные экспериментальные данные позволяют несравненно точнее вычислить значение механического эквивалента теплоты, чем это могло получиться у Майера: (суммарное количество работы в круговом процессе) : (суммарное количество теплоты в круговом процессе) = механический эквивалент теплоты = 426,6, кгс . м/Ккал. (9)
Уравнение (9) выражает принцип эквивалентности.

Рис. 16. Опыт Джоуля. Жидкость в сосуде В перемешивается при адиабатических условиях мешалкой Ad. Источник работы - грузы Е и F. Грузы, опускаясь, вращают мешалку. Над системой (жидкость, сосуд, мешалка) производится работа. Температура системы поднимается. Чтобы восстановить первоначальную температуру, через стенки сосуда при неподвижной мешалке передают теплоту источнику теплоты. Количество теплоты измеряют. Цикл закончен, все измерения произведены. Остается вычислить механический эквивалент теплоты.
Систематические (1843 - 1878) превосходные экспериментальные исследования Джоуля доказали постоянство механического эквивалента теплоты. Значение этой величины не зависит ни от природы системы, ни от характера цикла.
Необходимо только, как уже указывалось, чтобы система, совершая цикл, была закрытой и обменивалась с другими системами теплотой и работой.
Здесь можно описать только один опыт Джоуля. Цикл состоял из двух стадий. В первой стадии при адиабатических условиях и при постоянном атмосферном давлении над системой совершалась работа (груз опускался). Температура системы повышалась.
Во второй стадии система отдавала теплоту другим системам при постоянном внешнем давлении и принимала первоначальную температуру. Обе стадии и составляли цикл.
Джоуль не проводил второй стадии цикла. Общая теплоемкость при постоянном давлении системы была известна. Поэтому Джоуль мог вычислить количество теплоты, которую должна была отдать система, чтобы ее температура приняла первоначальное значение. Джоуль осуществлял экспериментально только первую адиабатическую стадию (рис. 16).
При повышении температуры объем системы увеличивается: система совершает объемную работу над постоянным внешним давлением (атмосфера - источник работы).
При понижении температуры объем системы уменьшается: постоянное внешнее давление производит объемную работу над системой. Но, по уравнению (4), суммарное количество объемной работы для всего цикла равно нулю. При вычислении механического эквивалента теплоты объемная работа поэтому не учитывается. Учитывается только работа опускающихся грузов.
Р. Э. Клаузиус (1822 - 1888) назвал принцип эквивалентности между работой и теплотой первым началом термодинамики.
Принцип эквивалентности похоронил беспочвенную надежду создать термодинамический вечный двигатель.
Принцип исключает возможность провести цикл, при котором система суммарно совершала бы работу над другими системами и суммарно не поглощала бы эквивалентного количества теплоты от других систем. Невозможность чисто механического вечного двигателя стала ясной гораздо раньше. Еще в 1775 г. Французская академия наук объявила, что она никогда больше не будет рассматривать никакой машины, дающей вечное движение. (Здесь движение в смысле работы.) Построение вечного двигателя невозможно!
Следствия из принципа эквивалентности. Суммарное количество теплоты в цикле не равно в общем случае нулю. Примеры - циклы Майера, Джоуля. Отсюда вывод: теплота не есть свойство системы. Количество теплоты, получаемой (отдаваемой) системой, зависит не только от начального и конечного состояний системы, но и от пути перехода ее из начального состояния в конечное.
После открытия принципа эквивалентности нельзя говорить, что система содержит теплоту независимо от того, вещество ли теплота или движение частиц тела. Можно говорить только, что система получает или отдает теплоту. Теплота, как и работа, не есть свойство системы.
Теплота, как и работа, - количественная мера передачи движения от одной системы к другой, но движения уже беспорядочного. Передается теплота хаотическими движениями молекул тела, при отсутствии предпочтительного направления в движении молекул. Такова передача движения при контакте двух тел с различными температурами.
Для передачи беспорядочного движения нет необходимости даже в непосредственном контакте двух тел с различными температурами. Тела могут быть разъединены. Движение передается через вакуум беспорядочными электромагнитными волнами. В этом случае говорят о лучистой теплоте.
Работа - передача упорядоченного движения. Теплота - передача беспорядочного движения. Но для систем, состоящих из небольшого числа молекул, деление передачи на две формы теряет смысл. Изучать подобные системы методами термодинамики уже нельзя.
В передаче беспорядочного движения участвует не менее двух систем. Одна из них - это изучаемая нами система, та же, которая участвует в передаче упорядоченного движения. Вторая система, на другом конце передачи, измеряет количество теплоты. Больше ничего нас во второй системе не интересует. Название ее в отличие от изучаемой системы источник теплоты. (Раньше авторы называли его термостат.) Источниками теплоты могут быть, например, смесь воды и льда, кусок меди с определенной температурой. По изменению его температуры (зная его теплоемкость) измеряют количество переданной теплоты. Источник теплоты ее не содержит.
Источник теплоты надо понимать не в смысле источник воды, а как, скажем, химический завод источник удобрений.
Поясним теперь, как ставят термодинамический опыт. Система всегда находится внутри проведенных границ, внутри оболочки, физической или мысленной. Источник работы (в принципе одного достаточно для любого опыта) и источники теплоты (в зависимости от опыта может быть один, два, очень много источников теплоты) находятся вне границ, вне оболочки. Поэтому упорядоченное движение и беспорядочное движение всегда должны передаваться через оболочку, через границы системы. Нет передачи упорядоченного движения через границы системы, нет и работы. В опыте Гей-Люссака нет передачи упорядоченного движения через границы системы, через стенки обоих стеклянных баллонов. Количество работы в этом опыте равно нулю. В опыте Гей-Люссака нет и передачи беспорядочного движения через границы системы (из-за малой длительности опыта и плохой теплопроводности стекла). Количество теплоты в опыте Гей-Люссака равно нулю - адиабатический опыт.
При передаче движения, упорядоченного и беспорядочного, через границы системы вещество не должно переходить через границы. В противном случае невозможно измерить количество работы и количество теплоты. Понятия работы и теплоты потеряют свою ценность. Только закрытая система - предмет термодинамического изучения. К тому же ее взаимодействия с другими системами должны ограничиться передачами работы и теплоты.
Подобная система называется термодинамической системой, а процесс, совершаемый ею, - термодинамическим процессом.
Внутренняя энергия системы. Принцип эквивалентности выражается уравнением (9). Численное значение механического эквивалента теплоты зависит от произвольного выбора единиц для количества работы и количества теплоты. Но чтобы экспериментально обосновать этот принцип, необходимо измерять количество работы и количество теплоты хоть в произвольных, но независимых друг от друга единицах. После открытия принципа эквивалентности стало возможным измерять количества работы и теплоты одной и той же единицей, но снова произвольной. Сейчас работу и теплоту измеряют в джоулях. При общей единице измерения механический эквивалент теплоты равен единице: (суммарное количество работы в круговом процессе) : (суммарное количество теплоты в круговом процессе) = 1. (10)
Запишем уравнение (10) в другом виде: (суммарное количество теплоты в круговом процессе) - (суммарное количество работы в круговом процессе) = 0. (11)
Уравнение (12) выражает закон сохранения и превращения энергии в применении к термодинамическим процессам. Уравнение замечательно и своей математической структурой, и своим физическим содержанием. Внутренняя энергия системы - свойство системы. Изменение внутренней энергии системы при термодинамическом процессе зависит только от начального и конечного состояний системы, а не от пути перехода ее из начального состояния в конечное. В цикле изменение внутренней энергии всегда равно нулю. Теплота и работа не числятся в свойствах системы. Количество теплоты и количество работы зависят от пути перехода системы из начального состояния в конечное, а не только от начального и конечного состояний. В цикле количество теплоты и количество работы в общем случае не равны нулю. И вот: разность двух величин, которые порознь не являются свойствами системы, равна изменению свойства системы. Интересно и важно!
Часть внутренней энергии системы зависит от температуры. Эту часть называют термической энергией системы. С изменением температуры изменяются скорости движения молекул. Вторая гипотеза о природе теплоты относится не к теплоте в современном термодинамическом смысле этого понятия, а к термической энергии.
В адиабатических процессах работа подражает свойству системы. В этих процессах, по определению, количество теплоты равно нулю и количество работы равно (с обратным знаком) изменению внутренней энергии системы. Для вдавливания поршня в воздушном огниве надо совершить работу над системой. Внутренняя (термическая) энергия системы возрастает. Повышение температуры и есть выражение возрастания внутренней энергии. Никто да не скажет, что при адиабатическом сжатии повышение температуры вызвано превращением работы в теплоту. Такое утверждение было бы полностью лишено смысла. Внутри системы нельзя говорить ни о теплоте, ни о работе.
Рассмотрим процесс, при котором суммарное количество теплоты равно нулю и суммарное количество работы равно нулю. Тогда, по уравнению (12), изменение внутренней энергии тоже равно нулю и сама внутренняя энергия остается постоянной. Закрытая система, которая не обменивается теплотой и работой с другими системами, называется изолированной системой. Внутренняя энергия изолированной системы не изменяется, остается постоянной, - закон сохранения энергии применительно к термодинамическим процессам.
Уравнение (12) часто используют при термодинамических расчетах. В опыте Гей-Люссака газ (малой плотности) расширился без изменения температуры. По постановке опыта, количества теплоты и работы равны нулю. Тогда, по уравнению (12), при изотермическом изменении объема газа ~малой плотности) изменение энергии газа равно нулю. Но изменение энергии газа при изотермическом изменении объема всегда равно нулю, а не только в опыте Гей-Люссака. Можно изотермически расширить газ с совершением работы. Тогда газ должен получить теплоту. Количество теплоты равно количеству работы. По уравнению (12), изменение энергии, конечно, равно нулю. Газ можно изотермически сжать с затратой работы. Тогда газ отдаст теплоту. Количество отданной газом теплоты снова равно количеству затраченной над газом работы. Иначе при изотермическом изменении объема изменение энергии газа не равнялось бы нулю.
Когда начальное и конечное состояния системы выбраны, можно на любом пути от начального состояния к конечному менять по своему произволу или количество теплоты, или количество работы, но не оба количества одновременно.
Теплота — одно из наиболее важных понятий термодинамики. По своему существу понятие теплоты близко к понятию работы. И то и другое — и теплота и работа — являются формами передачи энергии. Поэтому не имеет смысла говорить, что тело обладает каким-то запасом теплоты или работы. Можно лишь констатировать, что телу сообщена (или от тела отнята) определенная теплота или определенная работа.
Различие между теплотой и работой состоит в том, что они являются различными формами передачи энергии. Теплота представляет собой такую форму передачи энергии, которая определяется либо непосредственным контактом между телами (теплопроводность, конвекция), либо лучистым переносом энергии. Работа представляет собой иной механизм передачи энергии. В случае механической работы обязательно имеет место изменение объема тела.
Принято считать, что подвод теплоты связан с повышением температуры тела, определяемой энергией микрочастиц тела. В большинстве случаев так действительно и бывает. Но, как мы увидим в дальнейшем, бывает, что несмотря на подвод к телу теплоты его температура понижается. Все зависит от баланса энергии, подводимой к телу и отводимой от него. В частном, но наиболее распространенном случае изменение температуры тела определяется соотношением теплоты и механической работы, переданных телу и отнятых от него.
В 1844—1854 гг. английский физик Д. Джоуль провел опыты, которым было суждено сыграть большую роль в науке. Цель, которую поставил перед собой Джоуль, состояла в том, чтобы установить соотношение между работой, затрачиваемой при выделении теплоты, и количеством выделившейся теплоты. Схема опыта Джоуля была следующей:
В теплоизолированный медный сосуд 1, заполненный водой, погружена мешалка 2, снабженная лопатками. К стенкам сосуда также прикреплены лопатки 3, затрудняющие движение воды при вращении мешалки. Мешалка приводится во вращение посредством опускания связанного с ней тросом через блок 5 груза 4 весом G. При опускании на высоту Δz работа, производимая грузом (и, следовательно, мешалкой), равняется убыли потенциальной энергии груза GΔz. Теплота, выделившаяся в сосуде с водой, вычисляется по повышению температуры воды, измеряемой термометром.
Следует заметить, что еще до того, как была окончательно установлена природа теплоты, удалось разработать достаточно точные методы измерения теплоты (калориметрия). Масса воды была заранее измерена. Учитывалось поглощение теплоты стенками сосуда, лопатками и мешалкой. Теплоемкость воды и металла была известна. В результате серии тщательно поставленных опытов Джоуль установил, что между затраченной работой L и количеством полученной теплоты Q существует прямая пропорциональность:
А - коэффициент пропорциональности. Джоуль нашел, что коэффициент пропорциональности А всегда сохраняет одно и то же значение независимо от способа получения теплоты, вида работы, температуры тела и т.д.
Иными словами, Джоуль установил, что при затрате одного и того же количества работы выделяется всегда одно и то же количество теплоты. Таким образом, было показано, что количество полученной теплоты эквивалентно количеству затраченной работы; понятно, что это соотношение справедливо и при совершении работы за счет затраты теплоты.
По результатам своих измерений Джоуль вычислил величину А, которая носит наименование теплового эквивалента работы, и J — механического эквивалента теплоты:
Как уже отмечалось, достаточно точные методы измерения теплоты (калориметрия) были разработаны еще в XVIII в., т.е. задолго до окончательного выяснения природы теплоты, на основе использования представлений о температуре и теплоемкости тела. В свое время наиболее часто употребляемой единицей измерения теплоты была калория, которую определяли как количество теплоты, необходимой для нагрева 1 г воды на 1 °С (соответственно килокалория, ккал, — это количество теплоты, необходимой для нагрева 1 кг воды на 1 °С). Однако впоследствии было обнаружено, что теплоемкость воды несколько изменяется с температурой и поэтому при разных температурах для нагрева 1 г воды на 1 °С требуются различные количества теплоты.
В этой связи потребовалось уточнить понятие калории, и была введена так называемая 15-градусная калория — количество теплоты, расходуемой на нагревание воды от 14,5 до 15,5 °С. В настоящее время для измерения количества теплоты и работы могут применяться различные единицы, соотношение между которыми приведено в табл. 1. Наиболее удобной для практического использования единицей является джоуль; ранее часто употреблялась международная (интернациональная) калория (1 калинт = 4,1868 Дж). Употреблялись также так называемая термохимическая калория (1 калтх = 4,1840 Дж) и упомянутая выше 15-градусная калория (1 кал15° = 4,1858 Дж).
Вскоре после опытов Джоуля была разработана молекулярно-кинетическая теория вещества, в соответствии с которой теплота является энергией хаотического теплового движения микрочастиц, составляющих тело. Как правило, для упрощения обозначений в термодинамических уравнениях не используют коэффициенты А и J — теплоту и работу измеряют в одинаковых единицах.
Спасибо за просмотр данного материала. В следующий материал будет посвящен закону сохранения и превращения энергии.
Постоянное эквивалентное отношение между теплотой и работой при их взаимных переходах установлено в классических опытах Д.П.Джоуля (1842-1867). Типичный эксперимент Джоуля заключается в следующем.
Падающий с известной высоты груз вращает мешалку, погруженную в воду, находящуюся в калориметре (груз и калориметр с водой составляют термодинамическую систему.) Вращение лопастей мешалки в воде вызывает нагревание воды; соответствующее повышение температуры количественно фиксируется.
После того, как указанный процесс закончен, система должна быть приведена в исходное состояние. Это можно сделать путем мысленного опыта. Груз поднимается на исходную высоту, при этом затрачивается извне работа, которая увеличивает энергию системы. Кроме того, от калориметра отнимается (передается в окружающую среду) теплота путем охлаждения его до исходной температуры. Эти операции возвращают систему к исходному состоянию, т. е. все измеримые свойства системы приобретают те же значения, которые они имели в исходном состоянии. Процесс, в течение которого свойства системы изменялись, и в конце которого она вернулась к исходному состоянию, называется круговым (циклическим) процессом или циклом.
Единственным результатом описанного цикла является отнятие работы от среды, окружающей систему, и переход в эту среду теплоты, взятой у калориметра.
Сравнение этих двух величин, измеренных в соответствующих единицах, показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Теплоту и работу в циклическом процессе целесообразно записать как сумму (интеграл) бесконечно малых (элементарных) теплот dQ и бесконечно малых (элементарных) работ dW, причем начальный и конечный пределы интегрирования совпадают (цикл).
Условимся считать положительными теплоту, полученную системой от окружающей среды, и работу, произведённую системой (энергия в форме работы передается при этом от системы к окружающей среде).
Тогда эквивалентность теплоты и работы в циклическом процессе можно записать так:
В уравнении (I, 1) знак обозначает интегрирование по циклу. Постоянство коэффициента k отражает эквивалентность теплоты и работы (k – механический эквивалент теплоты). Уравнение (I, 1) выражает закон сохранения энергии для частного, очень важного случая превращения работы в теплоту.
В исследованиях Джоуля, Роуланда (1880), Микулеску (1892) и др. использовались методы трения в металлах, удара, прямого превращения работы электрического тока в теплоту, растяжения твёрдых тел и др. Коэффициент k всегда постоянен в пределах ошибки опыта.
В дальнейшем изложении всегда предполагается, что работа и теплота с помощью коэффициента k выражены в одних единицах (безразлично каких) и коэффициент k опускается.
Постоянное эквивалентное отношение между теплотой и работой при их взаимных переходах установлено в классических опытах Д.П.Джоуля (1842-1867). Типичный эксперимент Джоуля заключается в следующем.
Падающий с известной высоты груз вращает мешалку, погруженную в воду, находящуюся в калориметре (груз и калориметр с водой составляют термодинамическую систему.) Вращение лопастей мешалки в воде вызывает нагревание воды; соответствующее повышение температуры количественно фиксируется.
После того, как указанный процесс закончен, система должна быть приведена в исходное состояние. Это можно сделать путем мысленного опыта. Груз поднимается на исходную высоту, при этом затрачивается извне работа, которая увеличивает энергию системы. Кроме того, от калориметра отнимается (передается в окружающую среду) теплота путем охлаждения его до исходной температуры. Эти операции возвращают систему к исходному состоянию, т. е. все измеримые свойства системы приобретают те же значения, которые они имели в исходном состоянии. Процесс, в течение которого свойства системы изменялись, и в конце которого она вернулась к исходному состоянию, называется круговым (циклическим) процессом или циклом.
Единственным результатом описанного цикла является отнятие работы от среды, окружающей систему, и переход в эту среду теплоты, взятой у калориметра.

Сравнение этих двух величин, измеренных в соответствующих единицах, показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Теплоту и работу в циклическом процессе целесообразно записать как сумму (интеграл) бесконечно малых (элементарных) теплот dQ и бесконечно малых (элементарных) работ dW, причем начальный и конечный пределы интегрирования совпадают (цикл).
Условимся считать положительными теплоту, полученную системой от окружающей среды, и работу, произведённую системой (энергия в форме работы передается при этом от системы к окружающей среде).
Тогда эквивалентность теплоты и работы в циклическом процессе можно записать так:
В уравнении (I, 1) знак обозначает интегрирование по циклу. Постоянство коэффициента k отражает эквивалентность теплоты и работы (k – механический эквивалент теплоты). Уравнение (I, 1) выражает закон сохранения энергии для частного, очень важного случая превращения работы в теплоту.
В исследованиях Джоуля, Роуланда (1880), Микулеску (1892) и др. использовались методы трения в металлах, удара, прямого превращения работы электрического тока в теплоту, растяжения твёрдых тел и др. Коэффициент k всегда постоянен в пределах ошибки опыта.
В дальнейшем изложении всегда предполагается, что работа и теплота с помощью коэффициента k выражены в одних единицах (безразлично каких) и коэффициент k опускается.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:


Эквивалентность количества теплоты и работы.
Эквивалентность теплоты и работы означает, что тепловое взаимодействие также может изменить внутреннюю энергию системы, поскольку оно приводит к повышению или понижению температуры.

Работа может приводить к изменению температуры системы, не увеличивая ее механическую энергию. Значит система имеет внутреннюю энергию, связанную с температурой, кинетическую энергию, связанную с ее скоростью, и потенциальную энергию, связанную с ее положением в поле тяжести.
Доказательство эквивалентности теплоты и работы. Эквивалентность означает, что отношение количества теплоты к величине работы, которые вызывают одно и то же наблюдаемое изменение в системе (например, повышают ее температуру на 10°С), всегда одинаково. В метрической системе оно равно 4,1858 Дж/кал.

Механический эквивалент теплоты - 4,1858 Дж/кал.
В СИ количество теплоты выражают в джоулях, а удельную теплоёмкость – в джоулях на килограмм-кельвин.

Количество переданной теплоты оказалось эквивалентным работе : механический эквивалент теплоты 4,2 Дж/кал.
Вывод:
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 922 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 28 человек из 18 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дистанционные курсы для педагогов
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 612 961 материал в базе
Материал подходит для УМК
§ 5.3. Эквивалентность количества теплоты и работы
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 27.03.2021 167
- PPTX 546.4 кбайт
- 1 скачивание
- Оцените материал:
Настоящий материал опубликован пользователем Акиньшина Светлана Павловна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Россияне ценят в учителях образованность, любовь и доброжелательность к детям
Время чтения: 2 минуты
Школы граничащих с Украиной районов Крыма досрочно уйдут на каникулы
Время чтения: 0 минут
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Новые курсы: преподавание блогинга и архитектуры, подготовка аспирантов и другие
Время чтения: 16 минут
ГИА для школьников, находящихся за рубежом, может стать дистанционным
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Декремент затухания, количественная характеристика быстроты затухания колебаний. Д. з. d равен натуральному логарифму отношения двух последующих максимальных отклонений х колеблющейся величины в одну и ту же сторону:

Д. з. — величина, обратная числу колебаний, по истечении которых амплитуда убывает в е раз. Например, если d = 0,01, то амплитуда уменьшится в е раз после 100 колебаний. Д. з. характеризует число периодов, в течение которых происходит затухание колебаний, а не время такого затухания. Полное время затухания определяется отношением Т/d.
Добротность колебательной системы.
Добротность колебательной системы, отношение энергии, запасённой в колебательной системе, к энергии, теряемой системой за один период колебания. Добротность характеризует качество колебательной системы, т.к. чем больше Д. к. с., тем меньше потери энергии в системе за одно колебание. Д. к. с. Q связана с логарифмическим декрементом затухания d; при малых декрементах затухания Q " p/d. В колебательном контуре с индуктивностью L, ёмкостью C и омическим сопротивлением R Д. к. с.
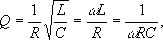
где w — собственная частота контура. В механической системе с массой m, жёсткостью k и коэффициентом трения b Д. к. с.

Добротность — количественная характеристика резонансных свойств колебательной системы, указывающая, во сколько раз амплитуда установившихся вынужденных колебаний при резонансе превышает амплитуду вынужденных колебаний вдали от резонанса, т. е. в области столь низких частот, где амплитуду вынужденных колебаний можно считать не зависящей от частоты. На этом свойстве основан метод измерения Д. к. с. Величина добротности характеризует также и избирательность колебательной системы; чем больше добротность, тем уже полоса частот внешней силы, которая может вызвать интенсивные колебания системы. Экспериментально Д. к. с. обычно находят как отношение частоты собственных колебаний к полосе пропускания системы, т. е. Q = w/Dw. Численные значения Д. к. с.: для радиочастотного колебательного контура 30—100; для камертона 10000; для пластинки пьезокварца 100000; для объёмного резонатора СВЧ колебаний 100—100000.
Равновесные термодинамические системы. Эквивалентность теплоты и работы. Внутренняя энергия. Первое начало термодинамики.
Термодинамическое равновесие — состояние изолированной термодинамической системы, при котором в каждой точке для всех химических, диффузионных, ядерных, и других процессов скорость прямой реакции равна скорости обратной.
Термодинамическое равновесие можно делить на термическое, механическое и химическое равновесие, выделяя различные типы физических процессов, на которых достигнуто состояние равновесия.
Согласно нулевому началу термодинамики к термодинамическому равновесию стремитсятермодинамическая система, изолированная от внешних воздействий.
На практике условие изолированности означает, что процессы внутри системы протекают гораздо быстрее, чем обменные процессы с внешней средой.
В реальных процессах часто реализуется неполное равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
1. локальное равновесие — равновесие достигается в какой-либо части (или частях) относительно большой по размерам системы;
2. частичное равновесие — неполное равновесие достигается вследствие разности скоростей релаксационных процессов, протекающих в системе;
3. смешанное — имеют место как локальное, так и частичное равновесие.
МЕХАНИЧЕСКИЙ ЭКВИВАЛЕНТ ТЕПЛОТЫ - количество работы, эквивалентное единице количества теплоты (1 кал или 1 ккал). Понятие M. э. т. возникло с установлением эквивалентности механич. работы ц теплоты и открытием энергии сохранения ,закона. Введение M. э. т. потребовалось для сопоставления значений этих физ. величин, измерявшихся в разл. единицах. Экспериментально установлено, что 1 ккал = 426,9 кгс*м.
В Международной системе единиц СИ для работы и кол-ва теплоты принята одна единица измерения - джоуль (1 Дж = 0,239 кал = 0,102 кгс*м), поэтому пользоваться понятием M. э. т. нет необходимости.
Первое начало термодинамики — одно из основных положений термодинамики, являющееся, по существу, законом сохранения энергии в применении к термодинамическим процессам.
Первое начало термодинамики было сформулировано в середине XIX в. в результате работ Ю. Р. Майера, Джоуля и Г. Гельмгольца. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Первый закон (первое начало) термодинамики можно сформулировать так:
ΔU = Q − A + μΔN + A'.
Для элементарного количества теплоты δQ, элементарной работы δA и малого приращения (дифференциала) dU внутренней энергии первый закон термодинамики имеет вид:
dU = δQ − δA + μdN + δA'.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая – работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что dU и dN являются дифференциалами, а δA и δQ - нет. Приращение теплоты часто выражают через температуру и приращение энтропии: δQ = TdS.
Читайте также:
- Принципы органов исполнительной власти кратко
- Инновационные методы работы старшего воспитателя с педагогами доу
- Книга своими руками в детский сад на тему домашние животные
- Содержание инвалидов и престарелых в учреждениях социальной защиты населения кратко
- Общая характеристика источников загрязнения окружающей среды кратко

