Донор в химии это определение кратко
Обновлено: 05.07.2024
An донор электронов химическое образование, которое жертвует электроны в другое соединение. Это Восстановитель что, благодаря своим электронным донорам, сам является окисленный в процессе.
Типичные восстановители подвергаются постоянным химическим изменениям в результате ковалентной или ионной химии. Это приводит к полному и необратимому переносу одного или нескольких электронов. Однако во многих химических условиях перенос электронного заряда на акцептор электронов может быть только дробным, что означает, что электрон не переносится полностью, но приводит к электронному резонансу между донором и акцептором. Это приводит к образованию комплексы с переносом заряда в котором компоненты в значительной степени сохраняют свою химическую идентичность.
Электронодонорная способность донорной молекулы измеряется ее потенциал ионизации что является энергией, необходимой для удаления электрона из наиболее занятой молекулярная орбиталь.
Общий баланс энергии (ΔE), то есть энергия, полученная или потерянная при донорно-акцепторном переносе электронов, определяется разницей между акцепторным электронное сродство (A) и потенциал ионизации (I):
В химия, класс доноров электронов, которые отдают не один, а набор из двух парных электронов, образующих Ковалентная связь с молекулой акцептора электронов, известна как База Льюиса. Это явление порождает широкую область Кислотно-основание Льюиса химия. [1] Движущие силы для поведения доноров и акцепторов электронов в химии основаны на концепциях электроположительность (для доноров) и электроотрицательность (для акцепторов) атомных или молекулярных объектов.
Содержание
В биологии
В биологиядоноры электронов освобождают электрон во время клеточное дыхание, в результате чего был выпущен энергия. Микроорганизмы, Такие как бактерии, получить энергию в процессах переноса электрона. Через свой клеточный механизм микроорганизм собирает энергию для своего использования. В конечном результате электрон передается акцептору электронов. Во время этого процесса (электронная транспортная цепь) донор электронов окисляется, а акцептор электронов восстанавливается. Нефть углеводороды, меньше хлорированный растворители, такие как винилхлорид, органическое вещество почвы, и восстановленные неорганические соединения - все соединения, которые могут действовать как доноры электронов. Эти реакции представляют интерес не только потому, что они позволяют организмам получать энергию, но и потому, что они участвуют в естественных процессах. биоразложение органических загрязнителей. Когда профессионалы по очистке используют контролируемое естественное ослабление для очистки загрязненных участков, биоразложение является одним из основных процессов, способствующих этому.
донор Термин донор Термин на английском donor Синонимы Основание Льюиса Аббревиатуры Связанные термины акцептор, донорно-акцепторное взаимодействие Определение (от лат. dono — дарю) — атом или молекула, отдающая акцептору электрон или электронную пару Описание
В широком смысле донор может отдавать разные частицы - электрон, протон, молекулу. Если не указан тип такой частицы, считается, что - электрон.
В физике донор - примесный атом в полупроводнике, ионизация которого (в результате теплового движения или внешнего воздействия) приводит к появлению электрона в зоне проводимости. Например, для Ge и Si типичные доноры — атомы элементов V группы периодической системы P, As, Sb. Донором может быть точечный дефект кристаллической решётки.
В химии понятие "донор" относится, в первую очередь, к кислотно-основным реакциям. Донором называют молекулу или частицу, способную отдать свою электронную пару акцептору и образовать с ним ковалентную донорно-акцепторную связь. В обобщенной теории кислот и оснований донор называют основанием Льюиса. Типичные доноры - атомы неметаллов, в первую очередь O и N, а также содержащие их молекулы, группы атомов и отрицательные ионы, например H 2 O, OH - , NH 3 , CN - .
- Еремин Вадим Владимирович, д.ф.-м.н.
- Физический энциклопедический словарь. - М.: "Большая Российская энциклопедия", 1995. - 928 с.
Энциклопедический словарь нанотехнологий. — Роснано . 2010 .
Полезное
Смотреть что такое "донор" в других словарях:
ДОНОР — человек, предоставляющий свою кровь для лечебных целей. Кровь, взятая от доноров, служит основным источником для переливания крови. Донорство в СССР является общественным делом. Права и обязанности доноров в нашей стране нормируются… … Краткая энциклопедия домашнего хозяйства
ДОНОР — [ Словарь иностранных слов русского языка
Донор — (donor) Лицо, делающее подарок или передающее имущество другому лицу – получающему дар (donee). Бизнес. Толковый словарь. М.: ИНФРА М , Издательство Весь Мир . Грэхэм Бетс, Барри Брайндли, С. Уильямс и др. Общая редакция: д.э.н. Осадчая И.М..… … Словарь бизнес-терминов
Донор — кредитор, предоставляющий ссуду на льготных условиях или безвозмездно с целью оказания финансовой помощи. По английски: Donor См. также: Кредиторы Финансовый словарь Финам … Финансовый словарь
донор — датель Словарь русских синонимов. донор сущ., кол во синонимов: 1 • датель (5) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ДОНОР — 1) лицо, сдающее кровь для медицинских целей (Закон РФ О донорстве крови и ее компонентов от 9 июня 1993 г.); 2) лицо, изъявившее согласие на пересадку своих органов и (или) тканей другому человеку (Закон РФ О трансплантации органов и (или)… … Юридический словарь
ДОНОР — (от латинского donare дарить), человек, добровольно сдающий кровь для использования ее в лечебных целях или ткань, орган (например, почку) для пересадки … Современная энциклопедия
ДОНОР — дефект кристаллической решетки полупроводника (обычно примесный атом), способный отдавать электроны в зону проводимости (пример донора примесный атом Sb в кристалле Ge) … Большой Энциклопедический словарь
ДОНОР — (от лат. dono дарю) человек, добровольно сдающий кровь (для использования ее в лечебных целях) или ткань, орган (напр., почку) для пересадки … Большой Энциклопедический словарь
ДОНОР — ДОНОР, а, муж. Человек, дающий свою кровь для переливания, для медицинских целей, а также дающий какой н. орган, ткань кому н. другому. | прил. донорский, ая, ое. Донорская кровь. Д. пункт. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова.… … Толковый словарь Ожегова
ДОНОР — (от лат. dono дарю), примесный атом в полупроводнике, ионизация к рого (в результате теплового движения или внеш. воздействия) приводит к появлению эл на в зоне проводимости. Напр., для Ge и Si типичные Д. атомы элементов V группы периодич.… … Физическая энциклопедия
донор (англ. donor) — (от лат. dono — дарю) — атом или молекула, отдающая акцептору электрон или электронную пару.
Описание
В широком смысле донор может отдавать разные частицы: электрон, протон, молекулу. Если не указан тип такой частицы, считается, что отдается электрон.
В физике донор — примесный атом в полупроводнике, ионизация которого (в результате теплового движения или внешнего воздействия) приводит к появлению электрона в зоне проводимости. Например, для Ge и Si типичные доноры — атомы элементов V группы периодической системы P, As, Sb. Донором может быть точечный дефект кристаллической решетки.
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.

Ковалентная связь ( лат. со - совместно + valens - имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
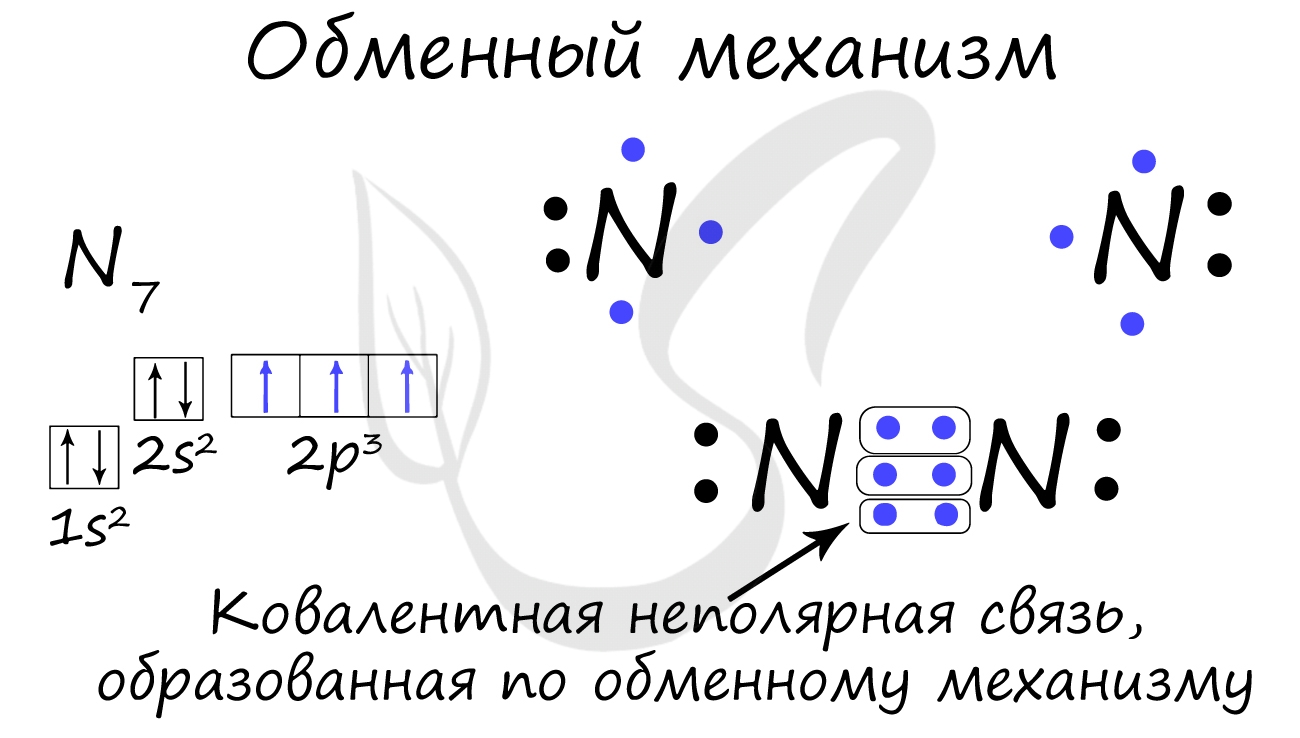
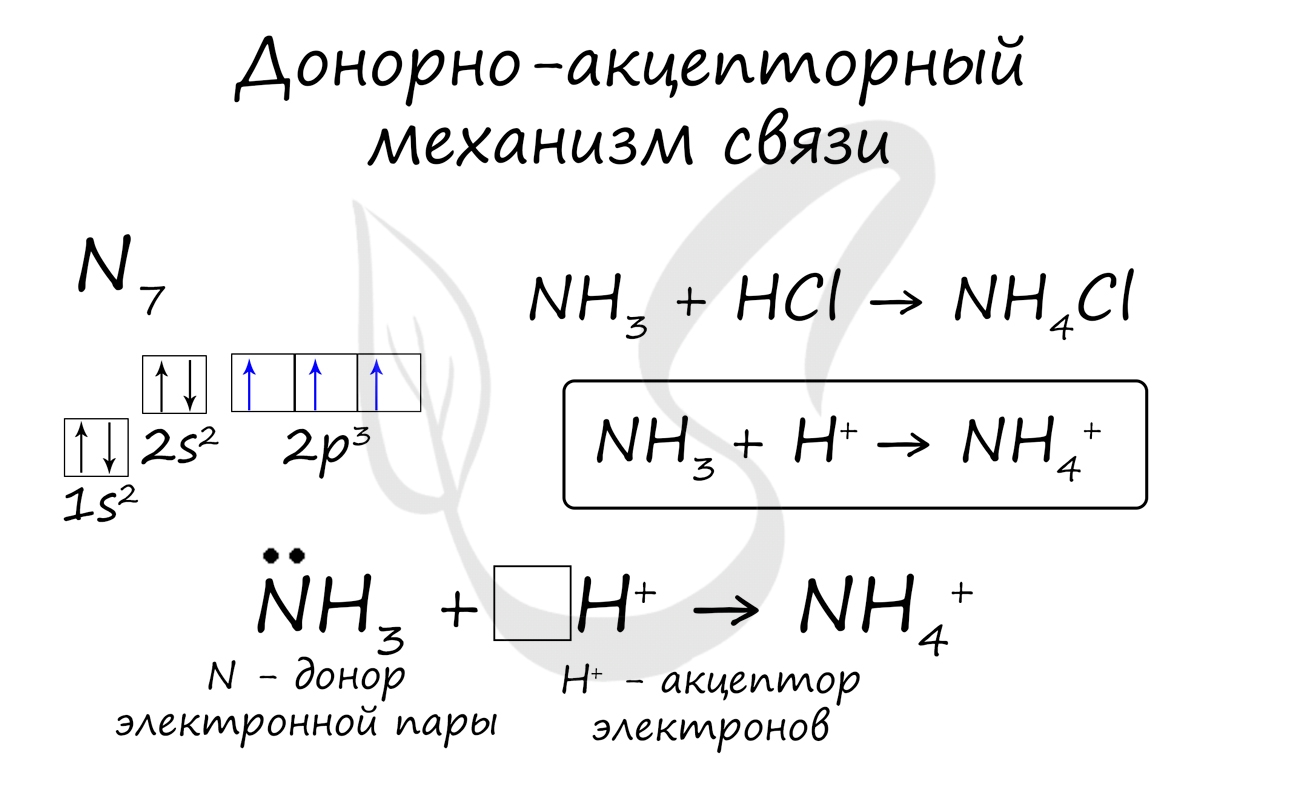
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
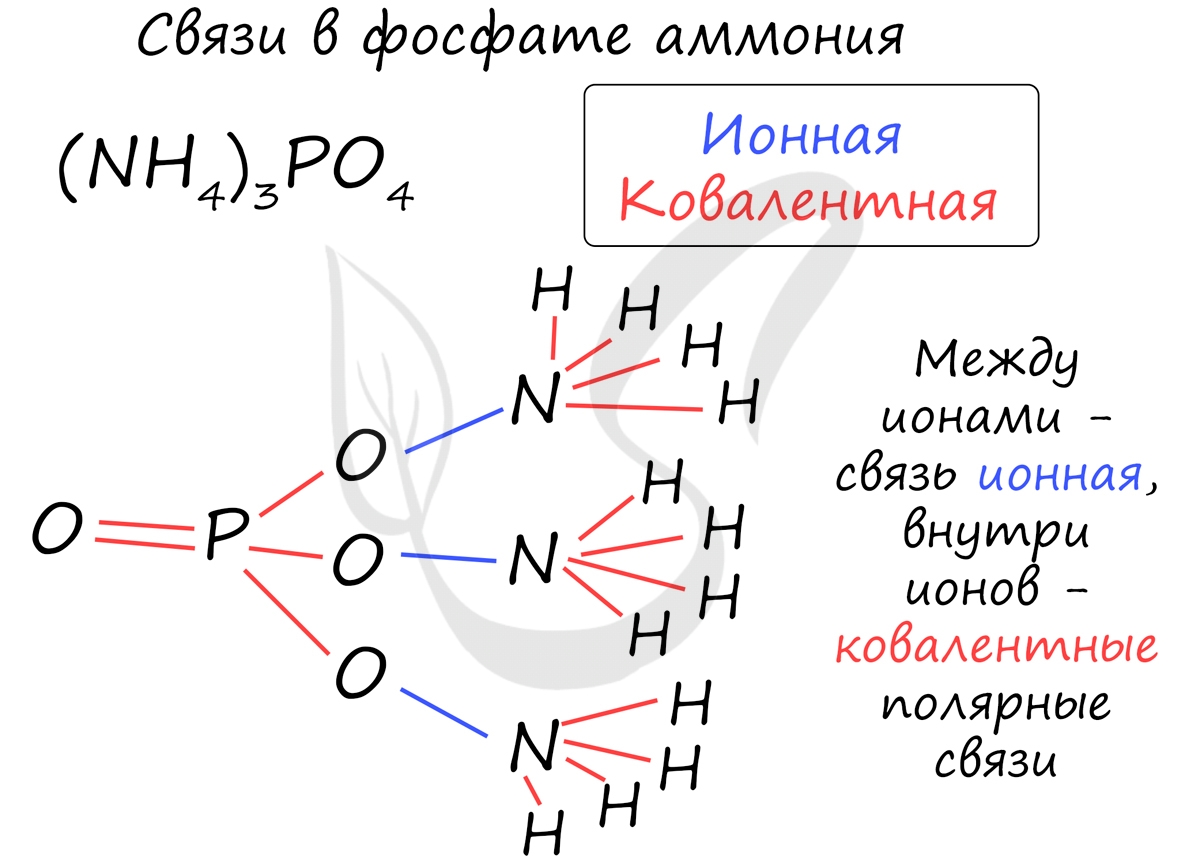
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Донор электронов – соединение (вещество или молекула), отдающее электроны в ходе окислительно-восстановительной реакции (редокс-реакции). Кроме того, в окислительно-восстановительных реакциях принимает участие акцептор электронов [1] .
Например, пурпурные серные бактерии семейства Chromatiaceae для восстановления CO2 в органическое вещество, в качестве донора электронов используют сероводород (H2S) [2] .
Самостоятельное существование электронов не возможно. Отделяясь от молекул-доноров, они немедленно присоединяются к молекулам способным их присоединить (акцепторам электронов). Установлено, что донором электроном предельно окисленное вещество являться не может [2] .
Читайте также:

