Диаграммы состояния двухкомпонентных систем кратко
Обновлено: 05.07.2024
Глава 16. Фазовые равновесия в многокомпонентных системах
16.1. Метод физико-химического анализа
Метод физико-химического анализа основан на изучении зависимости физических свойств системы от параметров, определяющих ее равновесие. В качестве изучаемых свойств могут быть выбраны тепловые, объемные, электрические, магнитные, оптические и другие свойства системы. Нас будет интересовать агрегатное состояние системы при изменении состава и температуры системы. Анализ системы будем делать с помощью диаграммы состояния. Диаграмма состояния (или фазовая диаграмма) представляет собой графическое изображение зависимости между параметрами состояния системы и фазовыми превращениями в системе. Диаграммы состояния или строят на основании экспериментальных данных в координатах [температура, состав системы] или рассчитывают. Анализ диаграмм состояния позволяет установить протекающие в системе качественные изменения, характер взаимодействия между компонентами, области существования и составы равновесных фаз.
Рассмотрим один из методов получения диаграммы состояния двухкомпонентной системы в координатах [состав расплава — температура образца] (рис. 16.1). Состав образца будем выражать в мольных долях; по оси ОХ будем откладывать мольную долю компонента В в системе. Приготовим ряд образцов, в котором мольная доля В будет изменятся от нуля до единицы и для каждого образца получим экспериментальные кривые охлаждения расплава (см. рис. 16.1). Кривая А охлаждения расплава соответствует образцу, в котором мольная доля В равна нулю, x b = 0 (образец состоит из компонента А), кривая 20 — образцу, в котором x b = 0,2, кривая 30 — образцу с x b = 0,3 и т. д. На кривых А и В ступенька на кривой охлаждения соответствует температуре кристаллизации вещества А или В соответственно. По точкам перегиба на кривых охлаждения расплава 10, 20 и т. д. получаем температуру кристаллизации соответствующего компонента из расплава. Например, точка перегиба на кривой 10 соответствует точке М на диаграмме состояния (рис. 16.2).

Рис. 16.1. Кривые охлаждения расплава

Рис. 16.2. Диаграмма состояния двухкомпонентной системы
Ступенька на кривой 10 соответствует температуре эвтектики на диаграмме состояния (см. раздел 2.1). Отметим, что на кривой охлаждения расплава 40 нет точки перегиба. Это означает, что при охлаждении данного расплава кристаллизация веществ А и В из расплава происходит при одной температуре.
16.2. Общая характеристика диаграмм состояния двухкомпонентных систем
Для двухкомпонентных систем, без учета давления как переменного параметра, правило фаз приобретает вид: С = К – Ф + 1. Диаграмма состояния двухкомпонентной системы (см. рис. 16.2) получена на основании анализа кривых охлаждения образцов (см. рис. 16.1). Из анализа кривых А и В получены температуры кристаллизации веществ А и В (Т 0 А и Т 0 В ). Точки перегиба на кривых 10, 20, 30 соответствуют температурам кристаллизации вещества А из расплава. Точки перегиба на кривых 60, 80 — кристаллизации вещества В из расплава. Температура Т = 200 ° С — это температура эвтектики Т эв . При этой температуре (при охлаждении расплава любого состава) будут находиться в равновесии три фазы: кристаллы вещества А, кристаллы вещества В и расплав состава: мольная доля В в расплаве равна 0,4, мольная доля А — 0,6. Отметим некоторую особенность кривой охлаждения 40; в расплаве 40 мольная доля В равна 0,4 (соответственно, мольная доля А — 0,6) и на данной кривой нет точки перегиба. Это означает, что при Т = Т эв (200 ° С) из расплава, одновременно, происходит кристаллизация вещества А и В. Расплав такого состава называется эвтектическим . Горизонтальная линия, проведенная через точку N, называется линия солидуса ; она определяет верхнюю границу полей, содержащих только твердые фазы. Линии MN и SN называются линии ликвидуса ; они определяют нижние границы однофазного поля расплава. Точки на диаграмме (например, точка N) называются фигуративные точки. Отметим хорошо известную особенность расплава двух компонентов — если к расплаву чистого вещества А добавлять возрастающее количество вещества В, то, в соответствии с законом Рауля, будет наблюдаться прогрессирующее понижение температуры кристаллизации.
16.3. Диаграмма состояния двухкомпонентной системы с простой эвтектикой и с полиморфными превращениями компонентов
16.4. Диаграмма состояния двухкомпонентной системы с образованием химического соединения, плавящимся без разложения (конгруэнтно)
При охлаждении бинарного расплава в системе возможно образование химического соединения. Если это соединение плавится конгруэнтно A m B n = mA + nB, то будет образовываться эвтектика как с компонентом А, так и с компонентом В, а на диаграмме появится вертикальная линия и температурный максимум (рис. 16.4). Вертикальная линия определяет состав вновь образовавшегося соединения и делит диаграмму на две части, каждая из которых может рассматриваться как самостоятельная двойная система. Температурный максимум определяет верхний температурный предел устойчивости вещества A m B n .

Рис. 16.4. Система волластонит глинозем
Сделаем анализ диаграммы состояния волластонит + глинозем, (см. рис. 16.4). Особенность процесса охлаждения расплава: при охлаждении расплава волластонита в присутствии глинозема (алюмината кальция) происходит образование геленита, т. е. образуется вещество, которое отсутствовало в начальном состоянии системы. При температуре Т 1 , соответствующей фигуративной точке 1, в системе одна фаза — расплав, в котором мольная доля глинозема х Са = 0,4. При температуре Т 2 , в результате реакции между волластонитом и глиноземом, начнется кристаллизация геленита:
Ca 2 Al 2 SiO 7 .
При Т = Т 3 продолжается образование геленита в расплаве состава: мольная доля глинозема Х са = 0,3; мольная доля волластонита 0,7. При Т = Т 4 = Т эв1 из расплава начнет выделятся волластонит; в системе три фазы: расплав, в котором мольная доля глинозема 0,2, кристаллы геленита и волластонита. При понижении температуры образца ниже T эв1 образуется эвтектическая твердая фаза из кристаллов α -волластонита и геленита. Отметим важную особенность анализируемой системы: наличие полиморфного превращения волластонита: при Т ° С α -волластонит превращается в β -волластонит. Далее: геленит не может существовать в виде жидкой фазы. При нагревании выше 1596 о С геленит разлагается на волластонит и глинозем (конгруэнтное плавление геленита).
16.5. Диаграмма состояния двухкомпонентной системы с образованием химического соединения, которое плавиться инконгруэнтно

Рис. 16.5. Диаграмма состояния двухкомпонентной системы
с химической реакцией между компонентами
При температуре, соответствующей точке Р, Т Р = Т 4 = 800 ° С из расплава начнут выделятся кристаллы вещества A m B n , которые образуются в результате химической реакции mA + nB = A m B n . Таким образом, при Т = Т 4 = 800 ° С в системе три фазы: расплав, с мольной долей В, равной 0,5, кристаллы вещества A m B n и кристаллы вещества В. После того, как закончится процесс кристаллизации расплава, при Т 4 (например при Т = Т 5 ) в системе две фазы: кристаллы вещества В и кристаллы вещества А m В n . Разобранная диаграмма соответствует, например, системе кальцит (компонент А) + нефелин (компонент В). Компоненту A m B n соответствует канкринит Ne 3 CaCO 3 (Ne — нефелин).
16.6. Диаграмма состояния двухкомпонентной системы с ликвацией
При охлаждении расплава может произойти расслоение в жидкой фазе, т. е. образование жидкостей, не смешивающихся друг с другом. Это явление называется ликвацией. На рисунке 16.6 приведена диаграмма состояния двухкомпонентной системы (А и В) с ликвацией.

Рис. 16.6 . Диаграмма состояния двухкомпонентной
системы с ликвацией
На диаграмме по оси ОХ отложена мольная доля компонента В в системе. Т А и Т В — температуры кристаллизации компонентов А и В соответственно. Ликвация (область диаграммы [eLfe] будет иметь место только для системы, в которой изначально мольная доля компонента В в системе будет лежать в пределах 0,2 b В = 0,3. Нагреем образец до температуры выше линии ликвидуса, например, до температуры Т = Т 1 = 800 ° С, которая соответствует фигуративной точке 1. При температуре Т 1 в системе одна фаза — двухкомпонентный расплав, в котором мольная доля компонента А x А = 0.7, x В = 0,3. При охлаждении образца, при температуре Т 2 , произойдет расслоение расплава, появится вторая жидкая фаза (расплав), в которой x В = 0,66. При последующем охлаждении расплава мы будем двигаться по кривой ликвидуса от точки 2 к точке d , затем к точке e , n и c . При температуре Т = Т 3 (которая соответствует фигуративной точке d ) в системе две жидкие фазы — два несмешивающихся расплава: первый расплав, в котором мольная доля компонента В равна x d1 и второй расплав состава x B = x d2 . При Т = Т 4 (температура эвтектики Т эв2 ) в системе три фазы: из жидкой фазы начнется выделение кристаллов В; расплав, в котором x В = 0,2 и расплав, в котором x В = 0,7. При Т 4 жидкая фаза опять будет однородной (ликвация отсутствует). В точке n (которой соответствует температура Т = Т 5 ) в системе две фазы: кристаллы В и расплав, в котором x В = x n = 0,25. В точке эвтектики с (при Т = Т 6 = Т эв1 ) в системе три фазы: кристаллы А, кристаллы В и расплав с x В = 0,1. При последующем охлаждении, когда исчезнет расплав, при Т 6 в системе образуется эвтектическая смесь кристаллов веществ А и В.
16.7. Диаграмма состояния двухкомпонентных систем с образованием твердых растворов
При охлаждении двухкомпонентного расплава возможно образование твердых растворов (см. главу 10). Если содержащиеся в твердом растворе компоненты растворяются друг в друге в любых соотношениях, то образуется непрерывный ряд твердых растворов. Если же компоненты растворяются лишь до определенных пределов концентрации, то такой раствор называется твердым раствором с ограниченной растворимостью. На рисунке 16.7 приведена диаграмма состояния двухкомпонентной системы с образованием непрерывного ряда твердых растворов. Данного типа диаграмма состояния характерна, например, для системы анортит (СаО × Al 2 О 3 × 2SiО 2 ) и альбит (Na 2 O × Al 2 O 3 × 6SiO 2 ). При охлаждении расплава этих компонентов образуется непрерывный ряд твердых растворов — плагиоклазы. Геленит (СаO × Al 2 O 3 × SiO 2 ) с окерманитом (2СаО × МgО × 2SiО 2 ) дает непрерывный ряд твердых растворов мелилиты.

Рис. 16.7. Диаграмма состояния двухкомпонентной системы
с образованием твердых растворов
Проведем анализ диаграммы состояния на рисунке 16.7. Верхняя кривая на диаграмме — линия ликвидуса, с помощью которой можно определить состав расплава в системе, нижняя кривая — линия солидуса, с помощью которой можно определить состав твердого раствора при заданной температуре в системе. По оси ОХ отложена мольная доля компонента В. Т А и Т В температуры кристаллизации компонентов А и В соответственно. Приготовим образец, в котором мольная доля компонента В х В = 0,4. Нагреем образец до температуры выше линии ликвидуса, например до Т = Т 1 = 925 ° С (данная температура соответствует фигуративной точке 1 диаграммы). Если расплав (x В = 0,4) охлаждать от температуры Т 1 до Т 2 , при Т = Т 2 из расплава начнут выделятся кристаллы твердого раствора состава x В = 0,92, x А = 0,08 (твердый раствор состава А 08 В 92 ). При охлаждении расплава от Т 2 до Т 4 мы будем перемещаться по линии ликвидуса от точки m точке n и далее к точке T A . В этом случае будет иметь место выделение из расплава кристаллов твердого раствора, состав которого зависит от температуры расплава. Например, при Т = Т 3 , расплав (x В ≈ 0,12) находится в равновесии с твердым раствором, А 30 В 70 . При Т 4 в системе одна фаза — твердый раствор, в котором мольная доля компонента В, x В = 0,4 (твердый раствор состава А 60 В 40 ).
16.8. Диаграммы состояния трехкомпонентных систем. Основные понятия и определения. Треугольник Гиббса
Диаграмма состояния трехкомпонентной системы даже при условии, что давление в системе постоянно — это трехмерная картинка. Как правило — это треугольная призма, грани которой представляют собой диаграммы состояния двойных систем. При изучении тройных систем обычно пользуются проекциями пространственных фигур на основание призмы. При использовании проекций диаграмм состояния на плоскость основания призмы для каждой точки проекции указывается температура образца.
Для определения состава расплава или твердого раствора пользуются методом расчета состава, предложенный Гиббсом (треугольник Гиббса). Если в основание призмы положить равносторонний треугольник АВС и ВН = Н — высота треугольника (рис. 16.8), то легко показать, что для любой точки треугольника сумма отношений перпендикуляров, опущенных из этой точки на стороны треугольника к высоте треугольника Н, равна единице. Например, для точки а: h а / H + h в / H + h с / H = 1. Если положить, что отношение h a /H пропорционально мольной доле компонента А в расплаве, а h b / H и h с / H — мольной доле В и С соответственно, то мы получаем возможность определить состав расплава для любой точки Δ АВС. Отметим, что при построении диаграмм состояния трехкомпонентных систем используют и другие методы определения состава расплава. Например, стороны треугольника делят на десять равных частей и проводят линии, параллельные сторонам треугольника.

Рис. 16.8. Треугольник Гиббса
16.9. Диаграмма состояния трехкомпонентной системы с простой эвтектикой
На рис.16.9 приведена диаграмма состояния трехкомпонентной системы с простой эвтектикой. Пусть температура системы такова, что в точке b две фазы: кристаллы вещества В находятся в равновесии с расплавом, в котором мольная доля В x b = h b /H, мольная доля, А x a = h a /H и x c = h c /H (Н — высота Δ АВС). При охлаждении расплава мы будем двигаться по прямой В-b-d, при этом будет продолжаться выделение кристаллов В из расплава, а состав расплава будет соответствовать координатам прямой b — d. В точке d начнется выделение кристаллов c из расплава. При дальнейшем понижении температуры мы будем двигаться к точке тройной эвтектики — Э (рис. 16.9).
При температуре расплава, соответствующей точке Э в системе четыре фазы: кристаллы В, кристаллы А, кристаллы С и эвтектический расплав, состав которого соответствует координате точки Э. При дальнейшем понижении температуры образца, при Т эв (когда исчезнет расплав), в системе эвтектическая смесь кристаллов А, В, и С. Координаты точек Э АВ , Э ВС , Э АС соответствуют температуре и расплавам двойных эвтектик. В общем случае диаграммы состояния трехкомпонентных систем — очень сложные и содержат большое количество взаимнопересекающихся линий, которые разграничивают области равновесного состояния различных фаз системы.

Рис. 16.9. Диаграмма состояния трехкомпонентной
системы с простой эвтектикой
16.10. Диаграмма состояния трехкомпонентной системы с химическими соединениями,
плавящимися конгруэнтно
В системе LiF + NaF + MgF 2 при охлаждении расплава образуется двойное соединение состава NaMgF 3 , которое плавится конгруэнтно. На рисунке 16.10 приведена диаграмма состояния данной системы. Определим одно важное понятие, которое часто используется при анализе диаграмм состояния тройных систем: линия Алькемаде или бинодаль Нода, или конода; это все одно и то же. Линия Алькемаде — это прямая линия, соединяющая точки составов двух фаз, первичные поля кристаллизации которых имеют общую пограничную кривую. Например, поля первичной кристаллизации (см. рис. 16.10) LiF и NaF разделены граничной кривой АВ. Следовательно, сторона треугольника составов, соединяющая LiF и NaF, является линией Алькемаде. Линия LiF — C — NaMgF 3 — линия Алькемаде или конода. Теорема Алькемаде утверждает, что пересечение коноды с соответствующей пограничной кривой происходит в точке температурного максимума; точка С на коноде LiF — NaMgF 3 — точка максимума температуры на граничной кривой. Стрелками на граничных кривых показаны направления понижения температуры при охлаждении расплава.

Рис. 16.10. Диаграмма состояния трехкомпонентной системы
с образованием двойного соединения,
которое плавится конгруэнтно
1. Цель работы:освоить термический анализ: снять кривые охлаждения чистых компонентов и бинарных смесей различного состава; на основании кривых охлаждения построить диаграмму плавкости и анализировать ее.
Теоретическая часть
Основные понятия и определения
Анализ диаграмм плавкости осуществляется с помощью правила фаз Гиббса, которое опирается на понятия “фаза, компонент, степень свободы”.
Правило фаз основано на втором законе термодинамики и относится к системам, находящимся в состоянии термодинамического равновесия.
Фазой называется гомогенная часть гетерогенной системы, отделенная от других частей поверхностью раздела, на которой скачком изменяются какие-либо свойства.
Компонентом называется такая часть системы, содержание которой не зависит от содержания других частей. Компоненты могут быть выделены из системы и существовать вне ее. Смесь газов является однофазной, но многокомпонентной системой. Вода, лед также являются однофазными, но однокомпонентными системами, так как водород и кислород в них входят в определенных соотношениях: количество одного зависит от количества другого. Число компонентов системы - это наименьшее число составных частей, достаточное для образования всех фаз системы.
Число степеней свободы–число независимых переменных (температура, давление, концентрация), которые можно изменять в некоторых пределах так, чтобы число и природа фаз оставались прежними. Если число степеней свободы равно нулю (инвариантная система), то нельзя изменять внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызывало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных параметров, и это не вызовет уменьшения или увеличения числа фаз.
Правило фаз Гиббса
Является законом фазового равновесия. Оно представляет собой математическое выражение условий равновесия системы, то есть показывает количественную зависимость между числом степеней свободы системы (С), числом независимых компонентов (К) и числом фаз (Ф). Если на равновесие в системе влияет n внешних факторов, то правило фаз Гиббса запишется следующим образом:
С = К – Ф + n (1)
Из уравнения (1) следует, что число степеней свободы (С) возрастает с увеличением числа независимых компонентов (К) и уменьшается при росте числа фаз (Ф). Для однокомпонентной (К = 1) системы при изменении двух внешних факторов температуры и давления (n = 2), максимальное количество фаз равно трем (твердая, жидкая и газообразная).
Правило фаз Гиббса для однокомпонентной системы: в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только температура и давление, число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два.
Фазовые диаграммы состояния двухкомпонентных систем
Диаграмма состояния - графическое изображение зависимости какого-либо свойства системы от ее состава. Диаграммы состояния строят по экспериментальным данным в координатах температура – состав. Они широко применяются при изучении различных минералов, силикатных систем, горных пород, металлических сплавов, водных растворов солей и др.
К основным типам диаграмм состояния двухкомпонентных конденсированных систем относятся:
· диаграмма с простой эвтектикой;
· диаграмма с образованием устойчивого химического соединения (конгруэнтно плавящегося);
· диаграмма с образованием неустойчивого химического соединения (инконгруэнтно плавящегося);
· диаграмма с неограниченной взаимной растворимостью компонентов в твердом состоянии;
· диаграмма с ограниченной растворимостью компонентов в твердом состоянии (I и II вида);
· диаграмма с ограниченной взаимной растворимостью компонентов в жидком состоянии.
Для таких систем при р = const, правило фаз Гиббса имеет вид:
2.3.1. Диаграмма состояния системы с эвтектикой
Является наиболее простой диаграммой состояния, в которой компоненты неограниченного смешиваются друг с другом в жидком состоянии. Однако совершенно не смешиваются в твердом состоянии, химически не взаимодействуют друг с другом и не образуют твердых растворов.
Диаграмма состояния системы с простой эвтектикой для компонентов А и В схематически представлена на рис.1.
Рис.1. Диаграмма состояния с эвтектикой
ТАЕ – линия ликвидуса (каждая точка на линии показывает состав расплава, который находится в равновесии с кристаллами А);
ТВЕ – линия ликвидуса (в равновесии с кристаллами В);
FEG – линия солидуса (линия эвтектики);
Рассмотрим процесс охлаждения расплава, заданного точкой М.
| Точка | Что происходит | Ф | С | Что означает число степеней свободы |
| М | Охлаждение расплава | Можно менять температуру и состав расплава | ||
| а | Появляются первые кристаллы компонента А | Можно менять только температуру | ||
| b | Продолжают выпадать кристаллы компонента А, состав расплава b1, состав твердой фазы b2 | Можно менять или температуру или состав расплава | ||
| d | Одновременно кристаллизуются компоненты А и В, на кривой охлаждения участок d-d’ | Система инвариантна | ||
| e | Охлаждение механической смеси компонента А состава е2 и компонента В состава е1 | Можно менять только температуру |
Соотношение между количеством твердой и жидкой фаз определяется по правилу рычага. Например, смесь в точке b соответствует начальному составу 40% А и 60% В, то при температуре Та она представляет собой гетерогенную систему из кристаллов вещества А и жидкой фазы. Для определения состава этих фаз проводят горизонталь b2b1 через точку b до пересечения с границами области (длина рычага). Определить количество кристаллической фазы и жидкого расплава можно по соотношению:
2.3.2. Фазовая диаграмма с конгруэнтно плавящимся химическим соединением
Как видно из рис.2, фазовая диаграмма представляет собой как бы две диаграммы с простой эвтектикой: А-АВ и В-ВА. Можно разделить такую диаграмму на две части по вертикали, соответствующей химическому соединению, и рассматривать каждую часть диаграммы отдельно.
Рис.2. Диаграмма состояния системы с образованием химического соединения, плавящимся без разложения (конгруэнтно)
Состав химического соединения АхВy в точке Д можно определить, зная состав соединения в молекулярных или массовых процентах.
А).Состав компонентов А и В выражен в мольных процентах:
, состав химического соединения А2В3;
, состав химического соединения АВ .
Б).Состав компонентов А и В выражен в массовых процентах:
, состав химического соединения АВ2 .
Рассмотрим процесс охлаждения расплава, заданного точками М1 и М2. Точка М1 отвечает составу конгруэнтно плавящегося химического соединения АхВy. Число независимых компонентов системы, образованных из одного химического соединения АхВy, равно единице и число степеней свободы в этом случае равно: С=К – Ф + 1 = 1 – Ф + 1 = 2 - Ф.
| Точка | Что происходит | Ф | С | Что означает число степеней свободы |
| М1 | Охлаждение расплава | Можно менять только температуру | ||
| Д | Появляются первые кристаллы компонента АхВy | Система инвариантна | ||
| F | Охлаждается твердая фаза химического соединения АхВy | Можно менять только температуру |
Рассмотрим процесс охлаждения расплава, заданного точкой М2.
| М2 | Охлаждение расплава | Можно менять температуру и состав расплава |
| а | Появляются первые кристаллы компонента АхВy | Можно менять только температуру |
| b | Кристаллизуются компонент А и химическое соединение АхВy | Система инвариантна |
| с | Охлаждение механической смеси А и АхВy | Можно менять только температуру |
2.3.3. Фазовая диаграмма с инконгруэнтно плавящимся химическим соединением
Диаграмма, когда компоненты А и В могут образовывать химическое соединение АхВy, плавящееся с разложением, т.е. инконгруэнтно, приведена на рис.3.
Рис.3. Диаграмма состояния системы с образованием химического соединения, плавящимся с разложением (инконгруэнтно)
Инконгруэнтно плавящееся химическое соединение АхВy устойчиво только ниже температуры Тc. При повышении температуры выше Тc химическое соединение распадается на две фазы: кристаллы компонента В и расплав состава y (точка С). На перитектической прямой СДТc в равновесии находятся три фазы:
- расплав состава точки С ( CL );
- кристаллы АхВy состава точки Д;
- кристаллы компонента В.
По правилу фаз Гиббса число степеней свободы в точке С равно нулю (С = 3 - Ф = 3 - 3 = 0), что указывает на постоянство температуры Тс и состава расплава. Чтобы состав расплава не менялся, одновременно с кристаллизацией АхВy ранее выпавшие кристаллы компонента В должны растворяться, поддерживая постоянным содержание компонента В в расплаве. При этом происходит перитектическое превращение: Lc + В АхВy.
Точка С называется точкой перитектики, температура Тс - температурой перитектики. В точке перитектики, так же как и в точке эвтектики, в равновесии находятся расплав и две твердые фазы. Однако процессы при охлаждении существенно различаются: в точке эвтектики одновременно кристаллизуются две твердые фазы, а в точке перитектики – одна твердая фаза кристаллизуется, а другая растворяется. На кривой охлаждения при Тс наблюдается горизонтальный участок b-b’.
Рассмотрим процесс охлаждения расплава, заданного точкой М.
Диаграмма состояния представляет собой графическое изображение состояния любого сплава в зависимости от температуры и концентрации компонентов.
Основой построения диаграмм состояния являются кривые охлаждения (рисунок 2.1). Строятся серии таких кривых, каждая из которых отвечает определенному соотношению компонентов сплава. Процентное содержание компонентов откладывается на оси абсцисс, а температура начала t1 и окончания t2 кристаллизации, отвечающие данному составу, на оси ординат. Соединяя все точки t1 и t2 можно получить искомую диаграмму состояния.
Верхняя кривая (ликвидус) отделяет жидкую фазу от промежуточной, в которой начинают появляться кристаллы. Под нижней кривой (солидусом) на диаграмме находится твердая фаза.
Знание вида диаграммы состояния для любого сплава является важной информацией, по которой можно определить температуры начала и окончания кристаллизации для любого соотношения компонентов. Для примера определим данные температуры для соотношения компонентов А и В равном 25/75. Проведем вертикальную линию из точки, соответствующей данному соотношению на оси абсцисс, отметим точки ее пересечения с ликвидусом и солидусом и проведем горизонтали из них до пересечения с ось ординат. Получившиеся точки 2 и 1 будут точкам начала и окончания кристаллизации.
Помимо этого, по диаграмме состояния можно определить процентное содержание компонентов жидкой и твердой фазы при определенной температуре.
Представленная на рисунке 2.2 диаграмма состояния является диаграммой состояния сплава тип твердый физический раствор с неограниченной растворимостью. Диаграммы состояния сплавов видов механическая смесь и твердый физический раствор с ограниченной растворимостью представлены на рисунке 2.3.
| Рисунок 2.3 –Диаграммы состояния сплавов механическая смесь (а) и твердый физический раствор с ограниченной растворимостью (б) |
Диаграмма состояния сплава типа твердый физический раствор с неограниченной растворимостью имеет следующие особенности. Точка G является точкой предельной растворимости вещества В в А. Точка J является точкой предельной растворимости вещества А в В. От 0% вещества В до точки G и от точки J до 100% вещества В твердая фаза представляет собой обычный твердый физический раствор. Между точками G и K из расплава начинает выделяться излишек не растворившегося вещества, называемый эвтектикой. Таким образом, сплав, образующийся между данными точками, является механической смесью твердого раствора компонентов А и В и их эвтектики.
| Рисунок 2.4 – Диаграмма состояния сплава химическое соединение |
Пунктирные линии CF и EK могли бы показывать изменение растворимости компонентов друг в друге с изменением температуры. Однако, данный эффект себя никак не проявляет по причине того, что ниже отрезка CE все вещество является твердым. Изменение взаимной концентрации веществ в твердом состоянии невозможно по причине крайне низкой скорости диффузии металлов в твердом состоянии.
Для сплава типа химическое соединение диаграмма состояния представлена на рисунке 2.4. Данная диаграмма составлена как бы из нескольких диаграмм, каждая из которых соответствует определенному химическому соединению. Происходит это по причине того, что два элемента могут иметь не одно, а несколько химических соединений (например железо и кислород – Fe2O3, Fe3O4 и т.д.). Каждому веществу соответствует свой минимум и максимум на диаграмме состояния.
| Рисунок 2.5 – Связь между диаграммами состояния сплавов и их физическими свойствами (1 – диаграммы состояния, 2 – графики изменения твердости, 3 – графики изменения пластичности |
2.4 Связь между диаграммами состояния сплавов и их физическими свойствами
Изменение физических свойств сплава твердый физический раствор с ограниченной растворимостью (рисунок 2.5, а) происходит нелинейно по причине постоянного изменения конфигурации кристаллической решетки с изменением взаимной концентрации компонентов. Резкий перегиб графика физических свойств для твердого раствора с ограниченной растворимостью (рисунок 2.5, в) характерен для начала и окончания присутствия эвтектики в сплаве. Для химического соединения (рисунок 2.5, г) излом графика происходит по причине большой разницы в строении веществ с разными химическими формулами.
Дополнительная:
Краткое содержание лекции
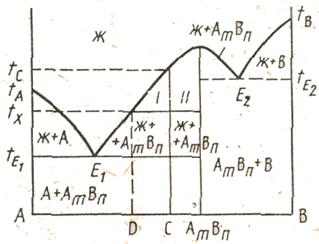
Часто в бинарной системе образуются новые химические соединения. Если вещества А и В образуют химическое соединение АmВn, то на диаграмме (рис. 9) появятся вертикальная линия и температурный максимум, указывающие на состав этого соединения. Если это соединение плавится конгруэнтно, то будет образовываться эвтектика как с компонентом А, так с компонентом В (эвтектические точки Е1 и Е2).
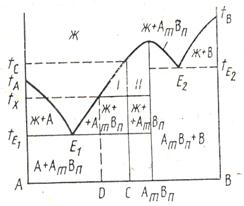
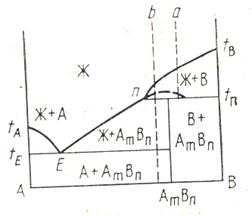
Рис. 9. Диаграмма состояния двух-
компонентной системы с химичес-
ким соединением, плавящимся без
Рис. 10. Диаграмма состояния двух- компонентной системы, с химическим соединением, плавящимся с разложением
Вертикальная линия состава химического соединения делит диаграмму на две части, каждая из которых может рассматриваться как самостоятельная двойная система. Все закономерности, установленные для системы с одной эвтектикой, справедливы и здесь, с тем лишь дополнением, что для некоторых составов смесей в качестве первичной твердой фазы будут выпадать кристаллы
соединения AmBn. Например, смесь состава С начнет плавиться при температуре и полностью перейдет в жидкое состояние при температуре tС . При температуре tх эта смесь будет состоять из кристаллов соединения AmBn и расплава состава D. Содержание фаз (%) находится по правилу рычага: измерением длины конноды и ее отрезков І и ІІ. Длина отрезка І пропорциональна массовой доле твердой фазы, отрезка ІІ – жидкой.
Точка П, характеризующая состав расплава, возникающего при разложении соединения AmBn , называется т о ч к о й п е р и т е к т и к и. В этой точке отмечается перегиб ликвидуса, вызванный изменением состава твердой фазы, находящейся в равновесии с расплавом. Вертикаль химического соединения доходит лишь до перитектической горизонтали, расположенной при температуре инконгруэнтного плавления и перитектики.
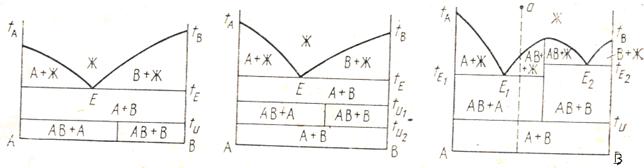
Рис. 11. Диаграмма состояния двухкомпонентной системы с химическим соединением, разлагающимся или образующимся в твердом состоянии
У смесей, составы которых находятся между точкой перитектики и составом химического соединения, первичным продуктом кристаллизации будут кристаллы компонента В. При дальнейшем охлаждении до температуры перитектики tП происходит перитектическая реакция между твердым веществом и расплавом. В результате реакции образуются кристаллы химического соединения AmBn.
Если кристаллы В выпадали в избытке по сравнению с их массовой долей, необходимой для реакции (смесь а), то при температуре tП произойдет полное затвердевание расплава в виде смеси кристаллов В и AmBn. При избытке расплава (смесь b) последний сохраняется вплоть до эвтектической температуры tЕ. Выпавшие кристаллы В полностью расходуются в процессе реакции, и при дальнейшем охлаждении смеси ниже tП происходит кристаллизация соединения AmBn непосредственно из расплава. При температуре tЕ кристаллизуется также компонент А и смесь затвердевает полностью.
При образовании химического соединения в уже затвердевшем расплаве на диаграмме (рис. 11, а) наблюдается появление новой вертикальной линии, отвечающей составу химического соединения. Если компоненты А и В непосредственно выпадают из расплавов и затвердевают при температуре tЕ, то ниже эвтектической температуры остается лишь механическая смесь кристаллов А и В. Однако возможны случаи, когда при дальнейшем понижении температуры до tи эти вещества образуют химическое соединение АВ. Избыток одного из компонентов кристаллизуется в чистом виде. Таким образом, в правой части диаграммы образуется смесь химического соединения АВ и кристаллов избыточного компонента В, в левой – смесь химического соединения АВ с кристаллами компонента А.

Иногда химическое соединение, образовавшееся при высокой температуре, или, как в предыдущем случае, уже в твердом состоянии, по достижении некоторой температуры tи снова распадается на составные части. Диаграмма, отражающая подобные процессы, отличается тем, что вертикальная линия, характеризующая наличие химического соединения, имеется лишь между определенными температурами tи1 и tи2 (рис. 11, б).
На диаграмме (рис 11, в) отражено образование химического соединения АВ, плавящегося без разложения, но существующего лишь в области высоких температур. При температуре tи соединение АВ распадается на составные части. Таким образом, если имеется расплав затвердевает при температуре tЕ1 в виде механической смеси – эвтектики из кристаллов А и АВ. По достижении температуры tи образовавшееся соединения распадается, в результате чего останется только смесь кристаллов А и В. Такой же процесс наблюдается и в правой части диаграммы с той лишь разницей, что в избытке будет компонент В, а компонент А полностью войдет в соединение АВ.
Сабақтың қысқаша мазмұны
Егер екі зат А мен В химиялық қосылыс АmBn түзетін болса, онда диаграммада осы қосылыстың құрамын көрсететін вертикаль сызық және температуралық максимум пайда болады.
Егер қосылыстар конгруэнтті балқитын болса, А компонентімен де В компонентімен де эвтектика пайда болады (диаграммадағы Е1 және Е2 нүктелері).
Құрамының вертикал сызығы диаграмманы екіге бөледі, оның әрқайсысын жеке екі жүйе ретінде қарастыруға болады. С құрамды қоспа tE1 температурасында балқи бастайды да tс температурасында сұйық күйге келеді. tх температурада бұл қоспа АmBn қосылысының кристалдарынан тұрады және D қоспасының балқымасынан тұрады. Фазалардың % құрамы рычаг ережесімен анықталады: конноданың ұзындығымен және оның I , II бөліктерінің ұзындығын өлшеп есептейді.
Ыдырай балқитын химиялық қосылыс түзетін жүйе күйінің диаграммасында ликвидус “көрінбейтін максимуммен” ыдырай сипатталады, ол АmBn құрамының жетуге болмайтын балқу температурасын көрсетеді. Жүйеде пайда болатын АmBn химиялық қосылыс tn температурасына дейін ыдырап, В затының кристалдары мен балқыма бөлінеді: АmBn В + балқыма (10 сурет).
Лекция №12
Литература
Основная:
Дополнительная:
Краткое содержание лекции
Часто в бинарной системе образуются новые химические соединения. Если вещества А и В образуют химическое соединение АmВn, то на диаграмме (рис. 9) появятся вертикальная линия и температурный максимум, указывающие на состав этого соединения. Если это соединение плавится конгруэнтно, то будет образовываться эвтектика как с компонентом А, так с компонентом В (эвтектические точки Е1 и Е2).


Рис. 9. Диаграмма состояния двух-
компонентной системы с химичес-
ким соединением, плавящимся без
Рис. 10. Диаграмма состояния двух- компонентной системы, с химическим соединением, плавящимся с разложением
Вертикальная линия состава химического соединения делит диаграмму на две части, каждая из которых может рассматриваться как самостоятельная двойная система. Все закономерности, установленные для системы с одной эвтектикой, справедливы и здесь, с тем лишь дополнением, что для некоторых составов смесей в качестве первичной твердой фазы будут выпадать кристаллы
соединения AmBn. Например, смесь состава С начнет плавиться при температуре и полностью перейдет в жидкое состояние при температуре tС . При температуре tх эта смесь будет состоять из кристаллов соединения AmBn и расплава состава D. Содержание фаз (%) находится по правилу рычага: измерением длины конноды и ее отрезков І и ІІ. Длина отрезка І пропорциональна массовой доле твердой фазы, отрезка ІІ – жидкой.
Точка П, характеризующая состав расплава, возникающего при разложении соединения AmBn , называется т о ч к о й п е р и т е к т и к и. В этой точке отмечается перегиб ликвидуса, вызванный изменением состава твердой фазы, находящейся в равновесии с расплавом. Вертикаль химического соединения доходит лишь до перитектической горизонтали, расположенной при температуре инконгруэнтного плавления и перитектики.

Рис. 11. Диаграмма состояния двухкомпонентной системы с химическим соединением, разлагающимся или образующимся в твердом состоянии
У смесей, составы которых находятся между точкой перитектики и составом химического соединения, первичным продуктом кристаллизации будут кристаллы компонента В. При дальнейшем охлаждении до температуры перитектики tП происходит перитектическая реакция между твердым веществом и расплавом. В результате реакции образуются кристаллы химического соединения AmBn.
Если кристаллы В выпадали в избытке по сравнению с их массовой долей, необходимой для реакции (смесь а), то при температуре tП произойдет полное затвердевание расплава в виде смеси кристаллов В и AmBn. При избытке расплава (смесь b) последний сохраняется вплоть до эвтектической температуры tЕ. Выпавшие кристаллы В полностью расходуются в процессе реакции, и при дальнейшем охлаждении смеси ниже tП происходит кристаллизация соединения AmBn непосредственно из расплава. При температуре tЕ кристаллизуется также компонент А и смесь затвердевает полностью.
При образовании химического соединения в уже затвердевшем расплаве на диаграмме (рис. 11, а) наблюдается появление новой вертикальной линии, отвечающей составу химического соединения. Если компоненты А и В непосредственно выпадают из расплавов и затвердевают при температуре tЕ, то ниже эвтектической температуры остается лишь механическая смесь кристаллов А и В. Однако возможны случаи, когда при дальнейшем понижении температуры до tи эти вещества образуют химическое соединение АВ. Избыток одного из компонентов кристаллизуется в чистом виде. Таким образом, в правой части диаграммы образуется смесь химического соединения АВ и кристаллов избыточного компонента В, в левой – смесь химического соединения АВ с кристаллами компонента А.
Иногда химическое соединение, образовавшееся при высокой температуре, или, как в предыдущем случае, уже в твердом состоянии, по достижении некоторой температуры tи снова распадается на составные части. Диаграмма, отражающая подобные процессы, отличается тем, что вертикальная линия, характеризующая наличие химического соединения, имеется лишь между определенными температурами tи1 и tи2 (рис. 11, б).
На диаграмме (рис 11, в) отражено образование химического соединения АВ, плавящегося без разложения, но существующего лишь в области высоких температур. При температуре tи соединение АВ распадается на составные части. Таким образом, если имеется расплав затвердевает при температуре tЕ1 в виде механической смеси – эвтектики из кристаллов А и АВ. По достижении температуры tи образовавшееся соединения распадается, в результате чего останется только смесь кристаллов А и В. Такой же процесс наблюдается и в правой части диаграммы с той лишь разницей, что в избытке будет компонент В, а компонент А полностью войдет в соединение АВ.
Сабақтың қысқаша мазмұны
Егер екі зат А мен В химиялық қосылыс АmBn түзетін болса, онда диаграммада осы қосылыстың құрамын көрсететін вертикаль сызық және температуралық максимум пайда болады.
Егер қосылыстар конгруэнтті балқитын болса, А компонентімен де В компонентімен де эвтектика пайда болады (диаграммадағы Е1 және Е2 нүктелері).
Құрамының вертикал сызығы диаграмманы екіге бөледі, оның әрқайсысын жеке екі жүйе ретінде қарастыруға болады. С құрамды қоспа tE1 температурасында балқи бастайды да tс температурасында сұйық күйге келеді. tх температурада бұл қоспа АmBn қосылысының кристалдарынан тұрады және D қоспасының балқымасынан тұрады. Фазалардың % құрамы рычаг ережесімен анықталады: конноданың ұзындығымен және оның I , II бөліктерінің ұзындығын өлшеп есептейді.
Ыдырай балқитын химиялық қосылыс түзетін жүйе күйінің диаграммасында ликвидус “көрінбейтін максимуммен” ыдырай сипатталады, ол АmBn құрамының жетуге болмайтын балқу температурасын көрсетеді. Жүйеде пайда болатын АmBn химиялық қосылыс tn температурасына дейін ыдырап, В затының кристалдары мен балқыма бөлінеді: АmBn В + балқыма (10 сурет).
Читайте также:
- Семейное воспитание детей младшего школьного возраста с сенсорным речевым отклонением
- Физическое развитие детей школьного возраста с нарушением зрения
- Права авторов и их гражданско правовая защита кратко
- Каковы место и роль австралии и океании в мире ответ кратко
- Клеточная мембрана строение и функции кратко таблица

