Биологическая роль комплексных соединений кратко
Обновлено: 03.07.2024
2. Биометаллоорганическая химия / Под ред. Ж. Жауэна. – М.: БИНОМ. Лаборатория знаний, 2009. – 494 с.
4. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; под ред. Ю.А. Ершова), 8 изд. – М.: Высшая школа, 2010. – 560 с.
Важнейшим классом бионеорганических комплексов металлов являются транспортные комплексы, в которых один или несколько атомов металла связаны с атомами азота, кислорода или серы белковых молекул, выступающие в роли полидентатных лигандов. Одним из основных переносчиков ионов металлов в человеческом организме является низкомолекулярный белок металлотионеин (Мr=6500), содержащий большое число цистеиновых фрагментов. Один моль металлотионеина способен перенести 7-12 моль таких жизненно необходимых элементов, как Zn, Cu и Se. При отравлениях тяжелыми металлами (Сd, Hg, Pb, Ag, As) данный белок выполняет защитную функцию, связывая их в прочные и относительно малотоксичные комплексы. Железосодержащий белок трансферрин выполняет преимущественно транспортные функции. Несмотря на сравнительно низкое содержание железа (2 моль ионов Fe3+ на одну молекулу белка), трансферриновые комплексы обеспечивают высокую скорость тканевого обмена данного элемента и являются важными переносчиками железа.
Изучение бионеорганических комплексов дает важную информацию об особенностях их метаболизма и позволяет разрабатывать эффективные способы коррекции заболеваний, связанных с недостатком (или, наоборот, с избытком) тех или иных элементов в человеческом организме.
Применение комплексных соединений в медицине и фармации связано также с их использованием в методах качественного и количественного анализа – в комплексонометрии. Широкое распространение получила комплексонометрия в медико-биологических исследованиях. Этот метод необходим для определения в живых организмах кальция, магния и многих микроэлементов. Комплексонометрия применяется в анализе лекарственного сырья, питьевых, минеральных и сточных вод. В биологии и медицине комплексоны используются не только в аналитических целях, но и в качестве стабилизаторов при хранении крови, так как комплексоны связывают ионы металлов, катализирующих реакции окисления. Комплексоны применяются также для выведения из организма ионов токсичных металлов (Рb2+, Cd2+ , Hg2+ и др.), радиоактивных изотопов и продуктов их распада.
Сущность, значение и функциональное строение порфинов. Металлы-комплексообразователи во всех здоровых человеческих тканях. Общий путь образования тетрапиррольных предшественников. Биосинтез гемоглобина и хлорофилла, строение и механизмы функционирования.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 28.10.2010 |
| Размер файла | 18,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Московский государственный университет имени М. В. Ломоносова
Факультет фундаментальной медицины
Реферат на тему:
Комплексные соединения, их биологическая роль.
Порфириновые комплексы Fe и Mg
Содержание
Обзор комплексов. Функциональное строение порфиринов
Гемоглобин - строение, механизмы работы
Общий путь образования тетрапиррольных предшественников (синтез основы)
Синтез гемоглобина и хлорофилла
4.1 Биосинтез протогема
4.2 Биосинтез хлорофиллов
Заключение
Список использованной литературы
Введение
1. Обзор комплексов. Значение порфиринов
Для живых организмов(животных, растений, бактерий) очень важны комплексные соединения металлов, в которых четыре координационных места занимает одна и та же частица, называемая порфином, содержащая четыре пирролоподобных цикла, соединенных =СН-группами:
Производными порфина являются порфирины. В порфиринах, в отличие от порфина, имеются боковые цепи вместо некоторых из 8 периферических пиррольных атомов водорода. Расположение и вид заместителей определяют название и специфические функции, соответствующего производного. В нормальном обмене веществ человека участвует т.н. Изомер III. Изомер I в значительных количествах появляется при довольно редком дефекте метаболизма. Остальные изомеры у человека не встречаются.
В составе гемоглобина, миоглобина, цитохромов, каталазы и пероксидазы порфирины выступают в виде комплексов с ионами железа - гемов. Хлорофиллы и бактериохлорофиллы содержат магний. Витамин В12 и родственные ему кобаламины, как следует из названия, имеют в качестве центрального иона кобальт.
В организмах встречаются комплексы, в которых некоторые атомы водорода в порфине замещены на метильные и винильные остатки пропионовой кислоты (протопорфирины). Известны 15 возможных изомерных структур. Однако основной каркас этой сложной молекулы сохраняется во многих сложных веществах: гемоглобине, цитохромах, витамине В12. Ион металла замещает атомы водорода двух пиррольных колец. Связи металла с четырьмя атомами азота двух других пиррольных колец, которые лежат в одной плоскости, благодаря эффекту резонанса рассматриваются как одинаковые.
Важнейшим свойством порфиринов является наличие в молекуле координационной полости, ограниченной атомами азота, N4, имеющей радиус около 2Е и способной координировать ионы металлов М2+, М3+, М4+ и даже с большей степенью окисления. В результате комплексообразования образуются комплексные соединения порфиринов, т.н. металлопорфирины, обладающие многообразными структурными и химическими особенностями, высокой биологической и каталитической активностью. При этом металл либо занимает центр полости N4 и оказывается в экваториальной плоскости xy, образуя плоский координационный узел из атомов MN4, либо оказывается приподнятой над плоскостью, в которой лежат атомы N4 и образует координационные узлы различной геометрической структуры - от терагоналной пирамиды L(MN)4 и октаэдра (L1)(L2)MN4 (рис. 3) до более сложных геометрических фигур.
Выход центрального атома из плоскости происходит, как правило, при донорно-акцепторном взаимодействии с молекулой L. Если металл М способен присоединить вторую молекулу L той же природы с противоположной стороны плоскости xy, то он возвращается в центр плоскости N4. Лиганды (L1), способные вступать в координационную сферу металла, уже занятую четырьмя атомами азота порфирина, называются аксиальными.
Возможности молекул металлопорфиринов выступать в биологических процессах в качестве биокатализаторов (ферментов) значительно расширяется в связи с специфическим строением порфиринов и их комплексов, необычайным своеобразием их свойств и чрезвычайно большим структурным многообразием. Структурное многообразие связано с многочисленными путями химической модификации молекул порфина за счет замещения атомов водорода.
Известно большое число биологических систем, в структуре которых металлопорфирины выполняют функции инициатора того или иного биологического процесса. Например, гем в составе гемопротеидов участвует в транспорте кислорода (гемоглобин), клеточном дыхании (цитохромы), утилизации пероксидов (каталаза). Наибольшее число исследований посвящено гемоглобину, гему крови, и процессам обратимой фиксации атмосферного кислорода на биологических и модельных системах.
Рассмотрим функциональные особенности и механизмы работы гемоглобина, как наиболее хорошо изученные.
2. Гемоглобин - строение, механизмы работы
Потребление атмосферного кислорода живыми организмами - важнейший биохимический процесс. Кислород транспортируется гемоглобином эритроцитов от легких к мышцам и удерживается в мышцах миоглобином. Гемоглобин и миоглобин представляют собой комплексы железа, в которых группа ферропротопорфирина (гема) содержит Fe (III)
Пятое координационное число занимает азот имидазола (Im) гистидинового остатка, через который осуществляется единственная связь группы гема с полипептидной цепью белка. В настоящее время известны аминокислотный состав и последовательность аминокислот в гемоглобинах, выделенных из разных животных, места присоединения частиц гема, пространственная структура гемоглобина (работы Перутца и др.). Гем локализован в расщелине между спиралями белка. Одна молекула гемоглобина, состоящая из четырех белковых субъединиц (глобулл), содержит четыре гема и, следовательно, четыре атома железа. Поскольку кислород в гемоглобине непосредственно фиксируется железом, то такая молекула может, постепенно насыщаясь, присоединить четыре молекулы кислорода. В молекуле миоглобина полипептидная цепь координирована железом гем-группы так же как в гемоглобине. Однако, в отличие от гемоглобина молекула миоглобина состоит из одной белковой субъединицы и содержит одну гемовую единицу. Структуры окси- и дезокси-форм различны, и это различие не исчерпывается тем, что одна из них содержит молекулы кислорода, а другая - нет.
При отсутствии кислорода атом Fe (II) в гемоглобине имеет координационное число 5, связан донорно-акцепторными связями с четырьмя координирующими атомами азота протопорфирина и одной менее прочной связью с третичным атомом азота проксимального имидазольного фрагмента гистидина (рис. 5). Координационный узел Fe (N4) N Im представляет собой квадратную пирамиду с атомом железа, удаленным от основания пирамиды на 0.8 Е. Шестое координационное место не в состоянии занять ни один из имеющихся поблизости лигандов (в том числе и Н2О), кроме молекулярного кислорода. Молекула О2 вызывает оксигенирование гемоглобина, а точнее иона Fe (II). При этом комплекс Fe (N4) N Im из высокоспинового пирамидального состояния в низкосипновое октаэдрическое искаженное состояние с координационным узлом Fe (N4) N Im (О2).
Под влиянием кристаллического поля N-донорных атомов порфирина, а также аксиальных лигандов (Im и О2 ) t42ge2g -конфигурация Fe (II) превращается в t62ge0g. На вакантные eg -орбитали переходят сигма-электроные пары имидазола и кислорода. Считают, что молекула О2 связывается в шестом координационном месте с Fe (II) также за счет дативной р-связи. Координированный ион железа поставляет пару электронов, находящуюся на его dyz (или dxz)-орбитали, на вакантную (разрыхляющую) pz-орбиталь молекулы О2. Образованию р-связи Fe (II) > О2 благоприятствует высокая электроннодонорная способность р-системы и проксимального имидазола. Атом железа после оксигенации входит в координационную плоскость N4 и располагается ценртосимметрично. Структура белка в гемоглобине такова, что он экранирует подход к атому Fe (II) всех других молекул, имеющихся в крови, и своевременно регулирует его донорно-акцепторные свойства. Исключение составляют токсиканты - яды крови, к которым относятся монооксид углерода, оксиды азота, метиленовый синий. Проникая с атмосферным воздухом в легкие, монооксид углерода быстро преодолевает капиллярно- альвеолярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает в обратимое химическое взаимодействие как с окси-, так и с дезоксигемоглобином:
HbО2 + CO = HbCO + О2
Hb + CO = HbCO, где Hb - гемоглобин.
Образующийся комплекс карбоксигемоглобин (HbCO) не способен присоединять к себе кислород. В молекуле гемоглобина СО координируется атомом железа , вытесняя О2. Одна молекула гемоглобина (точнее, четыре её гема) может присоединить до четырех молекул СО.
Важным производным гемоглобина является метгемоглобин, в молекуле которого атом железа находится в степени окисления +3. Метгемоглобин не связывает молекулярный кислород. Он образуется при воздействии на гемоглобин окислителей (оксидов азота, метиленового синего, хлоратов). Образование метгемоглобина в крови уменьшает количество в ней функционально важного оксигемоглобина и нарушает доставку кислорода к тканям. Комплексы железа с порфиринами участвуют не только в транспорте кислорода, но и выполняют множество других функций. Среди них процесс переноса электронов.
3. Общий путь образования тетрапиррольных предшественников
Начало исследований принято относить к 1945 году, когда молодой американский ученый Шемин поставил эксперимент на собственном организме, приняв порцию простейшей аминокислоты глицина, которая отличалась от обычной аминокислоты заменой изотопа 14N на 15N. Через некоторое время он выделил из крови гемоглобин затем гемин, содержащий повышенное количество изотопа 15N. Позднее было показано, что глицин конденсируется с сукцинил-коэнзимом А, давая д-аминолевулиновую кислоту (д-АЛК). Этот процесс катализируется ферментом АЛК-синтетазой, его обязательным участником является фосфорилированная форма витамина В6 - пиридоксальфосфат. Последующими исследованиями было доказано, что д-АЛК выступает в качестве общего предшественника в биосинтезе всех природных тетрапиррольных пигментов. Описанное образование д-АЛК характерно для животных и ферросинтетических бактерий. В растениях и у некоторых прокариотов д-АЛК синтезируется из глютаминовой кислоты.
Наличие простетичсекой группы в дезаминазе, построенной из молекул, подобных субстрату, - явление необычное для ферментов. Известно только, что, действуя на дезаминазу сильными кислотами, удается отщепить депирролилметан. Полученный апофермент уже не обладает каталитической активностью. Лишь после присоединения двух первых молей ПБГ при определенном pH дезаминаза снова становится способной к обратимому присоединению четырех молекул ПБГ. Синтезированный оксибилан под действием второго фермента косинтетазы превращается в Уро'ген III. Для этой циклизации, сопровождающейся обращением пиррольного кольца D, за долгие годы изучения этой реакции предложено свыше двух десятков механизмов. В настоящее время наиболее обоснованным представляется поворот кольца D за счет образования спиро-структуры (на схеме).
После образования Уро'гена III происходит первое разветвление путей биосинтеза тетрапиррольных пигментов. Декарбоксилирование Уро'гена III ведет к порфиринам и хлорофиллам, а С-метилирование - через прекоррин-1 - к витамину В12 и другим кобаламинам.
4. Синтез гемоглобина и хлорофилла
Рассмотрим путь, ведущий к главному порфирину в живом организме - протопорфирину IX и его железосодержащему комплексу - протогему. Превращение Уро'гена III под влиянием соответствующего фермента включает последовательное декарбоксилирование остатков уксусной кислоты до метильной группы с образованием копропорфириногена III (Копро'ген III). Декарбоксилирование начинается с кольца D и далее продолжается по часовой стрелке через кольца А,В и С. Имеются также данные, что в определенных условиях возможен и иной порядок декарбоксилирования.
Копро'ген III под действием копропорфириногеноксидазы подвергается окислительному декарбоксилированию. В результате два остатка пропионовой кислоты в положениях 3 и 8 превращаются в винильные группы и образуется протопорфирин IX(Прото IX). На этом участке происходит дальнейшее разветвление путей биосинтеза. Введение ионов двухвалентного железа (фермент феррохелатаза) приводит к образованию протогема, который является простетической группой в многочисленных природных белках - гемопротеидах.
4.2 Биосинтез хлорофиллов
Включение в Прото IX магния начинает новую цепь биосинтетических превращений, ведущую к хлорофиллу а, бактериохлорофиллу и другим зеленым пигментам, общее количество которых на сегодня превышает 50 типов. Ниже приведена схема, основных превращений магниевого комплекса Прото IX в хлорофилл а (Хл а).
Существенным отличием этой ветви биосинтеза от ранее рассмотренной является то, что при биосинтезе Прото IX большая часть промежуточных соединений находится в растворах, перемещаясь от одного фермента к другому, причем сами ферменты также по большей части растворены в цитоплазме клетки. Биосинтез хлорофиллов, напротив, протекает только в хлоропластах, все ферменты закреплены в мембранах и часто образуют сложные ассоциаты. Это значительно затрудняет изучение отдельных стадий, механизмов превращений промежуточных соединений, и, в связи с этим, общая картина биосинтеза Хл а остаётся менее ясной.В целом же о биосинтезе известно следующее. После введения иона магния происходит этерификация остатка пропионовой кислоты в положении 13. Далее этот остаток окисляется через несколько промежуточных стадий, давая после замыкания кольцо Е(12). Затем происходит восстановление винильной группы до этильной в положении 8 с образованием 3-винилпротохлорофилла(13). Следующая важная стадия включает в себя восстановление двойной связи в кольце D. Исключительно важную роль играет при этом освещение растений. Показано, что в отсутствии света у высших растений накапливается протохлорофиллид. Даже короткая световая экспозиция приводит к превращению протохлорофиллида в хлорофиллид(14). В то же время, низшие растения и водоросли могут синтезировать хлорофиллид и при отсутствии света. На заключительном этапе происходит этерификация хлорофиллида природным спиртом фитолом при участии особого фермента хлорофиллсинтетазы. В результате образуется хлорофилл а (15). Пути биосинтеза других хлорофиллов, а также бактериохлорофиллов изучены пока недостаточно. Известно, однако, что все эти пигменты образуются через Хл а. В случае хлорофилла b происходит окисление метильной группы в положении 7 до формильной (16). Образование самого распространенного среди бактериохлорофиллов а -изомера (17) включает превращение винильной группы в ацетильную, гидрирование второго пиррольного остатка В и этерификацию остатка пропионовой кислоты фитолом.
Металлопорфирины являются макроциклическими комплексами, и это накладывает отпечаток на их строение и свойства. Однако, они отличаются от бесчисленного множества других групп макроциклических комплексов тем, что являются ароматическими макроциклами с уникальной сопряженной р-системой. Ароматичность порфиринов определяет их электроннодонорные свойства, то есть способность к снижению локальных положительных и отрицательных зарядов путем их распределения по ароматическим орбиталям. Вследствие этого стабилизируются катион- и анион-радикальные формы, а также различные степени окисления металлов, возникающие в процессе функционирования биологически активных соединений на основе металлопорфиринов.
Изложенные здесь пути биосинтеза протогема и хлорофилла а показывают, насколько близко переплетаются фундаментальные процессы жизнедеятельности в бактериях, высших растениях и животном мире. При значительных различиях объектов исследования в рассмотренных схемах используются близкие или общие методы построения промежуточных соединений.
Список использованной литературы
Подобные документы
Описание процесса диссоциации солей. Комплексные соединения и положения координационной теории Вернера и Чугаева. Характеристики лигандов: дентантность, внутренняя и внешняя сфера, координационное число. Пространственное строение комплексного иона.
презентация [152,7 K], добавлен 19.03.2014
Общая характеристика фенольных соединений, их природа и свойства. Главные классы растительных фенолов и сырье, их содержащее. Биосинтез ароматических аминокислот и разных классов полифенолов из фенилаланина. Поликетидный путь образования антрахинонов.
реферат [559,3 K], добавлен 23.08.2013
Характеристика гетероциклических соединений, их биологическое значение, распространение в природе, участие в построении аминокислот и классификация. Строение гемма крови и хлорофилла. Структура фурана, фурфурола, имидазола, тиазола, пирана, пиридина.
реферат [41,5 K], добавлен 22.06.2010
Понятие комплексной частицы и комплексообразователя. Унидентатные и монодентатные лиганды. Электронное строение центрального атома и координационное число. Внутренняя и внешняя сфера комплексного соединения. Классификация комплексных соединений.
презентация [379,7 K], добавлен 11.10.2015
Определение комплексных соединений и их общая характеристика. Природа химической связи в комплексном ионе. Пространственное строение и изомерия, классификация соединений. Номенклатура комплексных молекул, диссоциация в растворах, реакции соединения.
реферат [424,7 K], добавлен 12.03.2013
Основные положения координационной теории. Комплексообразователи: положительные ионы неметаллов, ионы металлов, нейтральные атомы. Номенклатура комплексных соединений и порядок перечисления ионов и лигандов. Понятие константы нестойкости комплекса.
реферат [142,9 K], добавлен 08.08.2015
Биологическая роль цереброзиидов - природных органических соединений из группы сложных липидов (сфинголипиды), впервые обнаруженых в составе мозга. Галактоцереброзид - один из простейших гликолипидов. Глюкоцереброзид. Место локализации цереброзидов.
Многие вещества, присутствующие в организме: аминокислоты, белки, нуклеиновые кислоты и их основания, витамины, гормоны, порфирины, – являются активными лигандами и, взаимодействуя катионами биометаллов, образуют многообразные комплексные соединения, выполняющие определенные биологические функции.
Некоторые природные комплексные соединения содержат в качестве хелатообразующего лиганда порфириновые производные, в которых за счет электронодонорных свойств четырех атомов азота образуются связи с комплексообразователем. В зависимости от природы комплексообразователя изменяются биологические функции этих комплексов.
Похожий на гемоглобин комплекс есть и в зеленых растениях: комплексы порфирина с катионом магния образуют активную часть молекулы хлорофилла (рисунок 8.3).
Активная часть молекул гемоглобина и хлорофилла.


Нарушение металлолигандного гомеостаза происходит по разным причинам: долговременное непоступление в организм катионов биогенных металлов или поступление их в значительно меньших количествах, чем необходимо для жизнедеятельности; поступление катионов биометаллов в количествах заметно больших, чем необходимо для жизнедеятельности.
Эти нарушения могут быть вызваны несбалансированным питанием или биогеохимическими особенностями территорий, где проживает человек.
Более серьезные нарушения в метаболизме организма вызываются поступлением катионов металлов-токсикантов (тяжелых металлов) или лигандов-токсикантов. В результате деятельности человека в окружающую среду поступают различные вещества. Существенную роль в загрязнении окружающей среды играют: электрохимические производства, поставляющие практически любые металлы-токсиканты, особенно ртуть, кадмий и хром; выхлопные газы автотранспорта – свинец; а также отходы металлургической и атомной промышленности, поставляющие широкий спектр различных металлов-токсикантов. Попадание их в организм может вызвать тяжелые последствия, например появление опухолей, мутагенез, нарушение обмена веществ.
Детоксикацию организма от металлов-токсикантов можно проводить при помощи лиганд-препаратов на основе полидентантных лигандов, которые образуют с токсикантами прочные водорастворимые комплексы (хелатотерапия).
Один из наиболее известных полидентантных лигандов – динатриевая соль этилендиаминтетрауксусной кислоты (другие названия: ЭДТА, комплексон ІІІ, трилон Б). Для связи с центральным атомом этот лиганд может использовать до шести центров: четыре атома кислорода карбоксильных групп и неподеленные пары электронов атомов азота.

§8. Комплекснье соединения ионов металлов с органическими реагентами. Хелаты и ионные ассоциаты.
Для разделения катионов и анионов из водных растворов применяют органические реагенты. Для этого к водному раствору соли металла добавляют раствор органического лиганда и полученный комплекс экстрагируют из водной фазы в органический растворитель.
Условием экстрагируемости комплексов является образование ионных ассоциатов, которые могут экстрагироваться в органическую фазу. Примером использовния экстрагирующихся ассоциатов является экстракционно-фотометрическое определение бора в виде ионного ассоциата комплексного аниона [BF4] - - с катионом красителя метиленового голубого МГ: [МГ] +[BF4] - .
Образовавшийся ионный ассоциат является электронейтральным и экстрагируется органическим растворителем.
Электронейтральными являются многие внутрикомплексные (халатные) соединения, которые, как правило, хорошо растворимы в органических растворителях. Наиболее широко применяются для экстракции металлов такие хелатообразуюшие реагенты. Как дитизон, пиридил - азонафтол, диэтилтиокарбамид и т.д.
Комплексные соединения катионов с органическими реактивами называют клипексонами. Эти реакции сопровождаются образованием внутрикомплексных (хeлатных) соединений. Большое значение в аналитической химии имеет комплексон III(трилон Б), натриевая соль этилендиаминтетрауксусной кислоты (Na2H2Y).
Молекула органического лиганда должна иметь определенные специфические связи, сопровождающейся аналитическими эффектами (появление осадка, изменение окраски или то и другое вместе).
Эти группировки называют функционально – аналитическими группировками (ФАГ).

Пи рокатехин Пи рокатехин железа(III)
Согласно принципу Чугаева в комплексообразование вступают органические реагенты, даюшие с ионами металлов циклы. Чем больше циклов (4,5,6,7 и 8 – членных) образуется вокруг иона металлов тем устойчивее соединение.
Например, диметилглиоксим (диацетилдиоксим).

Аналитические свойства продукта реакции меняют аналитически активные группы (ААГ). Свойствами аналитически активных групп в органических лигандах обладают ауксохромные группы, влияющие на систему сопряженных π- связей и углубляющие окраску комплекса (Сl - , Вr - ,I - С6Н5 - и т.д.).
1- нитрозо-2-нафтол - реактив на Со 2+ дает красно – бурый осадок.

Ализарин - реактив на AI 3+ дает розово – красный осадок (алюминиевый лак).

Дитизон (дифенилтиокарбазон) реактив на Zn 2+ , Аg + ,РЬ 2+ ,Hg 2+ ,Со 2+ и т.д.

Дифенилкарбазид, реактив на Hg 2+

При выборе специфических реакций на ионы, обладающие собственной окраской, например, на ионы Ni 2+ , подходящим реагентом оказывается бесцветный диметилглиоксим, т.е. реагент не отличающийся хромоформными свойствами. Элементы, обладающие хромоформным действием (Ni 2+ , Co 2+ , Fe 3+ , Cr 3+ и т.д.) дают с бесцветным органическими реагентами окрашенные соединения при образовании связей с кослородом (Кt-O-), с аминным азотом (Кt-N=), с сульфидной серой (Kt - S -). Органические реагенты могут использоваться как комплексообразователи для маскироки ионов, т.е. для связывания в комплексы тех ионов, которые мешают проведению реакций обнаружения других ионов.
Например, ионы Fe 3+ маскируют реакции обнаружения Со 2+ реакцией с роданидом аммония.
Так, обнаружению Со 2+ с роданидом (тиоцианатом) аммония мешают ионы Fe 3+ . Тогда ионы Fe 3+ маскируют взаимодействие с тартратами (солями винной кислоты) или фторидами.
Однако, ионы Fe 3+ также реагируют с роданидом аммония, образуя кроваво – красное окрашивание, которое делает незаметным ее окрашивание, вызываемое ионами Со 2+ . С целью маскировки Fe 3+ в раствор добавляют маскирующие реагенты фториды, фосфаты, оксалаты и т. д., образующие с ионами Fe 3+ сильно-кислой среде устойчивые комплексные анионы, такие как [Fe Fe6] 3- ,[Fe (P04 )2]3-, [Fe (C204)3]3-.
В качестве маскирующих реагентов используют такие органические комплексообразователи как тиомочевина, гидроксиламин, винная, лимонная комплексоны.
Лабораторная работа.
Определение рН раствора. В кислой среде не могут находиться ионы СО3 2– , так как соли угольной кислоты разлагаются под действием кислот.
Выявление анионов I группы
К порции анализируемого раствора в нейтральной или слабощелочной среде прибавить несколько капель хлорида бария. Если образуется осадок, то анионы 1 группы присутствуют.
Выявление анионов II группы
К порции анализируемого раствора, подкисленного до кислой среды азотной кислотой, прилить несколько капель нитрата серебра. Образование осадка укажет на наличие анионов II группы.
Выявление отдельных анионов
1) Выявление анионов SO4 2–
К 3-4 каплям анализируемого раствора прилить избыток соляной кислоты и 2-3 капли хлорида бария. Образование белого мелкокристаллического осадка укажет на присутствие иона SO4 2– .
2) Выявление аниона СО3 2–
3) Выявление анионов I –
Открытие аниона I – основано на окислении ионов I – до свободного состояния. Проводится двумя реактивами:
а) Хлорная вода в кислой среде.
К 3-4 каплям анализируемого раствора прилить 2-3 капли серной кислоты, 3-4 капли бензола и затем прилить по каплям хлорную воду. После каждой капли хлорной воды содержимое пробирки энергично встряхивать. Окрашивание бензола в красно-фиолетовый цвет укажет на присутствие аниона I – в растворе:
б) Нитритами в кислой среде.
К 3-4 каплям анализируемого раствора прилить 2-3 капли серной киcлоты, 3-4 капли нитрита натрия или калия и 1-2 капли крахмального раствора. Появления синей окраски кажет на наличие свободного йода:
Если в анализируемом растворе обнаружены анионы I – , то их необходимо удалить, так как они мешают выявлению анионов Br – и РО4 3– .
4) Удаление анионов I – и выявление анионов Br –
Удаление анионов I – основано на их окислении до свободного йода с последующим удалением его из раствора при кипячении.
К 1-2 каплям прокипяченного раствора, взятым в пробирку, прибавить 1-2 капли серной кислоты, 3-4 капли бензола и по каплям приливать хлорную воду, встряхивая пробирку после каждой капли. Если бензол при этом остается бесцветным то следовательно йод удален полностью и анионы брома в растворе отсутствуют. Если бензол окрашивается в желтый или оранжевый цвет, то в растворе имеются анионы брома. Если бензол принимает красно-фиолетовую окраску, значит ионы йода удалены не полностью. К раствору, оставшемуся в чашке, прибавить еще серной кислоты, нитрита и снова прокипятить, после чего вновь провести пробу на полноту удаления йода. После полного удаления йода открывать анионы брома, как указано выше.
5) Выявление анионов РО4 3–
Если в анализируемом растворе присутствуют анионы йода, то анионы РО4 3– открываются после удаления йода, а если анионы йода отсутствуют, то прямо из анализируемого раствора с двумя реактивами:
а) магнезиальной смесью в нейтральной или слабощелочной среде. Налить в пробирку 5-6 капель магнезиальной смеси и прибавлять по каплям раствор с удаленным йодом или исходный раствор при взбалтывании. Выпадение белого кристаллического осадка укажет на присутствие анионов РО4 3– .
б) Налить пробирку 5-6 капель молибденовой смеси, нагреть ее до 50-60 °С, прибавить 1-2 капли раствора (с удаленным йодом) или исходного раствора, дать постоять. Выпадение желтого кристаллического осадка укажет на присутствие анионов РО4 3– .
6) Выявление анионов хлора
К 3-4 каплям анализируемого раствора прибавить 2-3 капли азотной кислоты иизбыток нитрата серебра. Раствор нагреть почти до кипения. Осадок отцентрифугировать и провести пробу на полноту осаждения. Добившись полного осаждения, центрифугат слить с осадка. Осадок промыть 2-3 раза теплой водой до полного удаления катионов Ag + (проба на HCl). Затем к промытому осадку прибавить 6-8 капель 12 %-ого раствора карбоната аммония и энергично взболтать содержимое пробирки, при этом AgCl частично растворяется с образованием [Ag(NH3)2]Cl. Осадок оставшийся отцентрифугировать, центрифугат слить в чистую пробирку и прибавить к нему несколько капель бромида калия. Помутнение раствора из-за выделения AgBr укажет на присутствие анионов Cl – .
Выявление аниона NO3 – производится несколькими реактивами:
К 1-2 каплям анализируемого раствора прилить 1-2 капли дифениламина, появление синего окрашивания укажет на присутствие NO3 – . Если в растворе присутствуют анионы йода, окраска может быть затушевана коричневой окраской выделяющегося в результате окисления I2.
б) Цинковой пылью в щелочной среде.
К 3-4 каплям анализируемого раствора прибавить 2-3 капли концентрированной щелочи, добавить немного цинковой пыли (или порошкообразного алюминия) и нагреть. Выделение аммиака укажет на присутствие в растворе анионов NO3 – . Аммиак можно обнаружить по посинению влажной универсальной индикаторной бумажки.
Роль комплексных соединений в биологических процессах чрезвычайно велика, так как они лежат в основе живой природы. Два вещества, без которых не возможна жизнь высших животных и растений (гемоглобин и хлорофилл) являются комплексными соединениями. Многие ферменты для проявления своей максимальной активности требовали либо добавления иона металла, либо эти ферменты уже содержали ион металла, то есть являлись металлоферментами. Активным центром в металлоферментах, которые являются комплексными соединениями, является ион металла (комплексообразователь), участвующий в католическом процессе. Так, ферменты каталаза и пероксидаза, которые катализируют реакции окисления пероксидом водорода, имеют в своей структуре гем (как в гемоглобине), в центре которого находится ион железа.
Молибденсодержащие ферменты участвуют в организме в окислительно-восстановительных реакциях. Важное значение имеют ферменты содержащие марганец Mn +2 или Mn +3 и др…
В медицине применяются комплексоны – это полидентатные лиганды (этилендиамин тетрауксусная кислота и др.), которые образуют с токсичными ионами металлов растворимые в воде комплексы и этим способствуют выведению этих ионов металлов из организма (ионы свинца, ртути, цинка, а также избыток ионов меди и железа). Применяя комплексоны, лечат лучевую болезнь и болезни, связанные с отложением в организме малорастворимых солей.
Было также установлено, что некоторые комплексы платины обладают противоопухолевой активностью, например, цис – [Pt(NH3)2Cl2].
Лекция 16: Природа химической связи и изомерия в комплексных соединениях.
Метод валентных связей.
Теория кристаллического поля.
Изомерия комплексных соединений.
Метод валентных связей.
Развитие представлений о природе комплексных соединений тесно связано с созданием и развитием общей теории химической связи. Уже в 20-х годах появились первые работы, применявшие идеи ионной и ковалентной связи к комплексным соединениям. Так, Косселю и Магнусу принадлежит большая заслуга в разработке электростатических представлений, а приложение идеи о парноэлектронной связи разрабатывалось в работах Сиджвика.
В дальнейшем было разработано три квантовомеханических метода: МВС, теория кристаллического поля (ТКП) и ММО. Ни один из этих методов не предназначался для объяснения связи только в комплексных соединениях, но и в этой области применение их оказалось весьма успешным. Они не являются противоположными друг другу. Наоборот, во многих отношениях они дополняют друг друга, трактуя одни и те же вопросы с различных точек зрения, и зачастую приводят к идентичным результатам.
МВС, являющийся развитием идей о парноэлектронной связи, широко использовался в 30 – 40-х годах. В последующее десятилетие он уступил место ТКП, которая представляет собой возрождение электростатических представлений на квантовомеханической основе. Усовершенствованная модель ТКП, учитывающая наличие в комплексах определенной доли ковалентной составляющей, известна под названием теории поля лигандов (ТПЛ). Наиболее современным и универсальным методом, охватывающим все случаи взаимодействия, является ММО. Интерес к этому методу и количество полученных при помощи его результатов непрерывно возрастают. Несмотря на это в настоящее время из трех квантовомеханических методов ведущую роль играет ТКП, при помощи которой более просто с меньшей затратой труда получено наибольшее количество результатов.
По простой электростатической модели (Коссель и Магнус, 1916 – 1922) взаимодействие между комплексообразователем и ионными или полярными лигандами подчиняется закону Кулона. При этом предполагается, что образующие комплекс частицы представляют собой недеформируемые шары с определенным зарядом и радиусом. Устойчивый комплекс получается, когда силы притяжения к ядру комплекса уравновешивают силы отталкивания между лигандами. При дальнейшем увеличении числа лигандов силы отталкивания между ними возрастают и комплекс становится непрочным. Эта модель позволила для ряда комплексов металлов оценить устойчивость, предсказать координационные числа и пространственное расположение лигандов.
На основе кулоновского взаимодействия заряженных частиц с учетом принципа наименьшей энергии системы были рассчитаны оптимальные значения координационных чисел. Так, для комплексообразователей в степени окисления +1 координационная валентность (KB) равна 1 или 2; для степени окисления +2 КВ = 2, а для +3 KB = 4,5 или 6. Кроме того, было показано, что наиболее распространенным координационным числам 2, 4, 6 соответствуют линейные, тетраэдрические и октаэдрические комплексы.
Согласно закону Кулона, прочность комплекса увеличивается с ростом заряда и уменьшением радиусов комплексообразователя и лигандов. Например, для галогенокомплексов алюминия [AlГ4] - устойчивость убывает в направлении от фторокомплексов к йодокомплексу, так как в этом ряду закономерно растет размер лигандов. Устойчивость комплексов с одними и теми же лигандами в более высокой степени окисления комплексообразователя всегда выше. Например:
К[Fe 2+ (CN)6] 4- = 10 -24 и К[Fe 3+ (CN)6] 3- = 10 -31
Так как силы отталкивания между ионами больше, чем между нейтральными лигандами, координационное число в комплексе с ионными лигандами оказывается меньше, чем в комплексе с дипольными молекулами. С ионными лигандами Со 2+ дает комплексы с КВ = 4, тогда как с дипольными молекулами координационное число возрастает до 6:
Электростатическая теория очень наглядна, и потому для качественных выводов ею широко пользуются и теперь. Однако она не в состоянии объяснить целый ряд фактов: 1) почему существуют комплексы с неполярными лигандами и комплексообразователем в нулевой степени окисления, например [Fe(CO)5], [Са(NH3)6] и др.; 2) почему комплексы переходных металлов второго и третьего рядов характеризуются большей устойчивостью сравнительно с комплексами переходных металлов первого ряда. При одинаковом заряде размеры ионов второго и третьего рядов переходных металлов больше, чем у первого, и поэтому по электростатическим представлениям комплексы тяжелых металлов должны были быть менее устойчивыми; 3) чем обусловлены магнитные и оптические свойства комплексных соединений.
Весьма наглядным способом описания комплексных соединений является МВС, предложенный и разработанный Полингом в 30-х годах, вскоре после создания квантовой механики. В основе метода лежат следующие положения:
1. Связь между комплексообразователем и лигандами донорно-акцепторная. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали. Мерой прочности связи служит степень перекрывания орбиталей. При этом учитываются только угловые функции, вкладом радиальной составляющей пренебрегают.
2. Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Гибридизация электронных орбиталей комплексообразователя определяет геометрию комплекса.
3. Дополнительное упрочнение комплекса обусловлено тем что наряду с σ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда. Перераспределение электронной плотности в результате σ- и π-связывания происходит в противоположных направлениях: при возникновении σ-связи идет перенос на комплексообразователь, при π-связывании – от него к лигандам.
4. Магнитные свойства, проявляемые комплексом, объясняются исходя из заселенности орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных металлами первого переходного ряда: медью, цинком, никелем и кобальтом. Напомним, электронные структуры ионов указанных металлов-комплексообразователей:
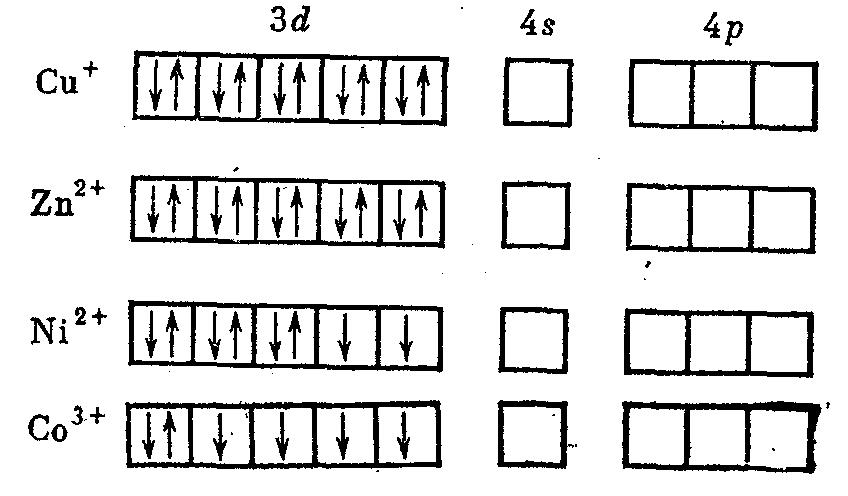
При образовании комплекса распределение электронов на d-орбиталях комплексообразователя может оставаться таким же, как у изолированного иона, или испытывать изменения (см. табл. 7). В приведенных примерах медь, никель (в [NiCl4] 2- ) и кобальт (в [CoF6] 3- ) сохранили электронную структуру катионов, в то время как в остальных комплексах произошло спаривание электронов. Освобождающиеся электронные орбитали участвуют в образовании σ-связей с лигандами. Как видно из табл. 7, при образовании октаэдрических комплексов гибридизация может осуществляться либо с использованием внутренних (n – 1) d–орбиталей ([Co(NH3)6] 3+ ), либо внешних nd-opбиталей ([CoF6] 3- ]. В табл. 7 собственные электронные пары комплексообразователя изображены стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ-связи, представлены пунктирными стрелками.
При внешней гибридизации связи образуют более удаленные и менее плотные 4d-орбитали. Степень перекрывания электронных облаков при этом меньше, и связь лигандов с комплексообразователем слабее, чем при внутренней гибридизации. Поэтому в комплексе [CoF6] 3- замещение ионов фтора идет легко и он более реакционноспособен, чем [Co(NH3)6] 3+ , в котором гибридизация внутренняя. Приведенные в табл. 7 электронные структуры комплексов правильно отражают их магнитные свойства. Так, [Cu(NH3)2] + , [Zn(NH3)4] 2+ , [Ni(CN)4] 2- , [Со(NН3)6] 3+ диамагнитны: у них нет неспаренных электронов. В противоположность им [NiCl4] 2- и [CoF6] 3- парамагнитны. При этом парамагнетизм этих соединений пропорционален числу неспаренных электронов.
Некоторые комплексы металлов в МВС

МВС дает возможность трактовать комплексы с нейтральными лигандами. Например, в карбонилах роль комплексообразователей играют атомы переходных металлов в нулевой степени окисления. Лигандами являются нейтральные молекулы окиси углерода. Карбонилы – диамагнитные вещества, поскольку все электроны металла спарены. Ниже приведена картина заселенности электронных орбиталей нейтральных атомов железа и никеля, а также карбонилов этих металлов (Fe(CO)5] и [Ni(CO)4]:
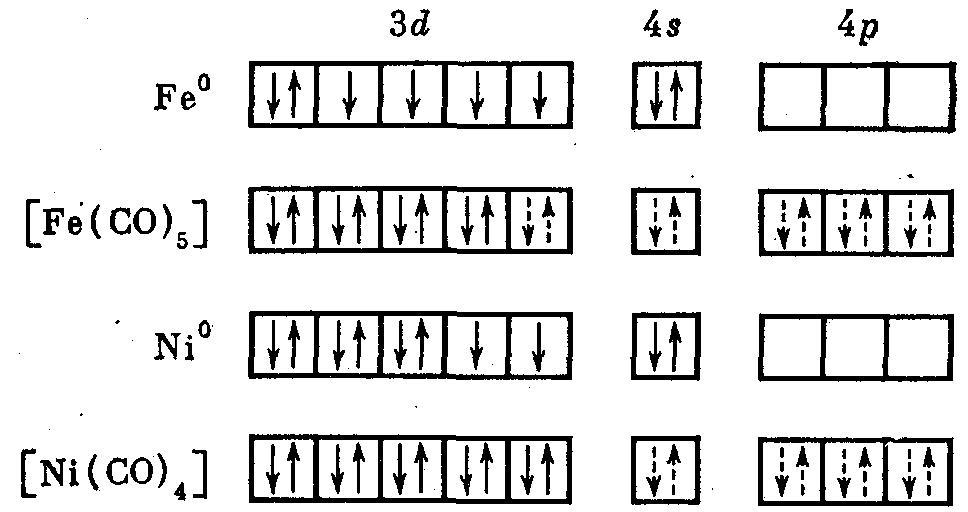
Если атом металла содержит нечетное число электронов, то возникает кластер со связью металл—металл. Например, карбонил марганца имеет состав [Mn2(CO)10] и является кластером:

В ряду [Ti(CO)4], [Cr(CO)6], [Fe(CO)5], [Ni(CO)4] все имеющиеся у металла валентные электроны заселяют d-орбитали. Оставшиеся свободными (n – 1)d-, s- и p-орбитали используются для образования донорно-акцепторной связи с неподеленными электронными парами углерода в молекулах СО. МВС имеет некоторые недостатки:
1. Пригоден для описания только ограниченного круга веществ. Комплексные соединения с многоцентровыми связями МВС совсем не рассматривает.
2. Не объясняет и не предсказывает оптические свойства комплексных соединений, так как не учитывает возбужденные состояния.
3. Не дает оценку энергий для различных структур комплексов. Поэтому не может объяснить, почему комплексы некоторых металлов, построенные в форме квадрата, отличаются достаточной прочностью и не переходят в более симметричные тетраэдрические комплексы.
Читайте также:

