Биологическая роль карбоновых кислот кратко
Обновлено: 07.07.2024
Органическая химия еще очень молода: как самостоятельная теоретическая дисциплина она сформировалась в XIX в. И тем не менее ее по праву можно считать древнейшей из наук, ведь знакомство наших предков с органическими веществами произошло задолго до новой эры.
В те времена люди добывали и обрабатывали только такие материалы, которые были необходимы в каждодневной борьбе за выживание. Из сырья растительного и животного происхождения наши далекие предки получали самые разнообразные продукты: пекли хлеб, делали пиво, уксус и т.д. Немецкий химик Андреас Либавий в XVI веке сухой перегонкой янтаря получил янтарную кислоту.
Новым продуктам чаще всего присваивали названия по тому природному веществу, из которого они были впервые выделены. Так, например, в 1787 г. итальянец Луиджи Брунъятелли окислением пробки получил пробковую кислоту, а в 1670 г. англичанин Джон Рей перегонкой муравьев – муравьиную кислоту.
Эту группу удалось значительно расширить шведскому ученому Карлу Шееле. Он обрабатывал соки известью, а затем действием серной кислоты извлекал кислоты из образовавшихся веществ. В 1784 г. он получил таким путем лимонную, в 1785 г. – яблочную, а в 1786 г. – галловую кислоту, уже известную в то время, но выделенную им более удачным методом – из сброженного экстракта дубильных орешков. С помощью азотной кислоты он пытался превратить глицерин в сахар, но эта реакция дала лишь щавелевую кислоту. Кроме того, в 1780 г. исследователь открыл молочную кислоту, а за четыре года до этого обнаружил в почечных камнях мочевую кислоту.
Более подробно хочется остановиться на истории открытия муравьиной кислоты.
В 1670 г. англичанин Джон Рей провел необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел ее до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой.
Кислота служит насекомому оружием для защиты и нападения. Вряд ли найдется человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Муравьиная кислота есть также в пчелином яде, сосновой хвое, гусеницах шелкопряда, в небольших количествах она найдена в различных фруктах, тканях, выделениях животных и человека.
Роль карбоновых кислот в жизни человека
Муравьиная и уксусная кислоты играют большую роль в жизнедеятельности людей. Они применяются при крашении тканей, в кожевенном и в консервном производствах. Муравьиная кислота применяется при консервировании фруктовых соков, зеленых кормов. В медицине муравьиная кислота применяется для приготовления катализаторов и в ряде синтезов, уксусная кислота применяется в производстве аспирина, фенацетина.
Уксусная кислота в больших количествах расходуется для производства уксусного ангидрида, как и консервирующее и вкусовое вещество, а также в производстве красителей и душистых веществ.
Пропионовая кислота находит все большее применение в синтезе гербицидов, консервантов, полимерных материалов.
Натриевые и калиевые соли высших карбоновых кислот (пальмитиновая и стеариновая кислоты) – основные части мыла.
Физические свойства.
С10Н21СООН - твердые вещества, высшие к/к - без запаха.
- Как будет меняться растворимость кислот с увеличением числа углеродных атомов? (Растворимость кислот должна уменьшаться, т.к. будет увеличиваться длина неполярного УВ радикала).
Температура кипения с увеличением числа УВ радикалов увеличивается, например, tкип. муравьиной кислоты – 100,7 0 С, уксусной кислоты – 118,1 0 С, стеариновой кислоты С17Н35СООН (октадекановая) – 376,1 0 С.
Некоторые представители карбоновых кислот.
Наибольшее значение имеют насыщенные монокарбоновые кислоты или (предельные одноосновные кислоты).
К предельным одноосновным карбоновым кислотамотносятся органические вещества, в молекулах которых имеется одна карбоксильная группа, связанная с радикалом предельного углеводорода или с атомом водорода.
Общая формула предельных одноосновных кислот.
Номенклатура и изомерия.
| Карбоновые кислоты (по природе углеводородного радикала) | ||
| Предельные (насыщенные) | Непредельные (ненасыщенные) | Ароматические |
По международной заместительной номенклатуре название кислоты производят от названия соответствующего (с тем же числом атомов углерода) углеводорода с добавлением окончания -оваяи слова кислота.Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение группы -СООН не указывают.
Внутрикласса возможна только изомерия углеродной цепи. Первые три члена гомологического ряда изомеров не имеют. Четвёртый член гомологического ряда существует в виде двух изомеров
Пятый член ряда существует в виде четырёх изомеров.
Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот
Химические свойства.
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот.
| свойства кислот | химические реакции, характерные для кислот | |
| неорганических | органических | |
| 1. Молекулы кислот в водном растворе диссоциируют (отщепляют ионы водорода) | HNO3 → H + + NO3 - | HCOOH → H + + HCOO - |
| 2.Кислоты реагируют с металлами | 2HСl + Mg → MgCl2 + H2↑ | 2CH3COOH + Mg → (CH3COO)2Mg + H2↑ ацетат магния |
| 3. Кислоты реагируют с основными и амфотерными оксидами и гидроксидами | H2SO4 + MgO → MgSO4 + H2O HСl + NaOH → NaCl + H2O | 2CH3COOH + MgO→ (CH3COO)2Mg + H2O CH3COOH + NaOH → CH3COONa + H2O |
| 4. Кислоты реагируют с солями более слабых и летучих кислот | 2HСl + СаСО3 → Са Cl2 + Н2СО3 | 2CH3COOH + СаСО3 → (CH3COO)2Са + Н2СО3 |
| 5. Кислоты могут образовать кислотные оксиды (или ангидриды – вещества, которые образуются при отщеплении воды от органических кислот) | H2SO4 → SO3↑ + H2O | 2CH3COOH → CH3CO-O-OCCH3 + H2O |
| 6. Кислоты реагируют со спиртами | С2Н5ОН + H2SO4→ С2Н5О - SO2-OH + H2O сложный эфир этилового спирта и серной кислоты | CH3COOH + С5Н11ОН → CH3COO- С5Н11 + H2O сложный эфир изопентилового спирта и уксусной кислоты |
Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором:
Cl – Cl + CH3COOH → Cl CH2COOH + HCl
Муравьиная кислота по химическим свойствам несколько отличается от других карбоновых кислот.
1. Из одноосновных карбоновых кислот муравьиная кислота является самой сильной кислотой.
НСООН + Ag2О → НОСООН + 2Ag↓
3. При нагревании с концентрированной серной кислотой муравьиная кислота отщепляет воду и образуется оксид углерода (II):
Задание на дом.
Какие соединения относятся к карбоновым кислотам?
Обряды и обрядовый фольклор: составляли словесно-музыкальные, драматические, игровые, хореографические жанры, которые.
Образцы сочинений-рассуждений по русскому языку: Я думаю, что счастье – это чувство и состояние полного.
Карбоновые кислоты – органические соединения, которые содержат карбоксильную группу –СООН. Функциональная группа состоит из карбонильной =С=О и гидроксильной –ОН групп. Карбоновые кислоты в жизни человека играют важную роль.
Классификация карбоновых кислот
- Одноосновные (СН3-СООН).
- Двухосновные (НООС-СН2-СООН).
- Трехосновные (НООС-СН(СООН)-СООН).
Также карбоновые кислоты можно разделить на несколько групп по строению углеводородного радикала на предельные, непредельные, ароматические и циклические.
Нахождение кислот в природе
Муравьиная кислота входит в состав выделений муравьев, а также в крапиву и хвою ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются, кислота проникает в организм и оказывает раздражающее действие. Валериановая кислота содержится в корнях валерианы. Масляная кислота входит в состав прогорклого масла.
Области применения карбоновых кислот
Предельные одноосновные кислоты
Муравьиная кислота НСООН используется в пищевой промышленности как добавка E236. Также она применяется как консервирующее средство. Муравьиной кислотой дезинфицируют пивные и винные бочки.
Уксусная кислота СН3СООН необходима для производства красителей. В составе продуктов она обозначается как Е260. Уксусную кислоту применяют при консервировании овощей, грибов и т. д.
Предельные двухосновные кислоты
Щавелевая кислота HOOC−COOH применяется как дезинфицирующее и отбеливающее средство. Она помогает в очистке металлов и удалении накипи и ржавчины. Щавелевая кислота играет роль протравы при окраске тканей, а также для дубления кожи. Она в составе косметических средств помогает в борьбе с пигментными пятнами и веснушками.
Янтарная кислота НООС−СН₂−СН₂−СООН внутри организма участвует в метаболических процессах. С ее помощью осуществляется клеточное дыхание и синтез белков. Янтарная кислота выводит отравляющие вещества и уменьшает вредное действие алкоголя в организме.
Жирные ненасыщенные кислоты
Олеиновая кислота C₁₇H₃₃COOH используется в изготовлении ароматизаторов, смазывающе-охлаждающих жидкостей. Также она применяется как эмульгатор в резинотехнической промышленности.
Линолевая кислота С₁₇H₃₁COOH участвует в регуляции обмена белка и жиров, предотвращении накопления холестерина в организме. Она защищает клетки от преждевременного старения.
Применение карбоновых кислот в медицине
В медицине используют муравьиную кислоту благодаря болеутоляющим, бактерицидным и согревающим действиям. Ее применяют в качестве обезболивающего средства. Карбоновую муравьиную кислоту можно встретить не только в медицине, но и в косметике.
Масляная кислота СH₃(CH₂)₂СООН используется при лечении заболеваний ЖКТ. В кишечнике она образует кислую среду, в которой погибают патогенные микробы и развиваются полезные бактерии.
Многие карбоновые кислоты с чётным количеством атомов углерода в молекуле входят в виде фрагментов в состав животных жиров и растительных масел, поедаемых с пищей. В организме жиры подвергаются гидролизу, при котором образуются эти кислоты в свободном виде, а затем часть из них идёт на строительство собственных запасных жиров человека или на синтез жиров молока. В молочных железах из одних, более длинных карбоновых кислот получаются другие, более короткие: масляная, капроновая, каприловая, каприновая.
Наиболее часто в жирах встречаются кислоты С18:



линолевая:



содержится в организме в очень малых количествах, но играет большую роль в синтезе гормонов.
Линолевая, линоленовая и арахидоновая кислоты являются для организма человека незаменимыми, так как отсутствие их в пище приводит к патологическим изменениям, например, к возникновению дерматитов. Незаменимые жирные кислоты предупреждают и излечивают дерматиты, причём наиболее активна арахидоновая кислота (в 10 раз по сравнению с суммой линолевой и линоленовой кислот). Больше всего арахидоновой кислоты в арахисовом масле, меньше в кукурузном, кунжутном, соевом и хлопковом маслах.
Некоторые авторы считают незаменимые жирные кислоты (НЖК) витаминами. Фрагменты НЖК находятся в фосфолипидных тканях животных и человека, в составе лецитина почек, кефалина мозга.
Запасный жир человека в норме содержит 8,2-11% линолевой кислоты и 0,3-1% арахидоновой кислоты.
Многие карбоновые кислоты являются фармацевтическими препаратами. Так, например, две карбоновые кислоты, содержащие в своей структуре йод, являются рентгеноконтрастными препаратами и применяются за 12-14 часов до рентгеновского исследования желчных путей и желчного пузыря.
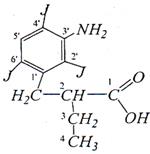
кислота йопаноевая (йопагност, холевид)

кислота йомегламовая (фалигност)
N-метил-N-(3-амино-2,4,6-трийодфенил)амид глутаровой кислоты.
Многие широкоприменяемые фармацевтические препараты являются кислотами. Например, аспирин, он же ацетилсалициловая кислота:

Более сильным жаропонижающим и противовоспалительным средством, чем аспирин, является мефенамовая кислота:

Витамин PP или никотиновая кислота (пиридин-3-карбоновая кислота)

обладает противопеллагрическим эффектом, улучшает углеводный обмен, действует положительно при лёгких формах диабета, заболеваниях печени и сердца.

Это соединение является активным противовоспалительным препаратом, применяемым, например, при ревматоидном артрите, подагре, тромбофлебите и других заболеваниях, сопровождающихся воспалением.
В справочнике Машковского описаны десятки других препаратов, являющихся производными карбоновых, дикарбоновых кислот и их солей.
Химические свойства карбоновых кислот.
Карбоновые кислоты являются слабыми кислотами. В воде они обратимо диссоциируют на карбоксилат-ионы и катионы водорода:
Это равновесие характеризуется константой кислотной диссоциации – Ka
Логарифмируя выражение (I) с помощью десятичных логарифмов, получим:
Меняя в выражении (II) знаки на противоположные и учитывая свойства логарифмов, получим:
Вводя обозначения и , получим:
Очевидно, что если , то pKa=pH.
Условие выполняется, когда , а это в свою очередь, если [R-COOH] = [R-COO - ].
Отсюда следует, что pKa это то значение pH, при котором кислота диссоциировала наполовину или, другими словами, то значение pH среды, при котором концентрация недиссоциированной формы кислоты равна концентрации её аниона. Величина pKa принята за меру силы кислот, в том числе карбоновых. На силу карбоновых кислот влияют характер радикала, наличие в нём заместителей. Так, например, электроноакцепторные заместители увеличивают силу кислот (уменьшают pKa), а донорные уменьшают.
Таким образом, трифторуксусная кислота сильнее аминоуксусной в 10 9 , то есть в миллиард раз.
Влияние заместителей на pKa производных уксусной кислоты
| Название кислоты | Формула | pKa | Качественная характеристика |
| Уксусная | 4,76 | Слабая | |
| Пропионовая (метилуксусная) | 4,87 | Слабая | |
| Пропеновая (акриловая) | 4,26 | Слабая | |
| Пропиновая (пропиоловая) | 1,84 | Средней силы | |
| Хлоруксусная | 2,85 | Средней силы | |
| Дихлоруксусная | 1,30 | Средней силы | |
| Трихлоруксусная | 0,70 | Средней силы (близка к сильным) | |
| Фторуксусная | 2,58 | Средней силы | |
| Трифторуксусная | 0,23 | Средней силы, но очень близка к сильным кислотам. | |
| Фенилуксусная | 4,25 | Слабая | |
| Меркаптоуксусная (тиогликолевая) | 3,68 | Слабая (близка к кислотам средней силы) | |
| Глицин (аминоуксусная) | 9,78 | Очень слабая (почти как фенол) | |
| Нитроуксусная | 2,26 | Средней силы | |
| Малоновая (карбоксилуксусная) | 2,86 | Средней силы | |
| Циануксусная | 2,47 | Средней силы | |
| Триметилуксусная ( пивалевая) | 5,05 | Слабая (≈ в 2 раза слабее уксусной) |
pKa дикарбоновых кислот. Зависимость от длины углеродной цепи
| Название кислоты | Щавелевая | Малоновая | Янтарная | Глутаровая | Адипиновая | Пимелиновая |
| Формула | HOOC-COOH | HOOC-CH2-COOH | HOOC-(CH2)2-COOH | HOOC-(CH2)3-COOH | HOOC-(CH2)4-COOH | HOOC-(CH2)5-COOH |
| pKa(I) | 1.25 | 1.38 | 4.16 | 4.34 | 4.41 | 4.51 |
| pKa (II) | 4.27 | 5.68 | 5.60 | 5.27 | 5.28 | 5.31 |
Обращает на себя внимание такой факт, что остаток ацетилена (то есть атом углерода в состоянии sp-гибридизации) влияет сильнее, чем введение одной нитрогруппы в качестве заместителя.
Удаление заместителя по углеродной цепи далее четвертого атома перестаёт сказываться на pKa. Это видно по таблице pKa дикарбоновых кислот.
Знание величины pKa позволяет решать вопрос о возможности вытеснения одной кислоты действием другой: если разница в pKa составляет одну единицу, то соотношение между кислотами в растворе будет 1:10, например:
То есть реакция (2) пойдёт практически до конца, реакция (1) до установления равновесия (≈1:10), а реакция (3) практически не пойдёт.
1. Как кислоты карбоновые кислоты вступают в реакции:
1.1 С металлами, стоящими в ряду напряжений до водорода:
Безводные жидкие кислоты можно вводить в реакции со щелочными металлами, Sr и Ba, которые в водных растворах реагируют и с водой:
1.2 Со щелочами (реакция нейтрализации):
1.3 С нерастворимыми в воде основаниями:
1.4 С амфотерными гидроксидами:
1.5 С основными оксидами:
1.6 С амфотерными оксидами:
1.7 С солями более слабых кислот:
1.8 С солями нестойких кислот:
2. Действием галогенидов неметаллов или оксигалогенидов неметаллов из карбоновых кислот получаются их галогенангидриды:
3. Действием декаоксида тетрафосфора (фосфорного ангидрида) из карбоновых кислот получаются их ангидириды:
4. Карбоновые кислоты мгновенно реагируют с аммиаком и аминами, давая соли:
При нагревании этих солей отщепляется вода, и получаются амиды или алкиламиды:
Соли триалкиламмониев при тех температурах, при которых аммонийные, моноалкиламмонийные и диалкиламмонийные соли разлагаются с получением соответствующих амидов или алкиламидов и воды, не разлагаются, а при температурах выше 200 о С разлагаются, давая сложную смесь низкомолекулярных продуктов.
Действием на амиды P4O10 получают нитрилы:
Карбоновыми кислотами называют органические вещества, в составе молекул которых входит карбоксильная группа СООН. Соединения обладают свойствами кислот, так как от карбоксильной группы в химических взаимодействиях легко отщепляется атом водорода.
История открытия
К карбоновым кислотам относятся уксусная и муравьиная кислоты, известные достаточно давно. Об уксусе человек узнал с тех пор, как научился делать вино. Алхимики умели получать уксусную кислоту методом перегонки древесины без доступа воздуха уже в XVII веке, но правильного представления о характере этого вещества у них не было. Лишь в начале XIX века знаменитый химик Берцелиус точно определил строение уксусной кислоты.
| Молочная кислота, 80% | Пивалевая кислота | Янтарная кислота |
Классификация
Карбоновые кислоты делят на группы в зависимости от признака, взятого за основу:
- По числу карбоксильных групп различают одно-, двух- и полиосновные кислоты. Уксусная кислота — одноосновная, щавелевая — двухосновная, лимонная — полиосновная.
- В зависимости от наличия в молекуле цикла: алифатические (без цикла), циклические; гетероциклические (в кольце есть атомы не только углерода); ароматические (с ароматическим кольцом, содержащим двойные связи). Бензойная кислота — ароматическая. Никотиновая кислота — гетероциклическая, с атомом азота в кольце.
- По числу атомов углерода в молекуле: низшие (1-3 атома, уксусная, щавелевая кислота), средние (4-9 атомов, лимонная кислота), высшие (свыше 10 атомов, пальмитовая, стеариновая, олеиновая). Высшие кислоты еще называют жирными, так как они содержатся в растительных и животных жирах.
- Предельные (с одинарными связями) и непредельные (с двойными или тройными связями). Муравьиная, янтарная, малоновая кислоты — предельные; олеиновая, сорбиновая — непредельные.
- Если атом водорода в радикале заменен еще одной функциональной группой (галогеном, аминогруппой NH2, карбонильной группой СОН и т.п.), то кислоты относят к классам галогенокислот, аминокислот, оксокислот и т.п. Яблочная кислота — оксикислота; глицин — аминокислота.
Агрегатное состояние кислот в нормальных условиях зависит от размера молекулы. Низшие кислоты — легкоподвижные жидкости, без цвета, с сильным запахом, легко растворяющиеся в воде. Средние кислоты — маслянистые, жидкие, запах неприятный. Высшие — твердые, не водорастворимы. Как и большинство органических веществ, карбоновые кислоты способны к изомеризации (изомеры имеют одинаковый состав атомов, но разное их расположение в пространстве).
Реактивы относятся к слабым кислотам, самые сильные из них — уксусная и муравьиная кислоты. Взаимодействуют с металлами, оксидами и щелочами с образованием солей. Вступают в реакции с солями, образованными более слабой кислотой; с галогенами. Реакции со спиртами позволяют получать сложные эфиры, имеющие большое практическое значение. Также большое значение имеют реакции с литийорганическими соединениями, в результате которых получают кетоны.
Карбоновые кислоты — это органические соединения, часто встречающиеся в природе. Они содержатся в растениях, играют важную роль в обмене веществ животных и человека. Например, муравьиную кислоту впервые выделили из выделений муравьев, но она есть в крапиве и хвое сосны. Масляная кислота образуется в животном масле. Валериановая кислота получила название по корню, в котором содержится.
Читайте также:

