Актуальность периодического закона кратко
Обновлено: 02.07.2024
Открытие периодического закона и создание Периодической таблицы химических элементов имеет огромное значение для развития науки.
- систематизировал и обобщил все сведения о химических элементах и их соединениях, объединил их в единое целое;
- объяснил разные виды периодичности в изменении свойств элементов и образованных ими простых и сложных веществ;
- позволил предсказывать существование неоткрытых химических элементов и прогнозировать их свойства;
- послужил базой для изучения строения ядра атома и электронных оболочек.
Во времена Д. И. Менделеева основным свойством атомов химических элементов считалась атомная масса. Периодический закон в формулировке Д. И Менделеева звучит так:
Свойства элементов, а также состав и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величин их атомных масс .
Позже было изучено строение атома, и стало ясно, что основной характеристикой атома химического элемента является не величина его атомной массы, а величина положительного заряда ядра. Периодический закон стали формулировать иначе. Современная формулировка выглядит следующим образом:
Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Заряды ядер атомов элементов, расположенных в ряд, возрастают непрерывно. Объяснить причины периодичности учёные смогли тогда, когда изучили строение электронных оболочек атомов.
Причиной периодического изменения свойств химических элементов и образуемых ими веществ является периодически повторяющееся строение наружных энергетических уровней электронных оболочек атомов.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Описание презентации по отдельным слайдам:
Современное значение закона Периодической системы Менделеева
Введение 3 слайд
История периодического закона 4 слайд
Современная формулировка периодического закона 5 слайд
Периодическая таблица,группы 6,7 слайд
Периодическая таблица,периоды 8,9 слайд
Прикладное значение периодического закона 10 слайд
Научное значение периодического закона 11 слайд
Значение в современном мире 12 слайд
Заключение 13 слайд
Источники информации 14 слайд
Современная формулировка периодического закона
Периодическая таблица Менделеева состоит из 8 групп
Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Высшая валентность элемента (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов). В главных подгруппах состав водородных соединений являются одинаковыми. Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения.
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Первый период отличается от других тем, что там находятся всего 2 элемента: водород H и гелий He.
Во втором периоде находятся 8 элементов (Li — Ne). Литий Li – щелочной металл начинает период, а замыкает его благородный газ неон Ne.
В третьем периоде, также как и во втором находятся 8 элементов (Na — Ar). Начинает период щелочной металл натрий Na, а замыкает его благородный газ аргон Ar.
Периодическая таблица,периоды
В четвёртом периоде находятся 18 элементов (K — Kr) – Менделеев его обозначил как первый большой период. Начинается он также с щелочного металла Калий, а заканчивается инертным газом криптон Kr. В состав больших периодов входят переходные элементы (Sc — Zn) — d-элементы.
В пятом периоде, аналогично четвертому находятся 18 элементов (Rb — Xe) и структура его сходна с четвёртым. Начинается он также с щелочного металла рубидий Rb, а заканчивается инертным газом ксенон Xe. В состав больших периодов входят переходные элементы (Y — Cd) — d-элементы.
Шестой период состоит из 32 элементов (Cs — Rn). Кроме 10 d-элементов (La, Hf — Hg) в нем находится ряд из 14 f-элементов(лантаноиды)- Ce — Lu
Седьмой период не закончен. Он начинается с Франций Fr, можно предположить, что он будет содержать, также как и шестой период, 32 элемента. Но найдено пока только 24 (до элемента с Z = 110). Сюда входят 14 f-элементов, которые относятся к актиноидам.
Прикладное значение периодического закона
На основе периодического закона Д. И. Менделеева были предсказаны и открыты благородные газы и другие химические элементы.
И сейчас этот закон служит путеводной звездой для открытия или искусственного создания новых химических элементов
Научное значение периодического закона
На основе периодического закона и периодической системы химических элементов ученые
систематизировали и обобщили все сведения о химических элементах и образуемых ими веществах;
Дали обоснование различным видам периодической зависимости, объяснив их на основе строения атомов элементов.
Периодический закон помог также уточнить многие особенности химического поведения уже открытых элементов. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева, расширили пределы Периодической системы элементов. Он используется, например, при синтезе веществ с заранее заданными свойствами, создании новых материалов, подборе эффективных катализаторов.
Значение в современном мире
Открытие периодического закона и периодической системы химических элементов стимулировало поиск причин взаимосвязи элементов, способствовало выявлению сложной структуры атома и развитию учения о строении атома.
Это учение в свою очередь позволило вскрыть физический смысл Периодического закона и объяснить расположение элементов в Периодической системе.
Заключение
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение. После открытия Периодического закона стало ясно, что атомы всех элементов должны быть построены по единому принципу, а их строение должно отображать периодичность свойств элементов. Таким образом, периодический закон стал важным звеном в эволюции атомно-молекулярного учения, оказав значительное влияние на разработку теории строения атома. Он также способствовал формулировке современного понятия "химический элемент" и уточнению представлений о простых и сложных веществах.
Используя Периодический закон, Д. И. Менделеев стал первым исследователем, сумевшим решить проблемы прогнозирования в химии. Это проявилось уже через несколько лет после создания Периодической системы элементов, когда были открыты предсказанные Менделеевым новые химические элементы. Периодический закон помог также уточнить многие особенности химического поведения уже открытых элементов. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева, расширили пределы Периодической системы элементов.

С открытием Менделеева изменилась вся мировая наука. Значение периодического закона химических элементов стало важно не только для химии, но и физики, космологии, геохимии.
Открытие Менделеева
Периодический закон был открыт Дмитрием Менделеевым в 1871 году. Разные учёные XIX века пытались найти закономерность и упорядочить все известные элементы. Менделеев установил, что химические свойства элементов меняются и повторяются с возрастанием относительной атомной массы.

Рис. 1. Менделеев.
На основе этого он расставил 63 известных элемента по шести периодам и восьми группам. Каждый период начинался металлом и заканчивался неметаллом. Менделеев оставил пробелы в таблице для неоткрытых элементов и сделал перерасчёт относительной атомной массы некоторых элементов.
Например, считалось, что атомная масса бериллия – 13,5, а не 9, как это известно сейчас. По логике Менделеева металл необходимо было поместить между углеродом с атомной массой 12 и азотом с атомной массой 14. Однако это нарушало бы принцип периодического закона: металл оказался бы между двумя неметаллами. Поэтому Менделеев предположил, что место бериллия между литием (7) и бором (9), т.е. атомная масса бериллия должна быть примерно 9, а валентность – II или III.
Математическая точность Менделеева впоследствии подтвердилась экспериментально, пропущенные учёным клетки постепенно стали заполняться. При этом Менделеев не знал о существовании элементов, их ещё предстояло открыть, но уже смог определить их порядковый номер, атомную массу, валентность, свойства.
В этом заключается главное значение открытия периодического закона Менделеева. Несмотря на новые знания, нахождение новых элементов и расширение таблицы, принцип периодического закона сохраняется и подтверждается до сих пор.
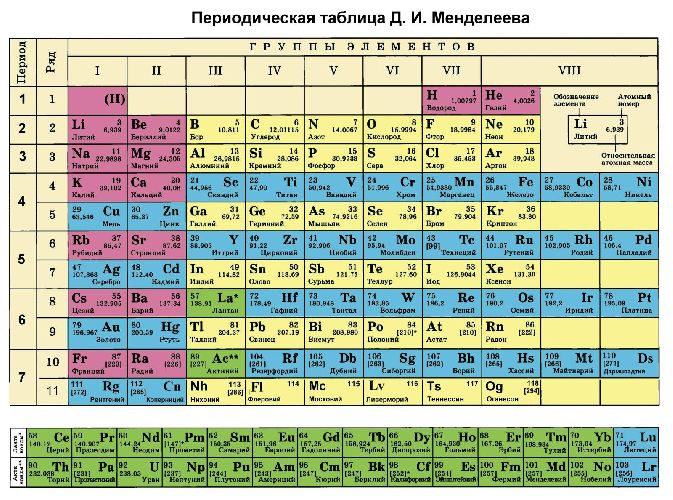
Рис. 2. Современная таблица Менделеева.
Наиболее подробно Менделеев описал три фантомных элемента – экабор, экаалюминий, экасилиций. Они были открыты в 70-80-х годах XIX века и названы соответственно скандием, галлием, германием.
Современность
Открытие, сделанное Менделеевым, повлияло на развитие науки. Если раньше новые элементы находились случайно, то с периодической таблицей химики целенаправленно, ориентируясь на пустые клетки, стали искать элементы. Так были открыты многие редко встречающиеся элементы, например, рений.

Рис. 3. Рений.
Таблица также дополнилась:
- инертными газами;
- радиоактивными элементами.
Кроме того, в конце XIX века благодаря теории строения атома стало известно, что свойства элементов находятся в зависимости не от относительной массы атомов, как это вывел Менделеев, а от заряда ядер. При этом порядковый номер элементов совпал с показателем заряда атома. Это позволило связать химию и физику и продолжить изучение внутриатомной энергии.
Таблица Менделеева охватывает всю неорганическую химию и даёт чёткое представление о химических, физических свойствах элементов и их месте во Вселенной.
Что мы узнали?
Периодический закон Менделеева повлиял на развитие химии и других смежных наук. Менделееву удалось предсказать многие элементы, которые были открыты позже. Он рассчитал для них атомную массу, определил их свойства. Значения подтверждались с нахождением элементов. Периодическая таблица задала направление химии: учёные стали искать элементы, ориентируясь на её пробелы.



Периодический закон и Периодическая система Д.И.Менделеева. Их значение.
1 МБОУ СОШ № 10 г.Красногорска (Московская область), Кадетский корпус имени Маршала Советского Союза Георгия Константиновича Жукова (ГБОУ школа № 1409 г.Москвы)
2 Кадетский корпус имени Маршала Советского Союза Георгия Константиновича Жукова (ГБОУ школа № 1409 г.Москвы)

Автор работы награжден дипломом победителя III степени
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Актуальность темы:
Периодический закон – основа современной химии. Периодическая система позволяет на основе закономерностей обобщать, делать выводы, предвидеть. Они лежат в основе решения современных задач химической науки и промышленности.
Изучить литературу по данной теме. Ознакомиться с областями применения, с работами по получению новых полимерных и полупроводниковых материалов, жаропрочных сплавов, веществ с заданными свойствами, по использованию ядерной энергетики, недр Земли, Вселенной…
Донести до слушателей уникальность открытия Д.И.Менделеева. Доказать то, что открытие Периодического закона ознаменовало собой начало современного нам этапа развития химии. Каждый из нас еще со школы знакомится с периодической системой и умеет ей пользоваться, однако не каждый углубляется в ее многофункциональность и значимость.
темы заключаются в следующем: обеспечить понимание значения периодического закона и периодической системы для развития науки и производства, показать на примере учения о периодичности объясняющую, обобщающую и прогнозирующую роли научной теории, роль практики в процессе познания.
Жизнь и деятельность Д.И.Менделеева
Дмитрий Иванович МЕНДЕЛЕЕВ (1834 г.р.) — гениальный русский учёный и общественный деятель. Широко известен как химик, физик, экономист, метролог, технолог, геолог, метеоролог, педагог, воздухоплаватель.
В 1849 г. окончил Тобольскую гимназию и в конце лета 1850 года был зачислен на физико-математический факультет Главного педагогического института, который окончил в 1955 году с золотой медалью.
В 70-е годы, изучая свойства разреженных газов, Менделеев создает точные приборы для измерения давления и температуры верхних слоев атмосферы. Он увлекается одной из интереснейших проблем того времени — конструированием летательных аппаратов.
В 80-х годах ученым были осуществлены фундаментальные исследования по изучению природы растворов. В начале 90-х годов Д. И. Менделеев, опираясь на результаты этих исследований, получил новое вещество — пироколлодий — и на его основе разработал технологию производства бездымного пироколлодийного пороха.
Еще одна отличительная черта творчества Менделеева его неослабевающий интерес к новым достижениям науки и культуры, преподавательской (педагогической) деятельности, промышленности, кораблестроения, воздухоплавания, метрологии, сельского хозяйства. Ученый находится в постоянном движении — знакомится с научными лабораториями, осматривает промышленные предприятия, месторождения полезных ископаемых, животноводческие фермы и опытные поля, посещает художественные выставки. Он активный участник, а порой и организатор научных съездов, промышленных и художественных выставок, активный общественный деятель.
Периодический закон Д.И.Менделеева
Работать над учебником Менделеев начал в 1867 г., а закончил — в 1871 г. Книга выходила отдельными выпусками, первый появился в конце мая — начале июня 1868 г.
Эти пророческие слова ученого полностью оправдались. Дальнейшее развитие атомной физики не только не опровергло Периодический закон, но стало его теоретической основой.
В отличие от своих предшественников Менделееву удалось составить таблицу, в которую вошли все известные элементы, расположенные по определенной системе. При этом, некоторые клетки он оставил незаполненными, примерно вычислив атомные веса некоторых элементов и описав их свойства.
Периодический закон Дмитрия Ивановича Менделеева — один из фундаментальных законов природы, который увязывает зависимость свойств химических элементов и простых веществ с их атомными массами. В настоящее время закон уточнен, и зависимость свойств объясняется зарядом ядра атома.
Значение Периодического закона и Периодической системы химических элементов
Особо хочу отметить, что 2019 год был посвящен 150-летию Периодической системе Дмитрия Ивановича Менделеева.
Благодаря ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И.Менделеева
(Периодическая система - графическое выражение периодического закона. Естественный ряд химических элементов - ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.):
- сложилось современное понятие о химическом элементе;
- были уточнены представления о простых веществах и соединениях;
- появление периодической системы открыло новую, научную эру в истории химии и ряде смежных наук появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть;
- подтвердились наиболее общие законы развития природы, является всеобщим законом природы;
- данные легли в основу решения современных задач химической науки и промышленности;
- она стала основой для естествознания. И для многих других наук и не только.
Это интересно: Периодическая система связана еще с географией. Название химических элементов берут от наименований городов, стран, континентов, в котором их открыли. Такие как: Франций, Германий, Иртий и др.
ПЕРИОДИЧЕСКИЙ ЗАКОН:
(Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.)
- обобщил большое число природных закономерностей;
- в таблицу, графически представляющую закон, включаются не только все известные элементы, но и те, которые открывают до сих пор;
- все новые открытия не повлияли на актуальность закона и таблицы;
- таблица совершенствуется и изменяется, но ее суть осталась неизменной;
- позволил уточнить атомные веса и другие характеристики некоторых элементов, предсказать существование новых элементов;
- химики получили надежную подсказку, как и где искать новые элементы. Это послужило научной базой прогнозирования в химии;
- кроме этого, закон позволяет с высокой долей вероятности заранее определять свойства еще неоткрытых элементов;
- сыграл огромную роль в развитии неорганической химии в 19-м веке;
- основа современной химии. Химия стала единой целостной наукой. Перестала быть описательной наукой;
- его открытие дало мощнейший толчок в развитии физических и химических знаний;
- были разработаны теории строения атома и химической связи.
Строение атома
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Кратко схему строения атома можно представить в следующем варианте:
Перечисляя значение Периодического закон и Периодической система Д.И.Менделеева, можно назвать ее универсальной и уникальной, применимой во всех практических областях.
Металлурги, например, использовали периодическую таблицу, для того, чтобы заменить какой-либо металл для сплава. Да и благодаря графическому изображению в виде таблицы во всех образовательных учреждениях стало легче изучать строение, свойства элемента. Она помогла в решение задач, где приходилось рассчитывать молярный вес химического вещества, способствует составлению конфигурации элемента.
Много можно говорить и приводить примеров того, что периодическая система - это фундаментальное открытие, которое находит место во всех сферах. В ближайшие годы возможно и открытие химических элементов, не вписывающихся в таблицу Менделеева, что, несомненно, заставит расширить границы познания.
Но на этом моя исследовательская заканчивается и теперь остается только обобщить и сделать выводы.
Делая выводы по проделанной работе можно сказать, что поставленная цель достигнута.
Надеюсь, что эта исследовательская работа, систематизирующая информацию по данной теме, будет полезной и интересной. Возможно, она поможет углубить знания о периодической системе, узнать что-то новое для себя и возникнет желание изучить эту тему в более широком формате.
СПИСОК ЛИТЕРАТУРЫ:
Бояринцев, В. И. Великий русский учёный Дмитрий Иванович Менделеев / В.И. Бояринцев. - М.: Русская правда, 2014;
Великие ученые. Ломоносов. Менделеев. Вернадский (комплект из 3 книг). - М.: Молодая Гвардия, 2010;
Габриелян О.С. и др. Химия 11 кл. М., Дрофа, 2002;
Морозов, Н.А. Д.И. Менделеев и значение его периодической системы для химии будущего / Н.А. Морозов. - М.: Книга по Требованию, 2012;
Тищенко, В. Е. Дмитрий Иванович Менделеев, его жизнь и деятельность. Университетский период 1861 - 1890 гг. / В.Е. Тищенко, Н М. Н, Младенцев. - М.: Наука, 1993;
Фигуровский, Н. А. Дмитрий Иванович Менделеев. 1834-1907 / Н.А. Фигуровский. - М.: Наука, 1983;
Читайте также:

