Аденилатциклазная система кратко и понятно
Обновлено: 18.05.2024
Циклический АМФ (циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы). Этапы передачи сигнала:
1) Взаимодействие лиганда с рецептором приводит к изменению конформации последнего.
2)Это изменение передается на G-белок, который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.В составе G-белков α-субъединицы бывают 2х типов по отношению к аденилатциклазе: активирующие αS и ингибирующие αI.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αS-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ.
Если в действо была вовлечена αI-субъединица – она ингибирует аденилатциклазу, все останавливается.
5) Циклический АМФ – вторичный мессенджер – в свою очередь, взаимодействует с протеинкиназой А и активирует ее. Протеинкиназа А фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, ТАГ-липаза.
6)Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
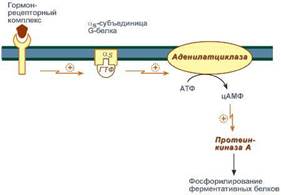
7) Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
8)Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро – в клетке активируются соответствующие процессы.
- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет. Механизм наработки цАМФ связан с активацией фермента аденилатциклазы и называется аденилатциклазный механизм.
Гормоны, для которых циклический АМФ служит в качестве вторичного медиатора:
Гормон Мишень: орган/ткань Типичное действие
Адренокортикотропный гормон Кора надпочечников Продуцирование кортизола
Кальцитонин Кости Концентрация кальция в сыворотке крови
Катехоламины (b-адренергические) Сердце ЧСС, сократимость миокарда
Хорионический гонадотропин Яичники, семенники Продуцирование половых гормонов
Фолликулостимулирующий гормон Яичники, семенники Гаметогенез
Глюкагон Печень Гликогенолиз, высвобождение глюкозы
Лютеинизирующий гормон Яичники, семенники Продуцирование половых гормонов
Рилизинг-фактор лютеинизирующего гормона Гипофиз Высв-е лютеинизирующего гормона
Меланоцитстимулирующий гормон Кожа (меланоциты) Пигментация
Гормон паращитовидных желез Кости, почки Концентрация Са и Р в сыворотке крови
Простациклин, простагландин Тромбоциты Агрегация тромбоцитов
Тиреотропный гормон Щитовидная железа Продуцирование и высвобождение Тз и Т 4
Рилизинг-фактор тиреотропного гормона Гипофиз Высвоб-е тиреотропного гормона
Вазопрессин Почки Концентрация мочи
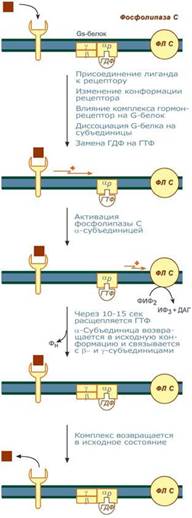
По этому механизму, который получил название кальций-фосфолипидный механизм, действуют вазопрессин (через V1-рецепторы), адреналин (через α1-адренорецепторы), ангиотензин II.
Принцип работы этого механизма совпадает с предыдущим, но вместо аденилатциклазы мишеневым ферментом для α-субъединицы служит фосфолипаза С. Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат (ФИФ2) до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ).
Этапы передачи сигнала:
1)Взаимодействие гормона с рецептором приводит к изменению конформации последнего.
2) Это изменение передается на G-белок, который состоит из трех субъединиц (αP, β и γ), α-субъединица связана с ГДФ.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на αP-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αP-субъединица стимулирует фосфолипазу С, которая начинает расщепление ФИФ2 до двух вторичных мессенджеров – ИФ3 и ДАГ.
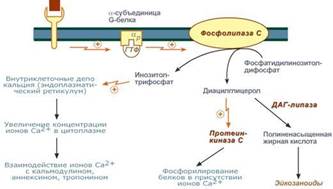
5)Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+. Диацилглицерол совместно с ионами Са2+ активирует протеинкиназу С. Кроме этого, диацилглицерол имеет и другую сигнальную функцию: он может распадаться на 1-моноацилглицерол и полиеновую жирную кислоту (обычно арахидоновую), из которой образуются эйкозаноиды.

6)Протеинкиназа С фосфорилирует ряд ферментов и в целом участвует в процессах клеточной пролиферации. Накопление ионов Са2+ в цитоплазме вызывает активацию определенных кальций-связывающих белков (например, кальмодулина).
7)Гидролиз ФИФ2 продолжается некоторое время, пока αP-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
8)Как только ГТФ превратился в ГДФ, то αP-субъединица инактивируется, теряет свое влияние на фосфолипазу C, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
9) Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск механизма произойдет быстро – в клетке активируются соответствующие процессы.
- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет.
Гуанилатциклазный механизм пока изучен недостаточно подробно, но известно, что по нему работает атриопептин (предсердный натрийуретический пептид), оксид азота (NO) и другие, пока малоизученные, соединения.
Гуанилатциклазный механизм передачи сигнала в общих чертах схож с аденилатциклазным: после появления какой-либо сигнальной молекулы сигнал воспринимается ферментом гуанилатциклазой и далее передается при помощи вторичного мессенджера цГМФ. Он воздействует на протеинкиназу G, которая фосфорилирует определенные белки, чем изменяет активность клетки.Но, в отличие от аденилатциклазы, данный фермент имеет четыре разновидности, три из которых связаны с мембраной, четвертый – цитозольный:
мембраносвязанные формы гуанилатциклазы работают как рецепторы, обладающие каталитической активностью.
Инозитолтрифосфат - это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора. Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона (Пример – АКТГ). В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы. В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Циклический АМФ (циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы). Этапы передачи сигнала:
1) Взаимодействие лиганда с рецептором приводит к изменению конформации последнего.
2)Это изменение передается на G-белок, который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.В составе G-белков α-субъединицы бывают 2х типов по отношению к аденилатциклазе: активирующие αS и ингибирующие αI.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αS-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ.
Если в действо была вовлечена αI-субъединица – она ингибирует аденилатциклазу, все останавливается.
5) Циклический АМФ – вторичный мессенджер – в свою очередь, взаимодействует с протеинкиназой А и активирует ее. Протеинкиназа А фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, ТАГ-липаза.
6)Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.

7) Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
8)Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро – в клетке активируются соответствующие процессы.
- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет. Механизм наработки цАМФ связан с активацией фермента аденилатциклазы и называется аденилатциклазный механизм.
Гормоны, для которых циклический АМФ служит в качестве вторичного медиатора:
Гормон Мишень: орган/ткань Типичное действие
Адренокортикотропный гормон Кора надпочечников Продуцирование кортизола
Кальцитонин Кости Концентрация кальция в сыворотке крови
Катехоламины (b-адренергические) Сердце ЧСС, сократимость миокарда
Хорионический гонадотропин Яичники, семенники Продуцирование половых гормонов
Фолликулостимулирующий гормон Яичники, семенники Гаметогенез
Глюкагон Печень Гликогенолиз, высвобождение глюкозы
Лютеинизирующий гормон Яичники, семенники Продуцирование половых гормонов
Рилизинг-фактор лютеинизирующего гормона Гипофиз Высв-е лютеинизирующего гормона
Меланоцитстимулирующий гормон Кожа (меланоциты) Пигментация
Гормон паращитовидных желез Кости, почки Концентрация Са и Р в сыворотке крови
Простациклин, простагландин Тромбоциты Агрегация тромбоцитов
Тиреотропный гормон Щитовидная железа Продуцирование и высвобождение Тз и Т 4
Рилизинг-фактор тиреотропного гормона Гипофиз Высвоб-е тиреотропного гормона
Вазопрессин Почки Концентрация мочи

По этому механизму, который получил название кальций-фосфолипидный механизм, действуют вазопрессин (через V1-рецепторы), адреналин (через α1-адренорецепторы), ангиотензин II.
Принцип работы этого механизма совпадает с предыдущим, но вместо аденилатциклазы мишеневым ферментом для α-субъединицы служит фосфолипаза С. Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат (ФИФ2) до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ).
Этапы передачи сигнала:
1)Взаимодействие гормона с рецептором приводит к изменению конформации последнего.
2) Это изменение передается на G-белок, который состоит из трех субъединиц (αP, β и γ), α-субъединица связана с ГДФ.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на αP-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αP-субъединица стимулирует фосфолипазу С, которая начинает расщепление ФИФ2 до двух вторичных мессенджеров – ИФ3 и ДАГ.
5)Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+. Диацилглицерол совместно с ионами Са2+ активирует протеинкиназу С. Кроме этого, диацилглицерол имеет и другую сигнальную функцию: он может распадаться на 1-моноацилглицерол и полиеновую жирную кислоту (обычно арахидоновую), из которой образуются эйкозаноиды.
6)Протеинкиназа С фосфорилирует ряд ферментов и в целом участвует в процессах клеточной пролиферации. Накопление ионов Са2+ в цитоплазме вызывает активацию определенных кальций-связывающих белков (например, кальмодулина).
7)Гидролиз ФИФ2 продолжается некоторое время, пока αP-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
8)Как только ГТФ превратился в ГДФ, то αP-субъединица инактивируется, теряет свое влияние на фосфолипазу C, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
9) Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск механизма произойдет быстро – в клетке активируются соответствующие процессы.

- если гормона в крови мало – для клетки наступает некоторая пауза, изменения метаболизма нет.
Гуанилатциклазный механизм пока изучен недостаточно подробно, но известно, что по нему работает атриопептин (предсердный натрийуретический пептид), оксид азота (NO) и другие, пока малоизученные, соединения.
Гуанилатциклазный механизм передачи сигнала в общих чертах схож с аденилатциклазным: после появления какой-либо сигнальной молекулы сигнал воспринимается ферментом гуанилатциклазой и далее передается при помощи вторичного мессенджера цГМФ. Он воздействует на протеинкиназу G, которая фосфорилирует определенные белки, чем изменяет активность клетки.Но, в отличие от аденилатциклазы, данный фермент имеет четыре разновидности, три из которых связаны с мембраной, четвертый – цитозольный:
мембраносвязанные формы гуанилатциклазы работают как рецепторы, обладающие каталитической активностью.
Инозитолтрифосфат - это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора. Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона (Пример – АКТГ). В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы. В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученных белков: 1) рецептор гормона; 2) фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ); 3) G-белок, осуществляющий связь между аденилатциклазой и рецептором; 4) цАМФ-зависимая протеинкиназа, катализирующая фосфорилирование внутриклеточных ферментов или белков-мишеней, соответственно изменяя их активность; 5) фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала (рис. 8.5).
Получены в чистом виде α- и β-адренергические рецепторы из плазматических мембран клеток печени, мышц и жировой ткани. Показано, что связывание гормона с β-адренергическим рецептором приводит к структурным изменениям внутриклеточного домена рецептора, что в свою очередь обеспечивает взаимодействие рецептора со вторым белком сигнального пути – ГТФ-связывающим.
ГТФ-связывающий белок – G-белок – представляет собой смесь 2 типов белков: активного Gs(от англ. stimulatory G) и ингибиторного Gi с мол. массой 80000–90000. В составе каждого из них имеется три разные субъединицы (α-, β- и γ-), т.е. это гетеротримеры. Показано, что β-субъеди-ницы Gsи Giидентичны (мол. масса 35000); в то же время α-субъединицы, являющиеся продуктами разных генов (мол. масса 45000 и 41000), оказались ответственными за проявление G-белком активаторной и ингибиторной активности соответственно. Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Gs-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствии ионов Mg 2+ на β-, γ-субъединицы и комплекс α-субъединицы Gsв ГТФ-форме; этот активный комплекс затем перемещается к молекуле аденилатциклазы и активирует ее. Сам комплекс затем подвергается самоинактивации за счет энергии распада ГТФ и реассоциации β- и γ-субъединиц с образованием первоначальной ГДФ-формы Gs.
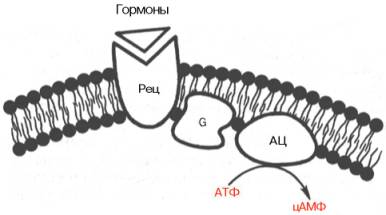
Рис. 8.5. Аденилатциклазный путь передачи гормонального сигнала.
Рец - рецептор; G - G-белок; АЦ-аденилатциклаза.
Аденилатциклаза представляет собой интегральный белок плазматических мембран, его активный центр ориентирован в сторону цитоплазмы и катализирует реакцию синтеза цАМФ из АТФ:
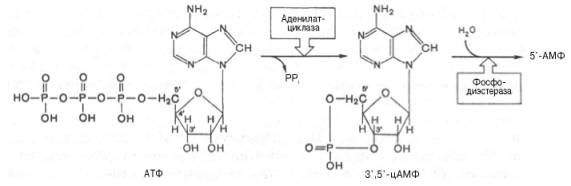
Каталитический компонент аденилатциклазы, выделенный из разных тканей животных, представлен одним полипептидом с мол. массой 120000– 150000; в отсутствие G-белков он практически неактивен; содержит две SH-группы, одна из которых вовлечена в сопряжение с Gs-белком, а вторая необходима для проявления каталитической активности. В молекуле фермента имеется несколько аллостерических центров, через которые осуществляется регуляция активности низкомолекулярными соединениями: ионами Mg 2+ , Mn 2+ и Са 2+ , аденозином и форсколином. Под действием фосфоди-эстеразы цАМФ гидролизуется с образованием неактивного 5'-АМФ.
Протеинкиназа – это внутриклеточный фермент, через который цАМФ реализует свой эффект. Протеинкиназа может существовать в 2 формах. В отсутствие цАМФ Протеинкиназа представлена в виде тетрамерного комплекса, состоящего из двух каталитических (С2) и двух регуляторных (R2) субъединиц с мол. массами 49000 и 38000 соответственно; в этой форме фермент неактивен. В присутствии цАМФ протеинкиназный комплекс обратимо диссоциирует на одну R2-субъединицу и две свободные каталитические субъединицы С; последние обладают ферментативной активностью, катализируя фосфорилирование белков и ферментов, соответственно изменяя клеточную активность.
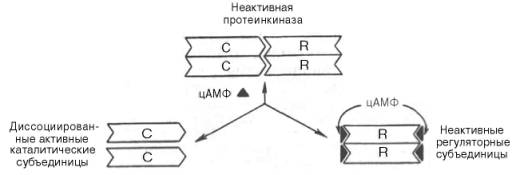
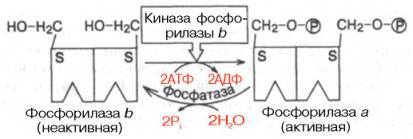
Рис. 8.6. Ковалентная регуляция гликогенфосфорилазы.
Следует отметить, что в клетках открыт большой класс цАМФ-зависи-мых протеинкиназ , названных протеинкиназами А; они катализируют перенос фосфатной группы на ОН-группы серина и треонина (так называемые серин-треонин-киназы). Другой класс протеинкиназ, в частности активируемый инсулиновым рецептором (см. ранее), действует только на ОН-группу тирозина. Однако во всех случаях добавление высокозарядной и объемной фосфатной группы вызывает не только конформационные изменения фосфорилированных белков, но изменяет их активность или кинетические свойства.
Активность многих ферментов регулируется цАМФ-зависимым фосфо-рилированием, соответственно большинство гормонов белково-пептидной природы активирует этот процесс. Однако ряд гормонов оказывает тормозящий эффект на аденилатциклазу, соответственно снижая уровень цАМФ и фосфорилирование белков. В частности, гормон соматостатин, соединяясь со своим специфическим рецептором – ингибиторным G-белком (Gi , являющимся структурным гомологом Gs-белка (см. ранее), ингиби-рует аденилатциклазу и синтез цАМФ, т.е. вызывает эффект, прямо противоположный вызываемому адреналином и глюкагоном. В ряде органов простагландины (в частности, РGЕ1) также оказывают ингибиторный эффект на аденилатциклазу, хотя в том же органе (в зависимости от типа клеток) и тот же PGE1может активировать синтез цАМФ.
Более подробно изучен механизм активирования и регуляции мышечной гликогенфосфорилазы, активирующей распад гликогена. Выделяют 2 формы: каталитически активную – фосфорилазаа и неактивную – фосфо-рилаза b. Обе фосфорилазы построены из двух идентичных субъединиц (мол. массой 94500), в каждой остаток серина в положении 14 подвергается процессу фосфорилирования–дефосфорилирования, соответственно активированию и инактивированию (рис. 8.6).
Под действием киназы фосфорилазы b, активность которой регулируется цАМФ-зависимой протеинкиназой, обе субъединицы молекулы неактивной формы фосфорилазы b подвергаются ковалентному фосфорилиро-ванию и превращаются в активную фосфорилазу а. Дефосфорилирование последней под действием специфической фосфатазы фосфорилазы а приводит к инактивации фермента и возврату в исходное состояние.
В мышечной ткани открыты 3 типа регуляции гликогенфосфорилазы. Первый тип – ковалентная регуляция, основанная на гормонзависимом фосфорилировании–дефосфорилировании субъединиц фосфорилазы (см. рис. 8.6).
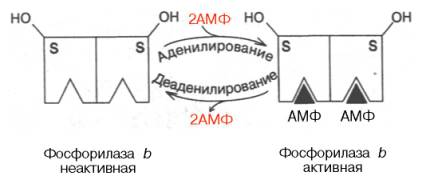
Второй тип – аллостерическая регуляция. Она основана на реакциях аденилирования–деаденилирования субъединиц гликогенфосфорилазы b (соответственно активирование–инактивирование). Направление реакций определяется отношением концентраций АМФ и АТФ, присоединяющихся не к активному центру, а к аллостерическому центру каждой субъединицы (рис. 8.7).
В работающей мышце накопление АМФ, обусловленное тратой АТФ, вызывает аденилирование и активирование фосфорилазы b. В покое, наоборот, высокие концентрации АТФ, вытесняя АМФ, приводят к аллостериче-скому ингибированию этого фермента путем деаденилирования.
цАМФ и протеинкиназа играют центральную роль в гормональной регуляции синтеза и распада гликогена в печени (рис. 8.8). Подробно о химических превращениях гликогена см. в главе 10.
Третий тип – кальциевая регуляция, основанная на аллостерическом активировании киназы фосфорилазы b ионами Са 2+ , концентрация которых повышается при мышечном сокращении, способствуя тем самым образованию активной фосфорилазы а.
neclesa Знаток (283), закрыт 5 лет назад http://www.rusmedserver.ru/med/haris/64.html -- гуглить я и сам могу :-)
Может кто-то доходчиво и кратко обьяснить весь процес преобразования АТФ в цАМФ ?" />
В настоящее время хорошо изучена система передачи сигнала клеткам с помощью некоторых гормонов, в состав которых входят пептидные цепочки. Рецептор представляет собой гликопротеид, пронизывающий плазмалемму. При связывании гормона с рецепторной частью белка в нем происходит активация каталитической внутриклеточной части, в результате чего активируется фермент - аденилатциклаза . Функция этого фермента заключается в том, что он синтезирует из АТФ циклическую аденозинмонофосфорную кислоту ( цАМФ ), которая, в свою очередь, может регулировать скорость различных внутриклеточных процессов, вызывая активацию или подавление (ингибирование) тех или иных ферментов клеточного метаболизма (обмена веществ) . Эффективность аденилатциклазной системы очень велика, синтез цАМФ, активируемой аденилатциклазой, приводит к десятикратному усилению сигнала гормона.
Гормоны - это биологически активные вещества, которые синтезируются в малых количествах в специализированнных клетках эндокринной системы и через циркулирующие жидкости (например, кровь) доставляются к клеткам-мишеням, где оказывают свое регулирующее действие.
Гормоны, как и другие сигнальные молекулы, обладают некоторыми общими свойствами.
- выделяются из вырабатывающих их клеток во внеклеточное пространство;
- не являются структурными компонентами клеток и не используются как источник энергии;
- способны специфически взаимодействовать с клетками, имеющими рецепторы для данного гормона;
- обладают очень высокой биологической активностью - эффективно действуют на клетки в очень низких концентрациях (около 10-6-10-11 моль/л).
Механизмы действия гормонов
Гормоны оказывают влияние на клетки-мишени.
Клетки-мишени- это клетки, которые специфически взаимодействуют с гормонами с помощью специальных белков-рецепторов. Эти белки-рецепторы располагаются на наружной мембране клетки, или в цитоплазме, или на ядерной мембране и на других органеллах клетки.
Биохимические механизмы передачи сигнала от гормона в клетку-мишень.
Любой белок-рецептор состоит, минимум из двух доменов (участков), которые обеспечивают выполнение двух функций:
- узнавание гормона;
- преобразование и передачу полученного сигнала в клетку.
Каким образом белок-рецептор узнает ту молекулу гормона, с которой он может взаимодействовать?
Один из доменов белка-рецептора имеет в своем составе участок, комплементарный какой-то части сигнальной молекулы. Процесс связывания рецептора с сигнальной молекулой похож на процесс образования фермент-субстратного комплекса и может определяется величиной константы сродства.
Большинство рецепторов изучены недостаточно, потому что их выделение и очистка очень сложные, а содержание каждого вида рецепторов в клетках очень низкое. Но известно, что гормоны взаимодействуют со своими рецепторами физико-химическим путем. Между молекулой гормона и рецептором формируются электростатические и гидрофобные взаимодействия. При связывании рецептора с гормоном происходят конформационные изменения белка-рецептора и комплекс сигнальной молекулы с белком-рецептором активируется. В активном состоянии он может вызывать специфические внутриклеточные реакции в ответ на принятый сигнал. Если нарушен синтез или способность белков-рецепторов связываться с сигнальными молекулами, возникают заболевания - эндокринные нарушения.
Есть три типа таких заболеваний.
- Связанные с недостаточностью синтеза белков-рецепторов.
- Связанные с изменением структуры рецептора - генетических дефекты.
- Связанные с блокированием белков-рецепторов антителами.
Механизмы действия гормонов на клетки-мишени.
В зависимости от строения гормона существуют два типа взаимодействия. Если молекула гормона липофильна, (например, стероидные гормоны), то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране.
Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала. Это происходит с участием веществ, которых называют вторыми посредниками. Молекулы гормонов очень разнообразны по форме, а "вторые посредники" - нет.
Надежность передачи сигнала обеспечивает очень высокое сродство гормона к своему белку-рецептору.
Что такое посредники, которые участвуют во внутриклеточной передаче гуморальных сигналов?
Это циклические нуклеотиды (цАМФ и цГМФ), инозитолтрифосфат, кальций-связывающий белок - кальмодулин, ионы кальция, ферменты, участвующие в синтезе циклических нуклеотидов, а также протеинкиназы - ферменты фосфорилирования белков. Все эти вещества участвуют в регуляции активности отдельных ферментных систем в клетках-мишенях.
Разберем более подробно механизмы действия гормонов и внутриклеточных посредников.
Существует два главных способа передачи сигнала в клетки-мишени от сигнальных молекул с мембранным механизмом действия:
- аденилатциклазная (или гуанилатциклазная) системы;
- фосфоинозитидный механизм.
Аденилатциклазная система.
Основные компоненты: мембранный белок-рецептор, G-белок, фермент аденилатциклаза, гуанозинтрифосфат, протеинкиназы.
Кроме того, для нормального функционирования аденилатциклазной системы, требуется АТФ.
Белок-рецептор, G-белок, рядом с которым располагаются ГТФ и фермент (аденилатциклаза) встроены в мембрану клетки.
До момента действия гормона эти компоненты находятся в диссоциированнном состоянии, а после образования комплекса сигнальной молекулы с белком-рецептором происходят изменения конформации G-белка. В результате одна из субъединиц G-белка приобретает способность связываться с ГТФ.
Комплекс "G-белок-ГТФ" активирует аденилатциклазу. Аденилатциклаза начинает активно превращать молекулы АТФ в ц-АМФ.
ц-АМФ обладает способностью активировать особые ферменты - протеинкиназы, которые катализируют реакции фосфорилирования различных белков с участием АТФ. При этом в состав белковых молекул включаются остатки фосфорной кислоты. Главным результатом этого процесса фосфорилирования является изменение активности фосфорилированного белка. В различных типах клеток фосфорилированию в результате активации аденилат-циклазной системы подвергаются белки с разной функциональной активностью. Например, это могут быть ферменты, ядерные белки, мембранные белки. В результате реакции фосфорилирования белки могут становятся функционально активными или неактивными.
Такие процессы будут приводить к изменениям скорости биохимических процессов в клетке-мишени.
Активация аденилатциклазной систтемы длится очень короткое время, потому что G-белок после связывания с аденилатциклазой начинает проявлять ГТФ-азную активность. После гидролиза ГТФ G-белок восстанавливает свою конформацию и перестает активировать аденилатциклазу. В результате прекращается реакция образования цАМФ.
Кроме участников аденилатциклазной системы в некоторых клетках-мишенях имеются белки-рецепторы, связанные с G-белками, которые приводят к торможению аденилатциклазы. При этом комплекс "GTP-G-белок" ингибирует аденилатциклазу.
Когда останавливается образование цАМФ, реакции фосфорилирования в клетке прекращаются не сразу: пока продолжают существовать молекулы цАМФ - будет продолжаться и процесс активации протеинкиназ. Для того, чтобы прекратить действие цАМФ, в клетках существует специальный фермент - фосфодиэстераза, который катализирует реакцию гидролиза 3',5'-цикло-АМФ до АМФ.
Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу, (например, алкалоиды кофеин, теофиллин), способствуют сохранению и увеличению концентрации цикло-АМФ в клетке. Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше, т. е. усиливается действие гормона.
Кроме аденилатциклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат- это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора.
Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Таким образом, в роли "вторых посредников" для передачи сигналов от гормонов в клетках-мишенях могут быть:
- циклические нуклеотиды (ц-АМФ и ц-ГМФ);
- ионы Са;
- комплекс "Са-кальмодулин";
- диацилглицерин;
- инозитолтрифосфат.
Механизмы передачи информации от гормонов внутри клеток-мишеней с помощью перечисленных посредников имеют общие черты:
- одним из этапов передачи сигнала является фосфорилирование белков;
- прекращение активации происходит в результате специальных механизмов, инициируемых самими участниками процессов, - существуют механизмы отрицательной обратной связи.
Гормоны являются основными гуморальными регуляторами физиологических функций организма, и в настоящее время хорошо известны их свойства, процессы биосинтеза и механизмы действия.
Читайте также:
- Инструкция по охране труда при эксплуатации весов электронных в доу
- Инструкция по охране труда учителя биологии в школе
- Диск поурочное планирование школа россии 1 класс
- Правила поведения человека в повседневной жизни помогающие ему избежать криминальных ситуаций кратко
- Приказ о проведении олимпиады в доу

