Твердое состояние вещества доклад
Обновлено: 18.05.2024
Актуальность тематики состоит в понимании необходимости наличия данного знания, так как по существу оно носит основополагающий фундаментальный характер. Как известно, любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества — твердое, жидкое и газообразное.
Одно и то же вещество может находиться в твердом, жидком или газообразном состоянии. Нам хорошо знакомы лед, вода и пар; давно известно, что это различные состояния одного и того же вещества - воды; но они так сильно различаются, что в разговорном языке не появилось объединяющего их слова.
Для того чтобы понять, как растут кристаллы из газообразных, жидких или твердых сред, нам мало знать внешние физические различия этих трех состояний материи, надо хорошо уяснить себе своеобразие их атомно-кинетического строения.
В ходе исследования автором были поставлены две основные задачи:
– изучить понятие состояний веществ;
– изучить особенности состояний веществ.
Рассмотрением вышеперечисленных аспектов мы и намерены заняться в дальнейшем.
Глава 1. Понятие состояний веществ
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном . Четвертым агрегатным состоянием вещества часто считают плазму .[1] Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.[2]
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
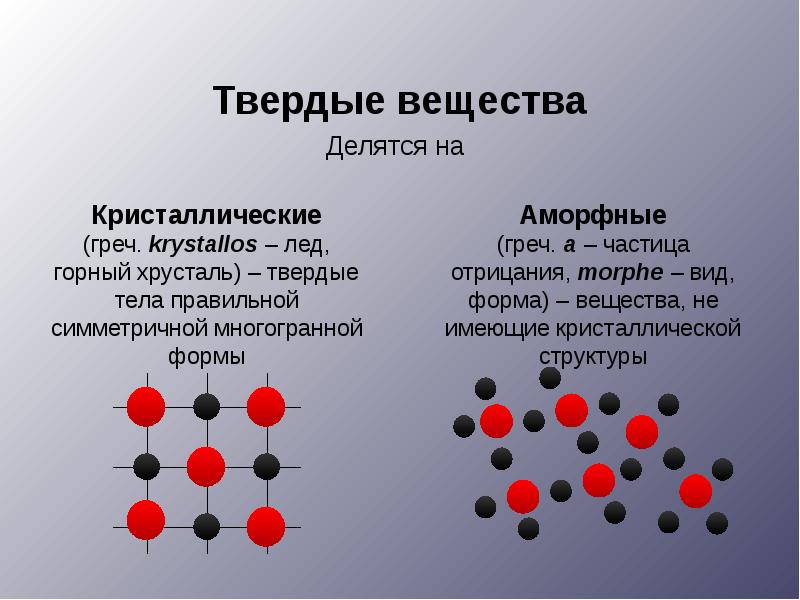
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
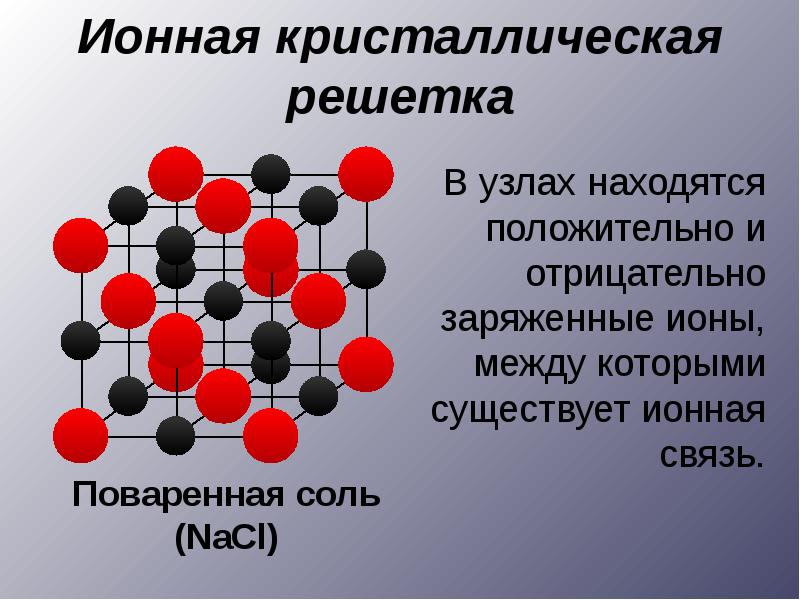
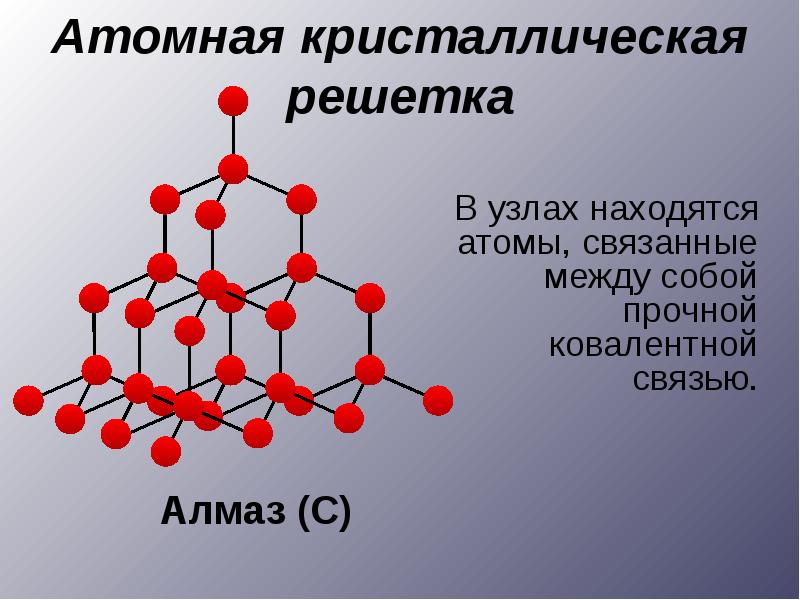
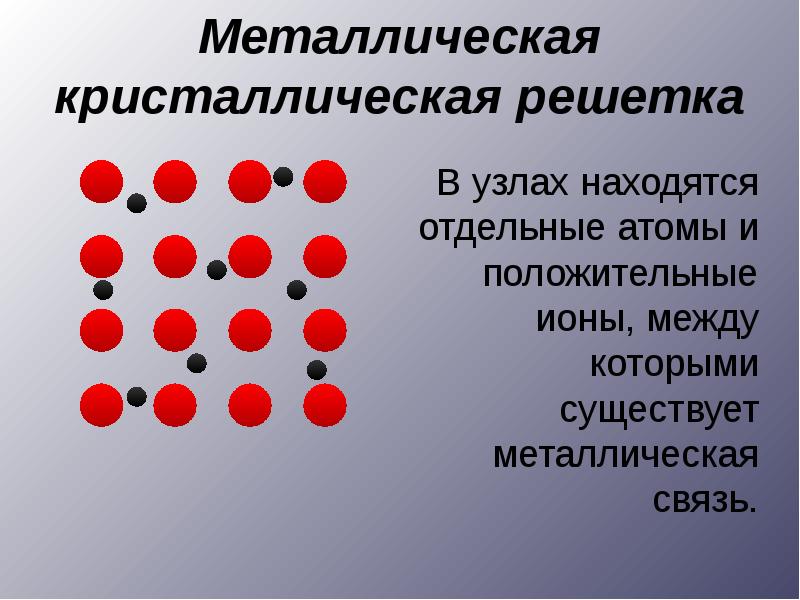
В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решетки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях.
В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью.
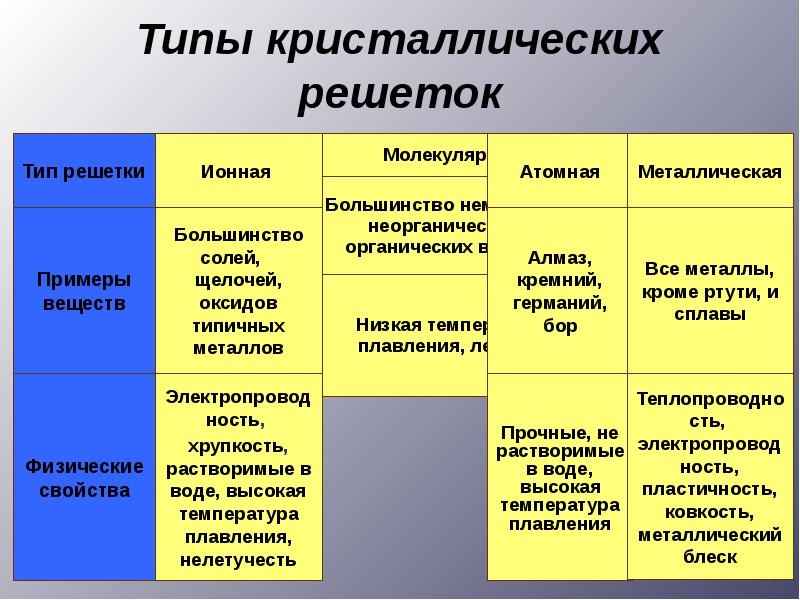
По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические.[3]
Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим. Поликристаллические материалы изотропны.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливается процесс термической ионизации. Молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. На поверхности Земли в естественных условиях плазма - редкий гость, появляющийся лишь при вспышках молний.
В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы и т. д. За последние годы применение плазмы существенно расширилось.[4]
Высокотемпературная плазма (Т ~ 10 6 -10 8 К) из смеси дейтерия с тритием используется для осуществления управляемого термоядерного синтеза; низкотемпературная плазма (Т = 5 К) - в различных газоразрядных приборах: газовых лазерах, ионных приборах, МГД-генераторах и так далее.
Глава 2. Особенности состояний веществ
Газ (франц. gaz, от греч. chaos — хаос) есть агрегатное состояние вещества, в котором кинетическая энергия теплового движения его частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию взаимодействий между ними, в связи с чем частицы движутся свободно, равномерно заполняя в отсутствие внешних полей весь предоставленный им объем.
Газ расширяется, пока не заполнит весь отведенный ему объем. Если рассмотреть газ на молекулярном уровне, мы увидим беспорядочно мечущиеся и сталкивающиеся между собой и со стенками сосуда молекулы, которые, однако, практически не вступают во взаимодействие друг с другом. Если увеличить или уменьшить объем сосуда, молекулы равномерно перераспределятся в новом объеме. Молекулярно-кинетическая теория связывает молекулярные свойства газа с его макроскопическими свойствами, такими как температура и давление.[5]
Жидкость есть агрегатное состояние вещества, сочетающее в себе черты твердого состояния (сохранение объема, определенная прочность на разрыв) и газообразного (изменчивость формы). Для жидкости характерны ближний порядок в расположении частиц (молекул, атомов) и малое различие в кинетической энергии теплового движения молекул и их потенциальной энергии взаимодействия. Тепловое движение молекул жидкости состоит из колебаний около положений равновесия и сравнительно редких перескоков из одного равновесного положения в другое, с этим связана текучесть жидкости.
В отличие от газа жидкость при заданной температуре занимает фиксированный объем, однако и она принимает форму заполняемого сосуда — но только ниже уровня ее поверхности. На молекулярном уровне жидкость проще всего представить в виде молекул-шариков, которые хотя и находятся в тесном контакте друг с другом, однако имеют свободу перекатываться друг относительно друга, подобно круглым бусинам в банке. Налейте жидкость в сосуд — и молекулы быстро растекутся и заполнят нижнюю часть объема сосуда, в результате жидкость примет его форму, но не распространится в полном объеме сосуда.[6]
Твердое тело есть агрегатное состояние вещества, отличающееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания вокруг положений равновесия. Различают кристаллические и аморфные твердые тела. В первых существует пространственная периодичность в расположении равновесных положений атомов. В аморфных твердых телах атомы колеблются около хаотически расположенных точек. Устойчивым состоянием твердых тел является кристаллическое. Различают твердые тела с ионной, ковалентной, металлической и др. типами связи между атомами, что обусловливает разнообразие их физических свойств. Электрические и некоторые др. свойства твердых тел в основном определяются характером движения внешних электронов его атомов. По электрическим свойствам твердые тела делятся на диэлектрики, полупроводники и металлы, по магнитным — на диамагнетики, парамагнетики и тела с упорядоченной магнитной структурой. Исследования свойств твердых тел объединились в большую область — физику твердого тела, развитие которой стимулируется потребностями техники.
Твердое тело имеет собственную форму, не растекается по объему контейнера и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры — кристаллические решетки, — так и беспорядочное нагромождение — аморфные тела (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске).[7]
Выше были описаны три классических агрегатных состояния вещества. Имеется, однако, и четвертое состояние, которые физики склонны относить к числу агрегатных. Это плазменное состояние. Плазма характеризуется частичным или полным срывом электронов с их атомных орбит, при этом сами свободные электроны остаются внутри вещества. Таким образом, плазма, будучи ионизированной, в целом остается электрически нейтральной, поскольку число положительных и отрицательных зарядов в ней остается равным. Мы можем наблюдать как холодную и в незначительной степени ионизированную плазму (например, в люминесцентных лампах), так и полностью ионизированную горячую плазму (внутри Солнца, например).
При сверхнизких температурах скорости молекул снижаются настолько, что мы не можем точно определить их местоположение. Это происходит в силу принципа неопределенности Гейзенберга.[8] Когда температура снижается настолько, что степень неопределенности положения атомов оказывается сопоставимой с размерами группы атомов, к которой они принадлежат, вся группа начинает вести себя, как единое целое. Такое состояние вещества называется конденсатом Бозе—Эйнштейна, и его можно считать пятым агрегатным состоянием вещества.[9]
Подведем итог вышесказанному.
В ходе исследования было показано, что все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном. Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой.
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.
Установлено, что газ есть агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Твердые тела характеризуются стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
В отличие от газа и твердых тех, жидкость есть агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
Список использованной литературы
1. Гуревич А. Е. и др. Физика. Химия. 5-6 классы: Методическое пособие. – М.: Дрофа, 2002. – 96 с.
2. Гуревич А. Е. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – 192 с.
3. Гуревич А. Е. и др. Физика. 8 класс: Учебник. – М.: Дрофа, 2002. – 272 с.
4. Перышкин А. В. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – 192 с.
5. Касьянов В. А. Физика. 10-11 классы: Учебник. – М.: Дрофа, 2002. – 416 с.
6. Перышкин А. В. Физика. 9 класс: Учебник. – М.: Дрофа, 2002. – 256 с.
7. Рыбьев И.А. Строительное материаловедение. – М.: Высшая школа, 2002. – 701 с.
8. Физика. 7 класс: Методическое пособие. – М.: Дрофа, 2002. – 64 с.
9. Физика композиционных материалов. В 2-х тт. Т. 1. / Под ред. Трофимова Н.Н., Кановича М.З., Карташова Э.М., Натрусова В.И., Пономаренко А.Т., Шевченко В.Г., Соколова В.И., Симонова-Емельянова И.Д. – М.: Высшая школа, 2005. – 456 с.
[1] Гуревич А. Е. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – С. 64.
[3] Перышкин А. В. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – С. 73.
[4] Рыбьев И.А. Строительное материаловедение. – М.: Высшая школа, 2002. – С. 238.
[5] Перышкин А. В. и др. Физика. 7 класс: Учебник. – М.: Дрофа, 2002. – С. 64.
[8] Физика композиционных материалов. В 2-х тт. Т. 1. / Под ред. Трофимова Н.Н., Кановича М.З., Карташова Э.М., Натрусова В.И., Пономаренко А.Т., Шевченко В.Г., Соколова В.И., Симонова-Емельянова И.Д. – М.: Высшая школа, 2005. – С. 218.
Все вещества могут существовать в трех агрегатных состояниях - твердом, жидком и газообразном . Четвертым агрегатным состоянием вещества часто считают плазму. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Агрегатное состояние зависит от физических условий, в которых находится вещество. Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии при разных условиях.
Газ - агрегатное состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя давление и температуру.
Жидкость - агрегатное состояние вещества, промежуточное между твердым и газообразным. Для нее характерна большая подвижность частиц и малое свободное пространство между ними. Это приводит к тому, что жидкости сохраняют свой объем и принимают форму сосуда. В то же время жидкость обладает рядом только ей присущих свойств, одно из которых - текучесть.
В жидкости молекулы размещаются очень близко друг к другу. Поэтому плотность жидкости гораздо больше плотности газов (при нормальном давлении). Свойства жидкости по всем направлениям одинаковы (изотропны) за исключением жидких кристаллов.
При нагревании или уменьшении плотности свойства жидкости, теплопроводность, вязкость меняются, как правило, в сторону сближения со свойствами газов.
Тепловое движение молекул жидкости состоит из сочетания коллективных колебательных движений и происходящих время от времени скачков молекул из одних положений равновесия в другие. При наличии внешней силы, сохраняющей свое направление более длительное время, чем интервалы между скачками, молекулы перемещаются в направлении этой силы, что и приводит к текучести жидкости.
Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов. Это движение вызывает колебания атомов (или ионов), из которых состоит твердое тело. Амплитуда колебаний обычно мала по сравнению с межатомными расстояниями.
Структура твердых тел многообразна, но, тем не менее, их можно разделять на кристаллы и аморфные тела.
В кристаллах атомы (или ионы) расположены в пространстве в узлах кристаллической решетки и колеблются около них. Строгая периодичность в расположении атомов приводит к сохранению порядка на больших расстояниях.
В аморфных телах атомы колеблются около хаотически расположенных точек. Свойства аморфных тел: они изотропны, не имеют постоянной температуры плавления, обладают текучестью.
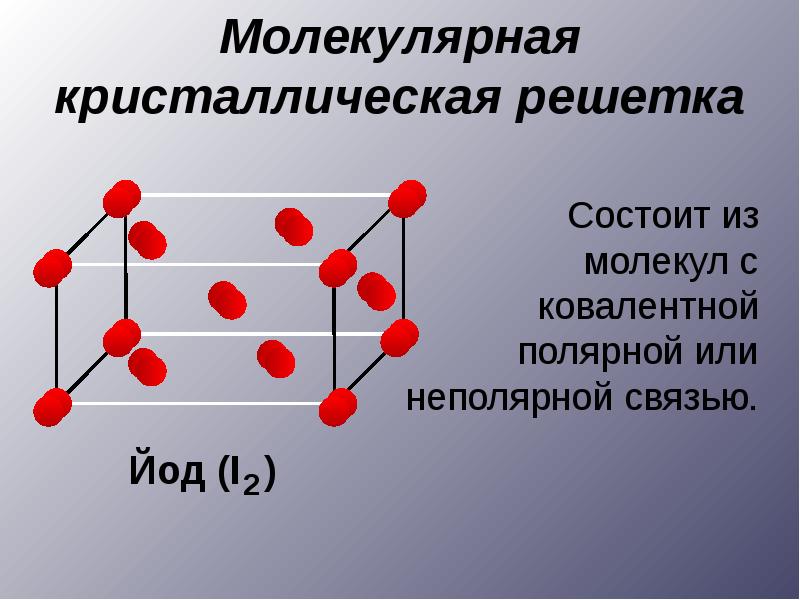
По типам химической связи твердые тела делят на три класса, каждый из которых характеризуется определенным пространственным распределением электронов: 1) ионные кристаллы (NaCl, KaCl); 2) ковалентные (алмаз, Ge, Si); 3) металлические.
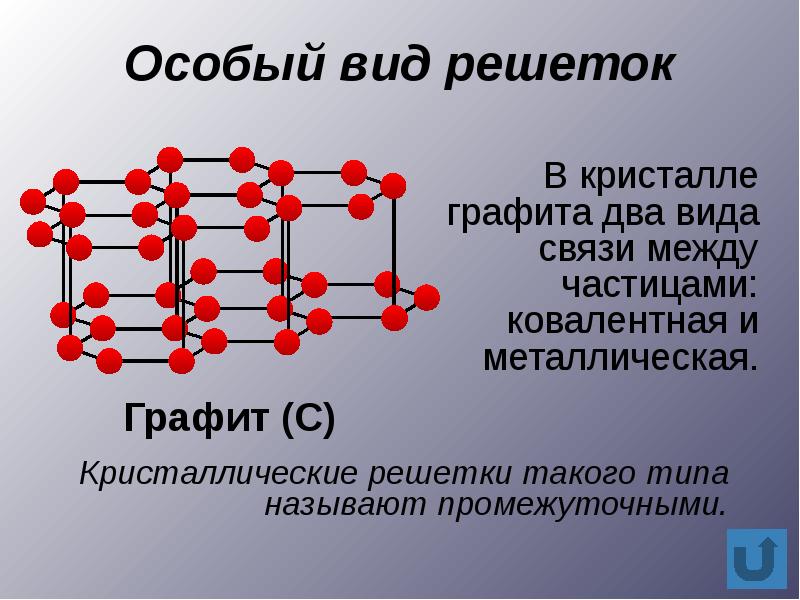
Кристаллическая структура твердых тел зависит от сил, действующих между атомами и частицами. Одни и те же атомы могут образовывать различные структуры - серое и белое олово, графит и алмаз.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной атомно-кристаллической структурой (сера, кремнезем имеют более чем две полиморфные модификации).
Одиночные кристаллы называют монокристаллами. У монокристаллов некоторые свойства анизотропны, т. е. зависят от направления (механические, оптические и электрические). Естественная анизотропия - характерная особенность кристаллов; например, пластинка слюды легко расщепляется на тонкие листочки вдоль определенной плоскости (параллельно этой плоскости силы сцепления между частицами слюды наименьшие).
Твердое тело, состоящее из большого числа маленьких кристаллов, называют поликристаллическим . Поликристаллические материалы изотропны.
Плазма - частично или полностью ионизированный газ, в котором плотности отрицательных и положительных зарядов одинаковы. При сильном нагревании любое вещество испаряется, превращается в газ. Если увеличивать температуру и далее, резко усиливается процесс термической ионизации. Молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы. В состоянии плазмы находится подавляющая часть вещества Вселенной: звезды, галактические туманности и межзвездная среда. Около Земли плазма существует в виде солнечного ветра и ионосферы. На поверхности Земли в естественных условиях плазма - редкий гость, появляющийся лишь при вспышках молний. В лабораторных условиях плазма впервые появилась в виде газового разряда. Она заполняет лампы дневного света, стеклянные трубки неоновой рекламы и т. д. За последние годы применение плазмы существенно расширилось. Высокотемпературная плазма (Т ~ 10 6 -10 8 К) из смеси дейтерия с тритием используется для осуществления управляемого термоядерного синтеза; низкотемпературная плазма (Т = 5 К) - в различных газоразрядных приборах: газовых лазерах, ионных приборах, МГД-генера-торах и так далее.
Вы можете изучить и скачать доклад-презентацию на тему Твердое состояние вещества. Презентация на заданную тему содержит 20 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!









Твердое состояние вещества- это одно из агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Твердое состояние вещества- это одно из агрегатных состояний вещества, отличающееся от других агрегатных состояний стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия.
Аморфные вещества (стекло, шоколад, смолы) Излом ограничен овальными поверхностями. При нагревании постепенно размягчаются. Нет определенной температуры плавления. Текучие: при длительном действии сравнительно небольших сил постепенно изменяют свою форму.
Кристаллическое вещество образует кристаллы совершенно определенной формы. Кристаллическая решетка –пространственный каркас, который возникает, если обозначить все частицы в кристалле в виде точек и соединить эти точки пересекающимися прямыми линиями. Узлы кристаллической решетки – точки, в которых размещены частицы.
Различают два состояния твердых веществ - кристаллическое и аморфное. Кристаллическое состояние характеризуется упорядоченной структурой. Упорядоченность в кристаллах обусловливается правильным геометрическим расположением частиц, из которых состоит твердое вещество. Каждое кристаллическое вещество имеет определенную, характерную форму. Например, кристаллы поваренной соли имеют форму куба, калийной селитры - форму призмы, алюминиевых квасцов - форму октаэдров и т. д.
Прикрепленные файлы: 1 файл
Различают два состояния твердых веществ.docx
Различают два состояния твердых веществ - кристаллическое и аморфное. Кристаллическое состояние характеризуется упорядоченной структурой. Упорядоченность в кристаллах обусловливается правильным геометрическим расположением частиц, из которых состоит твердое вещество. Каждое кристаллическое вещество имеет определенную, характерную форму. Например, кристаллы поваренной соли имеют форму куба, калийной селитры - форму призмы, алюминиевых квасцов - форму октаэдров и т. д.
Аморфные вещества не образуют правильной геометрической структуры, представляя собой структуры неупорядоченно расположенных молекул. В отличие от кристаллических веществ, имеющих вполне определенную температуру плавления, аморфные вещества плавятся в широком интервале температур. При нагревании они постепенно размягчаются, затем начинают растекаться и, наконец, становятся жидкими.
Примерами аморфных веществ могут быть стекла и смолы. К аморфным веществам относится также большинство полимеров. Некоторые вещества могут находиться и в кристаллическом, и в аморфном состояниях, - например сера, оксид кремния ( IV ) и др.
Стоит также отметить, что если свойства аморфных веществ изотропны (одинаковы по всем направлениям), то свойства кристаллов анизотропны, что особенно наглядно проявляется при исследовании таких веществ оптическими методами. Подавляющее большинство твердых веществ имеет кристаллическое строение.
Свойства твердых веществ
По сравнению с двумя другими состояниями вещества- газообразным и жидким-твердые вещества имеют наибольшую упорядоченность. Именно этой высокой упорядоченностью объясняются многие физические свойства твердых веществ.
Сжимаемость твердых веществ практически равна нулю. Все твердые вещества имеют определенный объем. Одним из наиболее известных свойств твердых веществ является их способность сохранять свою форму. По сравнению с газами и жидкостями твердые вещества могут выдерживать значительные внешние нагрузки. Плотность каждого вещества в твердом состоянии значительно больше, чем в газообразном состоянии, и несколько больше, чем в жидком. Исключение составляет вода, которая в жидком состоянии обладает большей плотностью, чем лед. Кристаллические твердые вещества имеют строго определенную температуру плавления, но аморфные твердые вещества, как, например, стекла, размягчаются в некотором интервале температур.
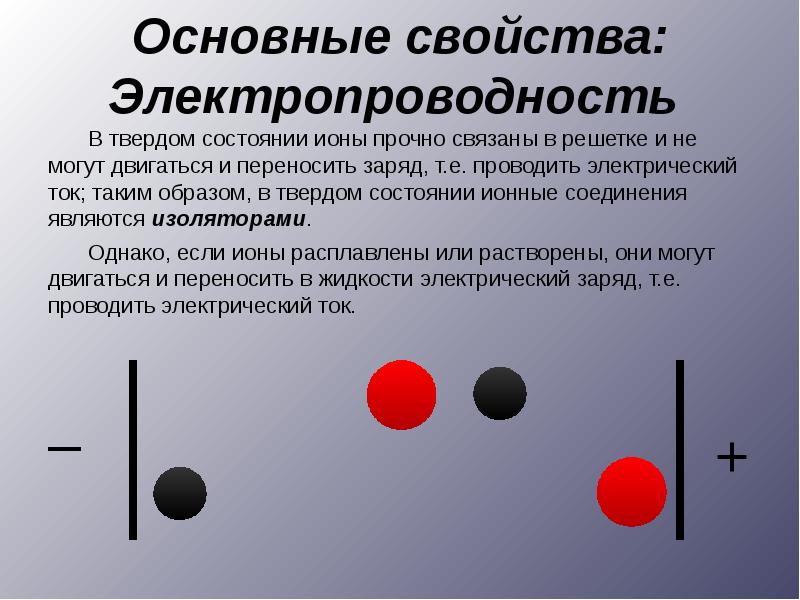
Все твердые вещества характеризуются определенным давлением пара, хотя оно, как правило, очень мало. Это особенно относится к твердым веществам ионного типа.
Все частицы (атомы, ионы либо молекулы) в кристаллической решетке твердых тел совершают колебательные движения. Иногда какая-либо частица на поверхности твердого вещества приобретает достаточную кинетическую энергию, чтобы преодолеть силы притяжения, связывающие ее в твердом веществе. Тогда она улетает с поверхности. Именно такие улетающие с поверхности частицы обусловливают давление пара над поверхностью твердых веществ.
Энтальпии плавления твердых веществ намного меньше, чем энтальпии испарения соответствующих жидкостей.
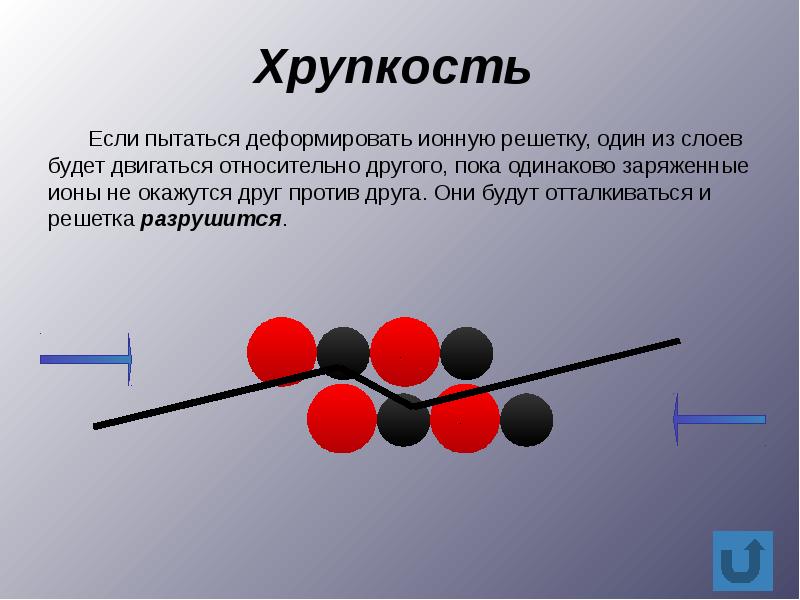
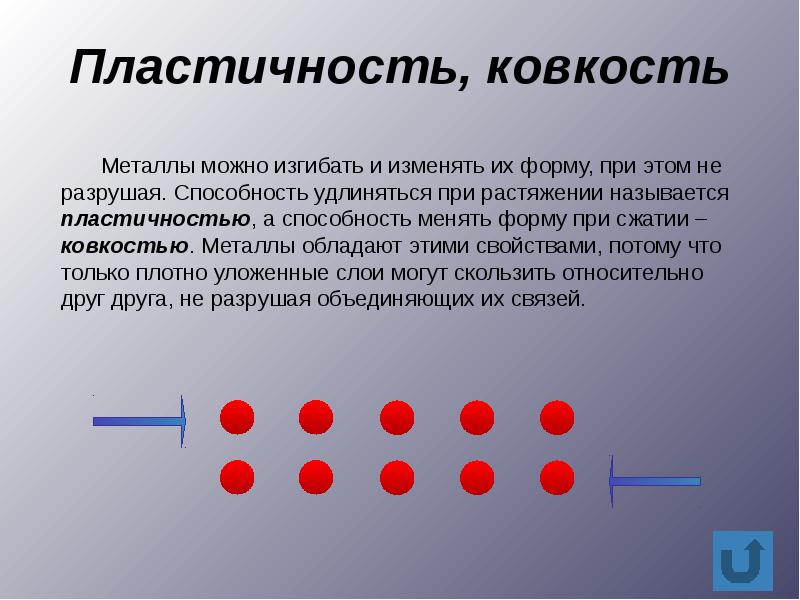
Твердые вещества могут значительно отличаться друг от друга по своим пластическим свойствам. Некоторые из них, например ионные вещества, обычно раскалываются под нагрузкой. Такое свойство называется хрупкостью. Другие, как, например, резина, являются упругими. После удаления внешней нагрузки они приобретают свою первоначальную форму. Многие металлы обладают свойствами ковкости и тягучести. Ковкий металл можно превратить ударами в тонкий лист, а тягучий металл вытянуть в тонкую проволоку.
Твердые вещества сильно различаются по способности проводить тепло и электрический ток. Все металлы обладают хорошей теплопроводностью и электропроводностью. Неметаллические вещества, как правило, являются изоляторами (диэлектриками), хотя, как мы уже упоминали, графит проводит электрический ток. Графит - пример анизотропного вещества: его свойства неодинаковы в разных направлениях. Например, графит проводит электрический ток только вдоль своих слоев. Кристаллы могут обладать и другими анизотропными свойствами. Например, их показатель преломления (света) может изменяться в зависимости от направления.
Если свойства какого-либо вещества одинаковы во всех направлениях, такое вещество называется изотропным. Кубические кристаллы изотропны, поскольку они обладают высокой симметрией.
Физические свойства твердых веществ в большой степени зависят от типа химической связи и от структуры.
Читайте также:

