Предельные одноосновные карбоновые кислоты доклад
Обновлено: 07.05.2024
Компоненты карбоксильной группы имеют следующие названия:

Кислотные радикалы RCO- (ацилы) имеют следующие названия:
| радикал муравьиной кислоты | формил | HCO- |
| радикал уксусной кислоты | ацетил | CH3 CO- |
| радикал пропионовой кислоты | пропионил | CH3 CH2 CO- |
| радикал масляной кислоты | бутирил | CH3 CH2 CH2 CO- |
| радикал валериановой кислоты | валерил | CH3 CH2 CH2 CH2 CO- |
Промышленные способы получения карбоновых кислот
1. Окисление углеводородов
Имеются два направления: окисление низших алканов С4 -С8 преимущественно в уксусную кислоту и окисление твердого парафина в так называемые синтетические жирные кислоты (СЖК) с прямой цепью углеродных атомов С10 -С20 , являющихся сырьем для синтеза ПАВ.
Процесс протекает в жидкой фазе - термически или в присутствии катализаторов. При окислении алканов происходит деструкция по связям между вторичными углеродными атомами, поэтому из н-бутана образуется главным образом уксусная кислота, а в качестве побочных продуктов - метилэтилкетон и этилацетат.
2. Синтезы на основе оксида углерода
Карбоновые кислоты получают на основе оксида углерода реакциями карбоксилирования и карбонилирования:
Присоединение водорода и карбоксильной группы по двойной связи при кислотном катализе всегда протекает по правилу Марковникова, вследствие этого только из этилена получается неразветвленная кислота, а из его гомологов - a-метилзамещенные кислоты. Особый интерес данный метод представляет для синтеза третичных кислот (неокислот) из изоолефинов (реакция Коха):
изобутилен триметилуксусная кислота
Механизм реакции состоит в предварительном протонировании алкена кислотой с образованием иона карбония, его взаимодействия с СО с получением ацилий-катиона и реакции последнего с водой с образованием карбоновой кислоты:
RCH=CH2 + H + « RC + HCH3 + CO « RCH(CH3 )C + O + H2 O « RCH(CH3 )COOH + H +
Неокислоты и их соли обладают очень высокой растворимостью и вязкостью, а их сложные эфиры - стабильностью к гидролизу, что обеспечивает им широкое применение в ряде отраслей.
Карбонилирование спиртов катализируется комплексами металлов (Ni, Co, Fe, Pd). Процесс реализован в промышленности для синтеза уксусной кислоты из метанола и характеризуется высокими экономическими показателями.
Кислоты также получают окислением альдегидов (продукт оксосинтеза).
Лабораторные способы получения карбоновых кислот
1. Окисление первичных спиртов см. Лекцию№21
2. Окисление альдегидов и кетонов
Альдегиды окисляются значительно легче, чем кетоны. Кроме того, окисление альдегидов приводит к образованию кислот с тем же числом углеродных атомов, в то время как окисление кетонов протекает с разрывом углерод-углеродных связей (образуются две кислоты или кислота и кетон):
Окислителями служат перманганат калия или бихромат. Окисление кетонов требует более жестких условий, чем альдегиды.
3. Гидролиз нитрилов
Нитрилы получают взаимодействием галогеналканов с цианистым калием, а затем подвергают их гидролизу водными растворами кислот или щелочей. В кислой среде азот выделяется в виде соли аммония:
в щелочной - в виде гидроксида аммония, кислота же получается в виде соли:
RCºN + - OH®RC(OH)=N- + H2 O® -OH + RC(OH)NH«RCONH2 + NaOH®RCOONa + NH3
4. Синтез Гриньяра
При взаимодействии магнийорганических соединений с диоксидом углерода образуются соли карбоновых кислот:
Под действием сильной кислоты (обычно HCl) соль превращается в кислоту:
CH3 CH2 COO - Mg + Br + HCl ® CH3 CH2 COOH + MgBrCl
5. Гидролиз жиров
Жиры и масла - сложные эфиры глицерина и высших жирных кислот. Как все сложные эфиры, жиры могут быть подвергнуты гидролизу (омылению) действием водных растворов щелочей, минеральных кислот или водяным горячим паром под давлением
химические свойства

Межмолекулярные водородные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии значительная часть молекул существует в виде димеров:

С ростом углеводородной цепи способность кислот к образованию водородных связей уменьшается.
Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты, из-за стабилизации карбоксилат-аниона, вызванной делокализацией p-электронов. Другими словами, карбоксилат-ион стабилизирован вследствие резонанса:

Степень делокализации изменяется в ряду RCOO - >>RCOOH >> ROH, RO - .

RO - + + BH

Энергия

RO-H + B
RO-H + :B « RO - + + BH

координата реакции
 |
Энергия
 |
 |

RCOOH + :B«RCOO - + + BH
Энергия а - стабилизация, вызванная делокализацией в RCOOH; b - стабилизация, обусловленная делокализацией в RCO - ; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу кислотности (называемую также константой диссоциации) Ка или через рКа :

Константы кислотности большинства карбоновых кислот составляют около 10 -5 (например, для уксусной кислоты 1,8×10 -5 ), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-ион. К таким заместителям относятся галогены и прочие электроотрицательные группы. Влияние заместителей на кислотность показано в Таблице.
| Кислота | рКа |
| CH3 COOH | 4,8 |
| ClCH2 COOH | 2,9 |
| Cl2 CHCOOH | 1,3 |
| Cl3 CCOOH | 0,7 |
| FCH2 COOH | 2,6 |
| CH3 CH2 CH2 COOH | 4,8 |
| F3 CCOOH | 0,2 |
1. Образование солей
Органические кислоты образуют соли с металлами, их оксидами, карбонатами, гидрокарбонатами и щелочами, например:
2. Образование галогенангидридов
Под действием галогенидов фосфора карбоновые кислоты образуют ангидриды (гидроксил замещается на галоген):
Хлорангидриды могут также быть получены действием на карбоновые кислоты тионилхлорида:
3. Восстановление
Карбоновые кислоты можно восстановить только с помощью очень сильных восстановителей, поэтому в качестве продуктов реакции всегда образуются первичные спирты (а не альдегиды):
4. Декарбоксилирование
Карбоновые кислоты очень легко теряют диоксид углерода. Как правило, при этом образуется углеводород. Алифатические карбоновые кислоты декарбоксилируют в присутствии различных катализаторов, содержащих медь. CH3 CH2 COOH®CH3 CH3 + CO2 .
К реакциям декарбоксилирования относится и синтез Кольбе (см. Лекцию №2).
5. Этерификация
В присутствии сильной кислоты (например, серной) карбоновые кислоты дают со спиртами сложные эфиры:
В результате реакции образуется равновесная смесь. Чтобы сместить равновесие в сторону образования продукта, используют большой избыток спирта или удаляют воду по мере ее образования.
Механизм этерификации представляет собой реакцию присоединения – отщепления (нуклеофильное ацильное замещение) Протон, являющийся катализатором, облегчает атаку карбонильной группы нуклеофилом:

Отдельные представители
Муравьиная кислота. Получают из ее натриевой соли (формиата), которая образуется при пропускании оксида углерода через 25-30% раствор щелочи:
Суспензию формиата натрия затем разлагают муравьиной кислотой.
Муравьиная кислота применяется для приготовления катализаторов, в медицине и в ряде синтезов. Из ее производных наибольшее значение имеет N,N-диметилформамид HCON(CH3 )2 . Он является селективным растворителем при выделении ацетилена из газовых смесей и при абсорбции HCl, SO2 , CO2 и некоторых других газов.
Муравьиная кислота обладает многими химическими свойствами кислот, но ей присущи и некоторые специфические особенности:
1. является хорошим восстановителем (легко окисляется):
HCOOH + HgCl2 ®Hg + CO2 + 2 HCl
Восстановительные свойства муравьиной кислоты объясняются тем, что она в одно и то же время является кислотой и оксиальдегидом, что видно из ее формулы.
2. при нагревании с концентрированной H2 SO4 распадается с образованием воды и СО:
3. соли щелочных металлов при сплавлении распадаются с образованием солей щавелевой кислоты (оксалаты):
2 HCOONa®H2 + NaOOC-COONa
Уксусная кислота. Широко применяется для получения сложных эфиров, уксусного ангидрида, винилацетата, а также в производстве красителей, лекарственных и душистых веществ. Большое практическое значение имеют и соли уксусной кислоты - натрия, алюминия, хрома, железа, меди, свинца и др. В промышленности уксусная кислота получается рядом способов:
Низшие жирные кислоты – это легкоподвижные с резким запахом жидкости, средние члены – масла с неприятным прогорклым запахом, высшие – твердые кристаллические вещества без запаха.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях, с ростом молекулярной массы растворимость быстро уменьшается, для высших членов гомологического ряда она равна нулю.
Температуры кипения и плавления увеличиваются с ростом числа атомов углерода, но не равномерно. Кислоты с четным числом атомов углерода имеют более высокие температуры плавления, по сравнению со следующими за ними кислотами с нечетным числом атомов углерода. Жирные кислоты имеют два ряда температур плавления – один ряд охватывает кислоты с четным числом атомов углерода, другой – с нечетным. В обоих рядах разности температур плавления двух соседних кислот постепенно уменьшаются (см. табл.)

Такое своеобразное различие между карбоновыми кислотами с четным и нечетным числом атомов углерода отчасти проявляется и в химических и биологических свойствах.
Карбоновые кислоты сильно ассоциированы и показывают вдвое больший молекулярный вес, чем это следует из их простой молекулярной формулы даже при температурах, выше их температур кипения.
Как и у спиртов ассоциация обусловлена наличием ОН-группы, водородный атом которой связывается водородной связью с атомом кислорода другой молекулы кислоты.
Получение карбоновых кислот
- Присоединение натрий алкилов к двуокиси углерода:
- Присоединение алкилмагниевых солей (реактив Греньяра) к двуокиси углерода:
- Способ Реппе. Нагревание олефинов, окиси углерода и воды в присутствии катализатора Ni(CO)4 при 200 атм и 270°С:
- Окисление первичных спиртов и альдегидов кислородом воздуха в присутствии катализаторов или хромовой кислотой, KМnО4и K2Сr2О7:

- Окисление парафинов – промышленный способ:
RCH2CH2R’ + 5/2O2 = RCOOH + R’COOH + H2O
Окисление осуществляют при катализе реакции солями кобальта или марганца.
R-COOR`+ КОН →R-COOK+R`OH
R-COOK + HCl → R-COOH + KCl

- Гидролиз галоидных алкилов осуществляют основанием или водой при катализе апротонными кислотами, например, FeCl3
- Гидролиз ангидридов карбоновых кислот:
- Гидролиз галогенангидридов карбоновых кислот:
RCOHal + H2O = RCOOH + HHal
- Метод Арндта и Эйстерта основан на взаимодействии хлорангидрида кислоты с диазометаном. Образующийся диазокетон обрабатывают водой в присутствии серебра, платины или меди:
Химические свойства одноосновных насыщенных карбоновых кислот
Одноосновные карбоновые кислоты обладают высокой реакционной способностью, причем в молекуле кислоты присутствуют одновременно несколько реакционных центров:
- О-Н-Кислотный центр. За счет подвижного водорода ОН группы характерно проявление кислотных свойств.
- Электрофильный центр – атом углерода карбоксильной группы. Благодаря этому центру кислоты и их производные вступают в реакции нуклеофильного замещения.
- Основный центр – оксогруппа (карбонильная группа), имеющая пару электронов. Способна к протонированию (присоединению водорода), в реакциях нуклеофильного замещения.
- С-Н – кислотный центр – возникает в алкильном радикале у α-углеродного атома благодаря индуктивному эффекту карбоксильной группы. При этом возникает возможность реакции конденсации, а также замещения водорода при этом центре.

I. Реакции с разрывом в карбоксильной группе связи O─H
- Диссоциация кислот в водных растворах происходит с отщеплением водорода:
R-COOH ↔ R-COO − + Н +
Карбоновые кислоты в водных растворах частично подвергаются электролитической диссоциации, которая по сравнению с минеральными кислотами незначительна. Все органические кислоты являются слабыми, тем не менее, они имеют свойственные минеральным кислотам химические свойства. Самая сильная среди одноосновных кислот – муравьиная (Н-СООН).
Заместители в молекуле кислоты способствуют возникновению индукционного эффекта, вследствие чего кислотность кислоты, а значит и ее сила уменьшается или растет в зависимости от природы заместителя. Так, электронодонорые заместители (например, алкильные заместители) понижают кислотность (силу) кислот, а электроноакцепторные (например, Cl, Вr, I) – увеличивают кислотность (силу) кислот.

Водные растворы карбоновых кислот изменяют окраску индикаторов.
- Образование солей карбоновых кислот
а) Взаимодействие кислот с металлами, стоящими в ряду напряжения металлов до водорода, приводит к образованию соли и выделению водорода:

б) Взаимодействие кислот с основными и амфотерными оксидами приводит к образованию соли и воды:
в) Реакция нейтрализации — взаимодействие кислот с щелочами, нерастворимыми основаниями и амфотерными гидроксидами к образованию соли и воды:
г) Взаимодействие кислот с аммиаком NH3 и гидроксидом аммония NH4OH:
Н–СООН + NH3 → Н–СООNH4 (формиат аммония)
г) Взаимодействие кислот с солями, образованными более слабыми или летучими кислотами:

II. Реакции, протекающие с разрывом C─O связи (замещение OH-группы)
Гидроксильная группа карбоновых кислот очень реакционноспособна и может замещаться многими атомными группами или отдельными атомами, например, Сl, SH, NH2, NHNH2, N3, NHOH
- Реакция этерификации — взаимодействие кислот со спиртами с образованием сложных эфиров:

Механизм реакции этерификации:

- Взаимодействие с аммиаком с образованием амидов кислот. На первой стадии реакции образуется аммониевая соль, на второй стадии при нагревании соли происходит отщепление воды и образование амида кислоты:

- Взаимодействие с галогенирующими агентами. Чаще всего используют хлорсодержащие соединения (галогениды фосфора — PCl3, PCl5, тионилхлорид — SO2Cl):

- Межмолекулярная дегидратация. Реакция протекает под действием температуры, в присутствии водоотнимающего агента – Р2О5 с образованием ангидридов кислот:
Исключением является муравьиная кислота межмолекулярная дегидратация которой приводит к образованию окиси углерода СО:

III. Реакции с разрывом связей C─H у α-углеродного атома углеводородного радикала
Реакции замещения. В молекуле карбоновой кислоты атомы водорода при втором атоме углерода (α-углеродного атома) являются наиболее подвижными по сравнению с другими водородными атомами. Поэтому они способны замещаться, например, на атом галогена в присутствии красного фосфора с образованием α-галогенкарбоновых кислот:

IV. Восстановление карбоновых кислот
Карбоксильная группа восстанавливается с большим трудом. Чтобы восстановить ее до метильной группы, требуется длительное нагревание с концентрированной йодистоводородной кислотой и фосфором и даже в этом случае восстановление протекает не до конца. Прямое восстановление карбоновых кислот водородом достигается применением высоких давлений и температур в присутствии катализаторов (Cu, Co, Zn-Cr-Cu-Cd катализатор) по способу Шраута-Нормана. Этот способ используют в промышленности для получения из высших жирных кислот первичных спиртов, которые используют в получении моющих средств. Наиболее легко восстановление кислот происходит с помощью алюмогидрида лития (LiAlH4) или диборана (B2H6):

V. Окисление (горение) карбоновых кислот.
Карбоновые кислоты, в отличие от альдегидов, довольно устойчивы к действию окислителей. И только муравьиная кислота, благодаря особенностям своего строения может окисляться до углекислого газа.
Однако все кислоты могут гореть в кислороде (жесткое окисление), образуя углекислый газ (СО2) и воду:

VI Декарбоксилирование карбоновых кислот
- Одноосновные карбоновые кислоты довольно устойчивы, отщепление их карбоксильной группы в виде СО2 происходит при высокой температуре:

- Наличие в молекуле кислоты электроноакцепторных заместителей в α-положении облегчает процесс декарбоксилирования:

- При сплавлении натриевых солей карбоновых кислот с NaOH, также происходит декарбоксилирование:

- Синтез Кольбе. При электролизе растворов или расплавов карбоновых кислот или их солей происходит декарбоксилирование с образованием алканов:

Отличительные свойства муравьиной кислоты
В молекуле метановой (муравьиной) кислоты сочетаются две группы – карбонильная и карбоксильная. Поэтому наряду со всеми свойствами кислот она обладает свойствами альдегидов:

Среди различных классов органических соединений широко распространены в природе и играют важнейшую роль в жизнедеятельности растений и животных33633-карбоновые кислоты. Карбоновые кислоты -органические соединения, содержащие одну или несколько карбоксильных групп -СООН. Название происходит от лат. carbo - уголь и греч. oxys - кислый. По числу -COOH этих групп различают моно-, ди, три- и тетракарбоновые кислоты (большее число групп -СООН в одной молекуле встречается редко). Карбоновые кислоты могут быть алифатическими - с нормальной и разветвленной цепью, циклическими и ароматическими, предельными и непредельными, содержать атомы галогенов и различные функциональные группы: ОН (оксикислоты), NH2 (аминокислоты), СО (кетокислоты) и т.д. Многие карбоновые кислоты в свободном состоянии, а также в виде различных производных (солей, эфиров) широко распространены в природе.
Актуальность темы курсовой работы: Карбоновые кислоты распространены в природе, очень разнообразны и находят широкое применение, поэтому их изучение важно и интересно с теоретической и практической точек зрения.
Цель курсовой работы: Изучить строение и свойства одноосновных карбоновых кислот.
Задачи:
изучить строение, номенклатуру, получение и свойства предельныx одноосновные карбоновых кислот;
изучить структуру, номенклатуру, способы синтеза и применение ненасыщенных одноосновных карбоновых кислот;
изучить строение, номенклатуру, получение и свойства ароматических одноосновные карбоновых кислот;
определить константы диссоциации уксусной, муравьиной и пропионовой кислот методом pH-метрии;
Глава 1. Предельные одноосновные карбоновые кислоты
Строение и номенклатура предельных карбоновых кислот
-органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Карбоксильная группа содержит две функциональные группы - карбо-нил >С=О и гидроксил -OH, непосредственно связанные друг с другом:
Классификация карбоновых кислот
Карбоновые кислоты классифицируют по двум структурным признакам.
1. По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые). Например:
Н-СООН (муравьиная кислота
многоосновные (дикарбоновые, трикарбоновые и т.д.).
HOOC-CH2-COOH (малоновая кислота)
2. По характеру углеводородного радикала различают кислоты:
предельные ((насыщенные),например, CH3CH2CH2COOH – бутановая кислота);
непредельные ((ненасыщенные),например, CH2=CHCH2COOH – 3-бутеновая кислота);
ароматические ((производные ароматических УВ),RC6H4COOH, например, C6H5COOH – бензойная кислота).
Насыщенные монокарбоновые кислоты
Наибольшее значение имеют насыщенные монокарбоновые кислоты. Общая формула насыщенных монокарбоновых кислот:
Важнейшие представители гомологического ряда этих кислот представлены в табл.1.В этой таблице приведены названия кислот RCOOH и кислотных остатков RCOO-.
В структуре карбоновых кислот часто выделяют также кислотные радикалы
Названия некоторых ацилов.
Номенклатура
По международной заместительной номенклатуре название кислоты производят от названия соответствующего(с тем же числом атомов углерода) углеводорода с добавлением окончания –овая и слова кислота. Нумерацию цепи всегда начинают с атома углерода карбоксильной группы,поэтому в названиях положение группы-СООН не указывают.
При составлении названий кислот, имеющих сложное строение, иногда также используют тривиальные названия кислот, соответствующие наиболее длинной прямой цепи .В этом случае атомы углерода в прямой цепи обозначают греческими буквами, начиная с атома углерода, соседнего с карбоксильной группой: альфа, бета, гамма, дельта и . т . д .,например:
1.2. Получение предельных карбоновых кислот
1. Окисление первичных спиртов и альдегидов.
В промышленном масштабе окисление ведут кислородом воздуха при катализе солями марганца или кобальта
В лаборатории окисление осуществляют неорганическими окислителями: KMnO4 в кислой или нейтральной среде, K2Cr2O7 в кислой среде.
2. Окисление неразветвленных алкенов
Окислителями являются K2Cr2O7 в кислой среде или KMnO4 в кислой среде.
3. Окисление алкинов.
В качестве окислителей используют те же реагенты, что и при окислении алкенов.
4.Окисление алканов (промышленный метод)
Окисление осуществляют при катализе реакции солями кобальта или марганца.
5. Гидролитические методы.
а) Кислотный гидролиз нитрилов
RC≡ N + 2H2O + HX RCOOH + NH4X
б) Основной гидролиз нитрилов
RC≡N + H2O + NaOH RCOONa + NH3
в) Кислотный гидролиз амидов кислот
г) Основной гидролиз амидов кислот
д) Кислотный гидролиз сложных эфиров
е) Основной гидролиз сложных эфиров
RCOOR' + NaOH RCOONa + R'OH
ж) Гидролиз ангидридов карбоновых кислот
з) Гидролиз галогенангидридов карбоновых кислот
RCOHal + H2O RCOOH + HHal
и) Гидролиз соединений, содержащих трихлорметильную группу
Гидролиз осуществляет либо основанием, либо водой при катализе апротонными кислотами, например, FeCl3.
6. Металлоорганический синтез.
7. Реакции карбонилирования
8. Синтез Арндта-Эйстерта
Промежуточным продуктом является диазокетон.
Эта реакция представляет собой удобный способ превращения карбоновой кислоты RCOOH в ее ближайший гомолог RCH2COOH.
Технически важную муравьиную и уксусную кислоты получают следующими способами.
Муравьиная кислота и ее эфиры:
1.3. Свойства и применение предельных карбоновых кислот
1.3.1. Физические и химические свойства
Физические свойства предельных одноосновных карбоновых кислот.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырёх атомов углерода, — жидкости с характерным резким запахом. Кислоты, содержащие от 4 до 9 атомов углерода, — вязкие маслянистые жидкости с неприятным запахом. Кислоты, состоящие из 9 атомов углерода и более, — твёрдые вещества, которые не растворяются в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы (см. табл.2).
Простейшая карбоновая кислота — муравьиная НСООН, имея небольшую относительную молекулярную массу (Мr(НСООН) = 46), при обычных условиях является жидкостью с температурой кипения 100,8 °С. В то же время бутан (Мr(С4Н10) = 58) в тех же условиях газ и имеет температуру кипения - 0,5 °С. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил
и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи.
Муравьиная и уксусная кислоты растворимы в воде неограниченно. С увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Физические свойства карбоновых кислот
Насыщенные монокарбоновые кислоты представляют собой бесцветные жидкие или кристаллические вещества с острым своеобразным запахом, высшие карбоновые кислоты (С15 – С18) имеют слабый запах стеарина. Они имеют весьма высокие температуры кипения, что свидетельствует о значительной межмолекулярной ассоциации следствие образования межмолекулярных водородных связей, причем образуются как циклические димеры, так и линейные олигомеры.
Электронографическое изучение карбоновых кислот показало, что в их молекуле имеются карбонильная и гидроксильная группа, при этом связь С = О длиннее, чем в кетонах, а связь С – О короче, чем в спиртах. Это свидетельствует о сопряжении неподеленной пары кислорода гидроксильной группы и орбиталей карбонильной группы
Проявляя +М – эффект, атом кислорода гидроксильной группы увеличивает полярность связей ОН, но в то же время в некоторой степени уменьшает положительный заряд на углеродном атоме по сравнению альдегидами и кетонами. Одновременно действует электроноакцепторный индуктивный эффект (-I) кислородных атомов.
Таким образом в карбоксильной группе имеется сильно поляризованный положительно атом водорода гидроксильной группы и углеродный атом которые являются нуклеофильными центрами. В то же время кислородный атом имеет нуклеофильный характер.
Химические свойства предельных одноосновных карбоновых кислот
Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов:
1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация.
2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер.
4.Реакции по С -углеродному атому алкильной группы.
Кислотность карбоновых кислот
Кислотность карбоновых кислот характеризуется константой кислотности Ка или показателем рКа. Их значения обычно составляет приблизительно 10 -5 , что свидетельствует о слабости этих кислот. Присутствие в структуре радикала электроноакцепторных заместителей будет стабилизировать карбоксилат анион, что приведет к увеличению кислотности соответствующей ему кислоты. Например: рКа монохлоруксусной кислоты составляет 2,9 а уксусной – 4,8. По мере удаления электроноакцепторного заместителя от карбоксильной группы кислотность снижается, что связано с быстрым затуханием индуктивного эфекта: так рКа -хлорпропионовой кислоты составляет ~4,0. Наоборот, увеличение разветвления алкильного радикала приводит к снижению кислотности, так как при этом возрастает индуктивный эффект алкильной группы. На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.
Кислотность карбоновых кислот проявляется в их взаимодействии с активными металлами и основаниями.
2RCOOH + 2Na 2RCOONa + H2
RCOOH + NaOH RCOONa + H2O

Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами .

Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.

Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
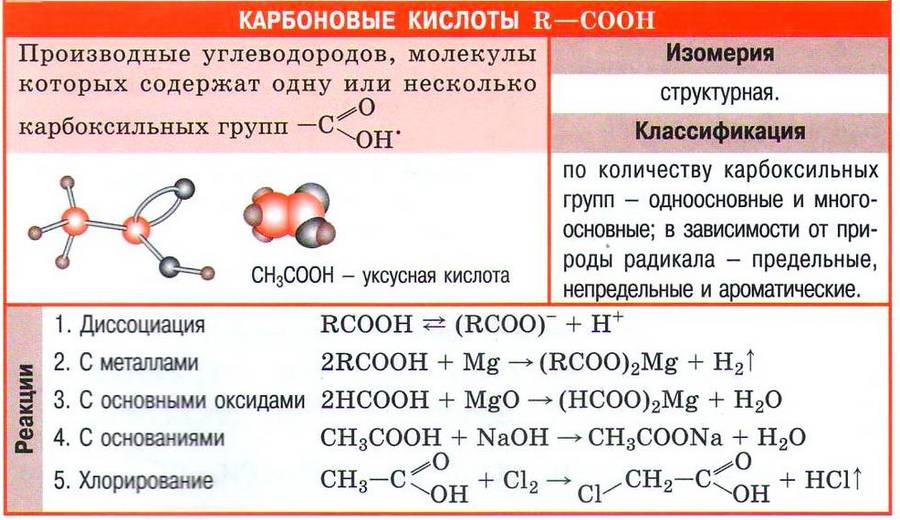
Химические свойства карбоновых кислот

Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.

Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:

Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:

При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:

Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.

Читайте также:

