Оксид серы серная кислота доклад
Обновлено: 25.06.2024
Способы получения
Оксид серы (VI) получают в реакциях окисления:
Разложением сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид – типичным кислотный оксид, взаимодействует с щелочами и основными оксидами.
3. Серный ангидрид – очень сильный окислитель:
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO 3 в H 2 SO 4
РЕАКЦИИ СЕРНОЙ КИСЛОТЫ
Химические свойства разбавленной серной кислоты
H 2 SO 4 - сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
1) Диссоциация протекает ступенчато:
(первая ступень, образуется гидросульфат – ион)
(вторая ступень, образуется сульфат – ион)
H 2 SO 4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + 2H + → Zn 2+ + H 2 0 ↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + 2H + → Cu 2+ + H 2 O
4) Взаимодействие с основаниями:
Если кислота в избытке, то образуется кислая соль:
2H + + Cu(OH) 2 → Cu 2+ + 2H 2 O
5) Обменные реакции с солями:
Серная кислота – сильная нелетучая кислота, вытесняет из солей другие менее сильные кислоты:
Качественная реакция на сульфат-ион
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
6) Реагирует с аммиаком
Химические свойства концентрированной серной кислоты
1. С водой образуются гидраты:
H 2 SO 4 + nH 2 O = H 2 SO 4 ·nH 2 O + Q
Органические вещества обугливаются!
2. Серная кислота окисляет неметаллы
неМе + H 2 SO 4 (конц.) = H 2 O + SO 2 + Кислотный гидроксид
, где степень окисления неметалла – высшая
3. Взаимодействие серной кислоты с металлами
H 2 SO 4 (конц.) + Me = t = соль + H 2 O + Х
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO 2 . С активными металлами может восстанавливаться до серы S, или сероводорода Н 2 S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании образуется газа SO 2 :
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии со щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
4. Взаимодействие с восстановителями
Концентрированная серная кислота окисляет галогеноводороды и сероводород при комнатной температуре:
СОЛИ СЕРНОЙ КИСЛОТЫ
1) Разложение сульфатов
Термически устойчивые сульфаты – сульфаты щелочных металлов (в том числе лития), они плавятся не разлагаясь
Остальные сульфаты при нагревании разлагаются на оксид серы(IV), оксид металла и кислород:
Следует быть осторожнее с сульфатами железа (II) и хрома (II) , эти металлы при наличии окислителя склонны окисляться до степени окисления +3, а тут как раз выделяется кислород:
Так как оксиды тяжёлых и благородных металлов разлагаются сами, разложение их сульфатов следует записывать до металла:
2) Сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями, восстанавливаясь до сульфидов.
CaSO 4 + 4C = CaS + 4CO
3) Многие средние сульфаты образуют устойчивые кристаллогидраты
Na 2 SO 4 ∙ 10H 2 O − глауберова соль
CuSO 4 ∙ 5H 2 O − медный купорос
FeSO 4 ∙ 7H 2 O − железный купорос
ZnSO 4 ∙ 7H 2 O − цинковый купорос
Na 2 CO 3 ∙ 10H 2 O − кристаллическая сода
Ключевые слова конспекта: соединения серы, серная кислота, участие в кислотно-основных и окислительно-восстановительных взаимодействиях, получение и применение серной кислоты.

Серная кислота H2SO4 – вещество молекулярного строения. Её графическая формула:
В серной кислоте сера находится в высшей степени окисления +6.
Серная кислота представляет собой бесцветную маслянистую жидкость, хорошо растворимую в воде. Смешивается с водой в неограниченном количестве и очень гигроскопична. При растворении верной кислоты в воде выделяется значительное количество теплоты.
Химические свойства серной кислоты можно рассмотреть с точки зрения кислотно-основных и окислительно-восстановительных взаимодействий.
Участие в кислотно-основных взаимодействиях
- Серная кислота – сильный электролит, в водных растворах диссоциирует практически полностью:

Изменяет окраску индикатора (например, лакмуса с фиолетовой на красную).
Более корректно электролитическая диссоциация H2SO4 описывается уравнениями:

- Серная кислота реагирует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
2Н + + CuO = Cu 2+ + H2O
- Серная кислoта реагирует с основаниями и амфотерными гидроксидами:
H2SO4 + Cu(OH)2 = CuSO4 + 2H20
2Н + + Cu(OH)2 = Cu 2+ + 2H20
- Сернaя кислота вытесняет более слабые кислоты из их солей:

- Сeрная кислота вытесняет и сильные, но летучие кислоты из их солей:

Участие в окислительно-восстановительных взаимодействиях

Разбавленные растворы H2SO4 реагируют с металлами, расположенными в электрохимическом ряду напряжений металлов до H2, с образованием сульфатов и выделением водорода:
Чистая H2SO4 и H2SO4 в концентрированных растворах проявляют сильные окислительные свойства за счёт S +6 .
Концентрированная H2SO4 взаимодействует с металлами (в том числе с Cu, Ag, Hg), стоящими после H2 в ряду напряжений металлов, с образованием сульфатов, воды и продуктов восстановления S +6 : H2S, S, SO2. Концентрированная серная кислота не реагирует с благородными металлами вследствие их малой активности, а также с Al, Cr, Fe из-за пассивации. На поверхности этих металлов образуется защитная оксидная плёнка, защищающая их от дальнейшего окисления.

Глубина восстановления зависит от восстановительных свойств металлов.
Активные металлы восстанавливают H2SO4 до H2S:

Металлы с меньшей активностью восстанавливают H2SO4 до SO2:

Концентрированная сeрная кислoта окисляет и некоторые неметаллы. Например:

Важной химической особенностью серной кислоты является её способность выступать в качестве дегидратирующего реагента. Концентрированная серная кислота вступает в реакции дегидратации со многими органическими веществами, отщепляя от них молекулы воды. Например:
Получение и применение серной кислоты
Промышленное получение серной кислоты включает несколько стадий. Сырьём является сера S и сульфидные руды (в основном пирит FeS2).
В ходе получения серной кислоты из пирита осуществляются три химические реакции:
- Обжиг пирита (проводится при температуре около 800 °С):

Эта реакция – обратимая, экзотермическая, каталитическая (её проводят в присутствии катализатора V2O5 при температуре около 450 °С).
Оксид серы (VI) (серный ангидрид) SO3 при обычных условиях – летучая жидкость (t°кип. = 44,8 °С), неограниченно растворяется в воде. Оксид серы (VI) SO3 – кислотный оксид, ему соответствует сильная серная кислота.
В промышленности для этой реакции используют концентрированную H2SO4, образуется олеум H2SO4 • SO3, при разбавлении которого получают концентрированную H2SO4.
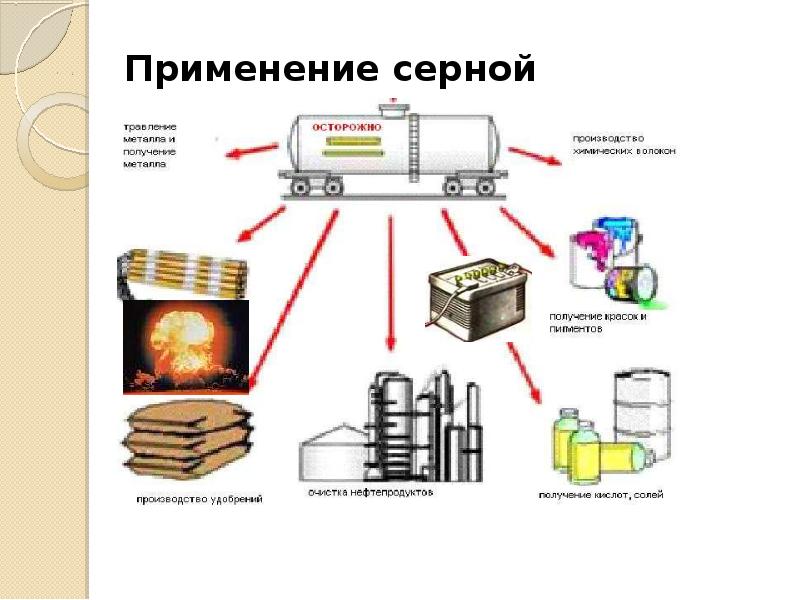
Серная кислота – один из важнейших продуктов химической промышленности. Важнейшие области её применения: производство минеральных удобрений, других кислот и солей, красителей, пластмасс, волокон, лекарственных веществ, очистка нефтепродуктов, металлургия.
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
- температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500 о С. Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5.
- давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Вы можете изучить и скачать доклад-презентацию на тему Оксид серы (VI). Серная кислота. Презентация на заданную тему содержит 12 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!
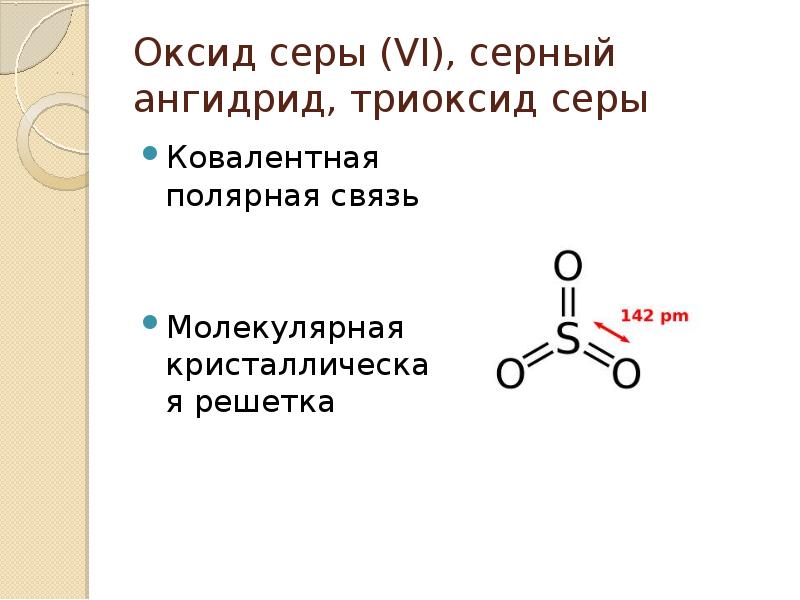









Оксид серы (VI), серный ангидрид, триоксид серы Ковалентная полярная связь Молекулярная кристаллическая решетка
Физические свойства серного ангидрида Бесцветная, летучая, маслянистая жидкость, t° пл. = 17°C; t° кип. = 45°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах
Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства кислот: С оксидами металлов.(реакция обмена) Н2SO4+MeO→MeSO4+H2O 2. С основаниями.(реакция обмена, реакция нейтрализации) Н2SO4+Me(OН)n→MeSO4+H2O 3. С металлами. Н2SO4+Me(до Н)→MeSO4(р)+H2↑(реакция замещения) 4.С солями( реакция обмена) Н2SO4+MeR(Р)→MeSO4 (Р)+HR (протекает в том случае, если образуется осадок или газ)
Качественная реакция на ион –SO42- Качественная реакция на ион –SO42- Реактивом на серную кислоту и ее соли является катион бария , т.к. с ионами бария сульфат ион образует белый нерастворимый сульфат бария, выпадающий в осадок. Ва2++SO42- = BaSO4↓
Концентрированная серная кислота Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2) Серная кислота(конц) восстанавливается до (Н2S,S,SO2) в зависимости от активности металла и условий протекания реакции. Железо и алюминий пассивируются кислотой, т.е покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах. Сu+2H2SO4(конц)→CuSO4+2H2O+SO2 4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их. Взаимодействие кислоты с сахарозой(C12H22O11) C12H22O11 + 2H2SO4(конц) = 11C + 13H2O↑ +2SO2↑ +CO2↑
Вулкан Малый Семячик Вулкан Малый Семячик Вулканический хребет длиной около 3 км., на гребне которого имеются три кратера. В южном (кратер Троицкого) на глубине 170м. находится необычное кислое озеро. Температура этого непрозрачного озера колеблется от +270С до +420С, а уровень минерализации соответствует раствору серной и соляной кислот средней концентрации. Поражают размеры озера: ширина около полукилометра, а глубина - до 140м. Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения вулкана, произошедшего незаметно для людей.
Читайте также:

