Кристаллизация доклад 7 класс
Обновлено: 02.07.2024
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*10 5 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*10 5 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm .
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
МКОУ “Табулгинская средняя общеобразовательная школа
имени П. Д. Слюсарева”
Чистоозерного района Новосибирской области
Кристаллизация веществ
Автор: Березовская Юлия,
учащаяся 11 класса
учащаяся 10 класса
Руководитель: Жарикова Светлана Семёновна.
Данная работа носит исследовательский характер и состоит из теоретической и практической частей.
Цель данной работы: исследование процесса кристаллизации и выращивание кристаллов.
Анализ научной литературы, с использованием Интернета в поисках информации.
Изучить методики процесса кристаллизации.
Выполнить опытно-экспериментальную работу по изученным методикам.
Обсудить и описать полученные результаты.
Гипотеза: некоторые кристаллы легко выращиваются в домашних условиях.
Предметная область: физика
Краткое содержание работы:
Тема кристаллизации веществ становится все более актуальной для всего человечества. В настоящее время изучением кристаллов занимается наука кристаллография. Мир кристаллов и мир людей стали неразрывны. Представления о кристаллах, их строении и свойствах развивались на протяжении нескольких веков. Узнали, что выращивание кристаллов очень интересное и увлекательное занятие. Поэтому решили исследовать процесс кристаллизации и вырастить кристаллы в домашних условиях. Работа представляет актуальное самостоятельное исследование, в котором удалось добиться решения поставленных задач и цели.
Ключевые слова: кристаллы, кристаллизация, выращивание кристаллов.
Актуальность исследования………………………………….………. 3стр.
ГЛАВА I . ОБЗОР ЛИТЕРАТУРЫ
Зачем растят кристаллы…………………………………………..…5стр.
Механизм роста кристалла………………………………………..…. 5стр.
Способы роста кристаллов…………………………………..………. 9стр.
ГЛАВА II . МЕТОДЫ И РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
2.1 Исследование №1. Наблюдение кристаллических тел….…………….10стр.
2.2 Исследование №2. Наблюдение процесса роста кристаллов из раствора………………………………………………………………..………….10стр.
2.3 Исследование №3. Выращивание затравочных кристаллов …………11стр.
3.4 Исследование №4. Выращивание монокристалла соли ……………. 11стр.
3.5 Исследование №5. Определение скорости роста кристаллов………..12стр.
3.6 Исследование №6. Измерение температуры кристаллизации вещества…………………………………………………………….……. 13стр
3.8 Исследование №8. Выращивание кристаллов на вырубленными фигурами…………………………………………………………………. 14стр.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ ……. 16 стр.
Актуальность исследования. Тема кристаллизации веществ становится все более актуальной для всего человечества. В настоящее время кристаллы буквально вошли в каждый дом. Каждый человек в своей жизни хотя бы один раз любовался красивым блеском кристаллов. В сердце каждого телевизора, сотового телефона, компьютера находится кристалл. Перечень видов применения кристаллов уже достаточно длинен и непрерывно растет. Выращивание которых сохраняет природные богатства, и ускоряет научно-технический прогресс. В настоящее время изучением кристаллов занимается наука кристаллография.
Все камни - это кристаллы! Причем не только яркие и блестящие драгоценные камни (алмазы, рубины, сапфиры), но и обычные, из которых состоят горы, скалы, ущелья и пещеры. Кристаллы красивы и разнообразны. Секрет их красоты - в симметрии. Сейчас мы знаем, что даже некоторые части нашего организма кристалличны, например, роговица глаза. Мир кристаллов и мир людей стали неразрывны.
Кристаллы завораживают своими правильными формами, большим разнообразием расцветок. Человечество с древних времен изучают их свойства. Кристаллы, как и живые существа, могут зарождаться, расти, стареть, и разрушаться. Почти любое вещество может при известных условиях дать кристаллы. Основное появление кристаллов основано на кристаллизации насыщенных и перенасыщенных растворов.
Узнали, что выращивание кристаллов очень интересное и увлекательное занятие. Поэтому решили исследовать процесс кристаллизации и вырастить кристаллы в домашних условиях. Какие методики существуют для выращивания кристаллов? На этот вопрос предстоит ответить в работе.
ЦЕЛЬ И ЗАДАЧИ
Цель: исследование процесса кристаллизации и выращивание кристаллов.
Исходя из цели сформулированы задачи :
1Анализ научной литературы, с использованием электронных ресурсов Интернета в поисках информации.
2.Изучить методики процесса кристаллизации.
3. Выполнить опытно-экспериментальную работу по изученным методикам.
4.Обсудить и описать полученные результаты.
Гипотеза: некоторые кристаллы легко выращиваются в домашних условиях.
Объект исследования: кристаллические вещества
Предмет исследования : процесс кристаллизации.
Методы исследования:
Сбор информации, её систематизация .
Анализ, оформление результатов работы.
Новизна исследования заключаетсяв представлениивыработанных рекомендаций юным
исследователям по выращиванию кристаллов в домашних условиях, которые способствуют повышению
интереса, активности и самостоятельности в опытно - экспериментальной деятельности, а
Новизна исследования заключается в представлении выработанных рекомендаций юным исследователям по выращиванию кристаллов в домашних условиях, которые способствуют повышению интереса, активности и самостоятельности в исследовательской деятельности.
Практическая значимост ь: практическое значение исследований состоит в том, что они может быть использовано на уроках окружающего мира, химии, физики, при организации исследовательской деятельности школьников.
ГЛАВА I . ОБЗОР ЛИТЕРАТУРЫ
Кристаллические тела
Кристаллы (от греч. krýstallos, первоначально — лёд, в дальнейшем — горный хрусталь, кристалл). В древности люди думали, что кристаллы горного хрусталя и кристаллы льда это одно и то же, только лёд замерзает мгновенно, а горный хрусталь при сильном морозе. И лёд становится хрусталём через тысячу лет, а хрусталь становится алмазом через тысячу веков. Поэтому кристаллы наделялись множеством таинственных свойств: исцелять болезни, влиять на судьбу человека. Представления о кристаллах, их строении и свойствах развивались на протяжении нескольких веков. Точкой отсчета истории кристаллов может быть известие о существовании изумрудов в Индии за 2 тыс. лет до н. э., алмазов за 1000-500 лет до н. э., рубинов Цейлона за 600 лет до н. э.
Кристаллы состоят из отдельных частиц: молекул и атомов, располагающихся в строгом порядке. Они и образуют кристаллическую решетку. Каждому атому отведено место в определенном узле решетки, при этом образуются правильные многогранники. Кристалл может иметь от трех до нескольких сотен граней. Но при этом они обладают замечательным свойством. Все плоские грани пересекаются друг с другом под определенными углами. Углы между соответствующими гранями всегда одинаковы. Например, у кристаллов поваренной соли (NaCl) всегда их грани пересекаются под прямым углом.
Кристаллическими называются твёрдые тела, физические свойства которых неодинаковы в различных направлениях, но совпадают в параллельных направлениях. Именно анизотропия физических свойств, а не геометрически правильная форма является важнейшим признаком кристаллического тела. Простейший пример анизотропии кристаллов – неодинаковая их прочность по разным направлениям. Это свойство наглядно проявляется при дроблении многих кристаллических тел. Кусок каменной соли при раскалывании разделился на части, ограниченные плоскими поверхностями, пересекающимися под одинаковыми углами.

Для наглядного представления внутренней структуры кристалла применяется способ его изображения с помощью пространственной кристаллической решетки - пространственной сетки, узлы которой совпадают с положением центров атомов или молекул в кристалле. В основе кристаллической решетки лежит элементарная ячейка – фигура наименьшего размера, последовательным переносом которой можно построить весь кристалл. Как правило, атом принадлежит не одной элементарной ячейке, а входит одновременно в состав нескольких соседних элементарных ячеек. На рисунке 1 примеры простых кристаллических решёток:
1 – простая кубическая; 2 – гранецентрированная кубическая; 3 – объёмно-центрированная кубическая; 4 – гексагональная
Кристаллические тела могут быть монокристаллами и поликристаллами. Большинство встречающихся в природе и получаемых в технике твердых тел представляют собой совокупность сросшихся друг с другом хаотически ориентированных маленьких кристаллов - кристаллитов. Такие тела называются поликристаллами. В отличие от монокристаллов поликристаллы изотропны, т. е. их свойства одинаковы во всех направлениях. Монокристаллом называют одиночный кристалл.
Примером образования кристаллов из пара и газа являются снежинки, иней.
1.2. Зачем растят кристаллы
Прежде всего, затем, что природные кристаллы не всегда достаточно крупны, часто они неоднородны, в них имеются нежелательные примеси. При искусственном выращивании можно получить кристаллы крупнее и чище, чем в природе.
Есть и такие кристаллы, которые в природе редки и ценятся дорого, а в технике нужны. В лабораториях выращивают большие кристаллы, необходимые для техники и науки , искусственные драгоценные камни, кристаллические материалы для точных приборов; там создают и те кристаллы, которые изучают кристаллографы, физики, химики, металловеды, минералоги, открывая в них новые замечательные явления и свойства. А самое главное – искусственно выращивая кристаллы, создают вещества, каких вообще нет в природе, множество новых веществ.
1.3 Механизм роста кристалла
Процессы роста кристаллов. Описывая строение кристаллов, пользуются их идеальными моделями. Отличие реальных кристаллов от идеальных заключается в том, что реальные кристаллы не обладают правильной кристаллической решеткой, а имеют целый ряд нарушений в расположении атомов, называемых дефектами . Знание условий образования дефектов и способов их устранения играет большую роль при использовании кристаллов на практике.

Рис.2 Схемы возникновения дефектов в кристаллах
1.4 Способы роста кристаллов
Выращивать кристаллы можно в химических и промышленных лабораториях
следующими способами: 1. Охлаждение насыщенного горячего раствора. 2. Постепенное удаление воды из насыщенного раствора. 3. Выращивание кристаллов из расплавленных веществ при медленном охлаждении жидкости. 4. Конденсация паров.
Удивительно, но выращивать кристаллы можно не только в химических и промышленных лабораториях, но и в домашних условиях. Самые популярные вещества, из которых выращивают кристаллы дома – это поваренная соль, сахар.
Существует всего два способа выращивания кристаллов в домашних условиях: 1. Путем выпаривания воды, в котором находится вещество. 2.Путем изменения температуры воды, охлаждения.
Первый из них состоит в медленном испарении растворителя из насыщенного раствора, а второй – в медленном понижении температуры раствора. Чаще применяют второй способ. В качестве растворителей используют воду, спирты, кислоты, расплавленные соли и металлы. Недостатком методов выращивания кристаллов из раствора является возможность загрязнения кристаллов частицами растворителя. Кристалл растет из тех участков пересыщенного раствора, которые его непосредственно окружают.
ГЛАВА II . МЕТОДЫ И РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для реализации поставленных в проекте задач были использована различные
методики по изучению и выращиванию кристаллических тел, разработаны рекомендации по выращиванию кристаллов в домашних условиях (приложение1).
Исследование №1. Наблюдение кристаллических тел

Приборы и материалы: набор кристаллических тел (хлорид натрия (1), сульфат меди (2), цинк (3), стекло (4), органическое стекло (5)); линза (фото1).
Результаты исследования. Рассмотрели при помощи линзы кристаллы хлорида натрия, сульфата меди, цинка, стекло, органическое стекло. Увидели, что кристаллы данных веществ имеют разную форму. Для одного и того же вещества она сохраняется. На изломе кристалла цинка порядок в расположении тоже сохранялся.
Исследование №2 . Наблюдение процесса роста кристаллов из раствора
Приборы и материалы: микроскоп, предметное стекло, стеклянная палочка, насыщенные раствор хлористого аммония (фото2).
Цель эксперимента: наблюдение процесса роста кристаллов хлористого аммония в перенасыщенном водном растворе.
Результаты исследования . Поместили на столик микроскопа предметное стекло, отрегулировали освещение и добилась четкого изображения поверхности предметного стекла. На предметное стекло нанесли с помощью стеклянной палочки каплю насыщенного раствора хлористого аммония. Поместили стекло с каплей под объектив микроскопа так, чтобы в поле зрения был виден край капли, так как первые кристаллы образуются обычно на краю капли . Наблюдали процесс роста кристаллов на предметном стекле(фото3) и в микроскопе (фото4).



Фото 2 Фото3 фото4
Исследование №3. Выращивание затравочных кристаллов
Материалы: кипяченная вода, соль, салфетка
Результаты исследования. Для приготовления раствора взяли кипяченную воду, растворили в ней соль, профильтровали, налили в стакан и прикрыли салфеткой для того чтобы испарение шло медленно. При растворении пользовались таблицей растворимости (Приложение 2). Исследования происходили при комнатной температуре. Через неделю появилось много небольших кристаллов (фото 5).
Вывод: при испарении в условии массовой кристаллизации образуется много чистых одиночных кристаллов соли, которые имеют свою определенную форму - кубическую. Есть и поликристаллы. Видно, что кристаллы нарастают слоями.
Исследование №4. Выращивание монокристалла соли
Материалы: стакан с насыщенным раствором, кристалл соли подвешенный на волосе, выбранный из кристаллов (исследование 3, фото 5, фото 6), салфетка.
Методы исследования: Провели выращивание монокристалла соли путём выпаривания. Помещая маленький кристаллик соли в перенасыщенный раствор соли, предварительно привязав его за волос. В результате данного исследования вырастили кристалл размером 9 мм за 5 дня. (фото7)
Фото 5 Фото 6 Фото 7
Результат: получили кристалл поваренной соли. Кристалл соли растет за счет нарастания на него из водного раствора соли других кристаллов.
Исследование №5. Определение скорости роста кристаллов
Приборы и материалы: микроскоп, секундомер, насыщенный раствор поваренной соли, предметное стекло, миллиметровая бумага, стеклянная палочка(фото7)
Вывод: за счёт высокой скорости роста кристаллы гипосульфита натрия за 5мин полностью кристаллизовались, закрывая всё поле зрения микроскопа. Интенсивный рост кристаллов наблюдался в первые две минуты.
Исследование №6. Измерение температуры кристаллизации вещества
Результаты исследования. В сосуд с водой при температуре 70 опустили пробирку с исследуемым веществом и наблюдали за тем, как оно плавиться. После того как все вещество расплавилось перенесли пробирку в стакан, куда налита 150мл горячей воды и опустили в расплавленное вещество термометр. С момента когда температура вещества начала понижаться, с интервалом в одну минуту записывали показания термометра при этом наблюдали переход вещества в твердое состояние, при охлаждении вещества до 31 прекратили измерения. По результатом измерения подготовили таблицу (приложение 4) и построили график (приложение 5) по которому определили температуру кристаллизации вещества- она равна 31
Результаты исследования. С помощью мерного стаканчика налили из-под крана в пластмассовый стакан 200мл воды и поставили разогреваться на плиту, примерно до 70°С. Осторожно перелили воду в стакан, всыпали в нее половину химического вещества из пакета и краситель из одной вложенной в набор баночки. Размешали до полного растворения вещества. В течении двух недель отслеживали их рост (приложение 6). В ходе эксперимента вырастила кристалл длиной 70мм.
Исследование №8 . Выращивание кристаллов на вырубленными фигурами
Результаты исследования. Таким же образом как в опыте №7 приготовили раствор. Когда раствор полностью остыл, опустила в него проволочку так, чтобы фигурка, находящаяся на ней, полностью была в растворе, но не касалась дна (фото 6). На стакан (вдоль длинной стороны) положили карандаш, зацепив на него верхний конец проволоки, важно жестко закрепить проволоку на карандаше, т.к. фетр легче воды, и он будет всплывать. На 2 день на фигурки образовались кристаллы(фото7)
Вы можете изучить и скачать доклад-презентацию на тему Лекция 3. Кристаллизация. Презентация на заданную тему содержит 16 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!














Кристаллизация — это процесс выделения твёрдой фазы в виде кристаллов из растворов или расплавов, протекающий без каких-либо химических реакций. Кристаллизация — это процесс выделения твёрдой фазы в виде кристаллов из растворов или расплавов, протекающий без каких-либо химических реакций.
Способы кристаллизации Для осуществления кристаллизации в растворе необходимо создать пересыщение. По способам его создания различают два метода :
Политермическая кристаллизация Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов возникает пересыщение, обусловливающее выделение кристаллов. Охлаждаем с t1 до t2 , процесс кристаллизации изобразится линией CD, или АВD, или AB'D'D или AB"D.
Изотермическая кристаллизация Перевод исходного раствора из точки А в пересыщенное состояние можно осуществить и за счет удаления растворителя при выпаривании раствора (линия AEG), которое происходит при постоянной температуре его кипения.
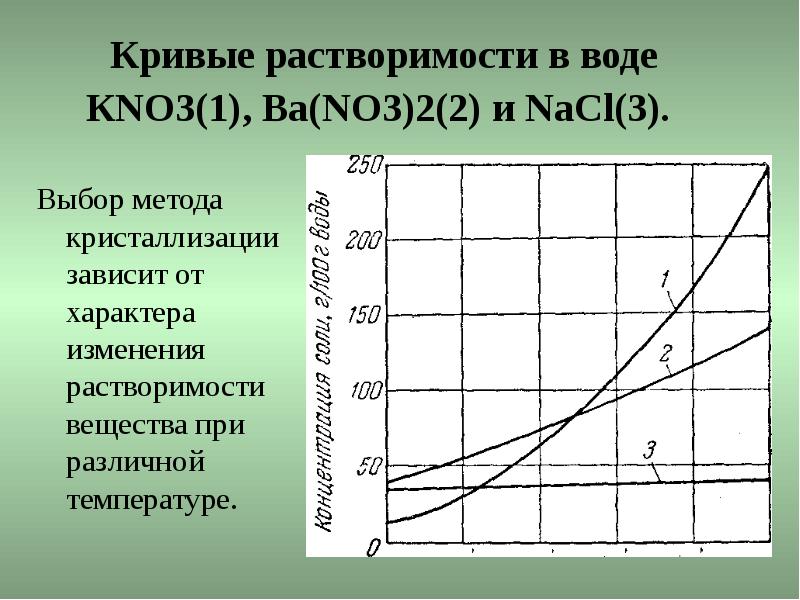
Кривые растворимости в воде КNО3(1), Ва(NО3)2(2) и NaCl(3). Выбор метода кристаллизации зависит от характера изменения растворимости вещества при различной температуре.
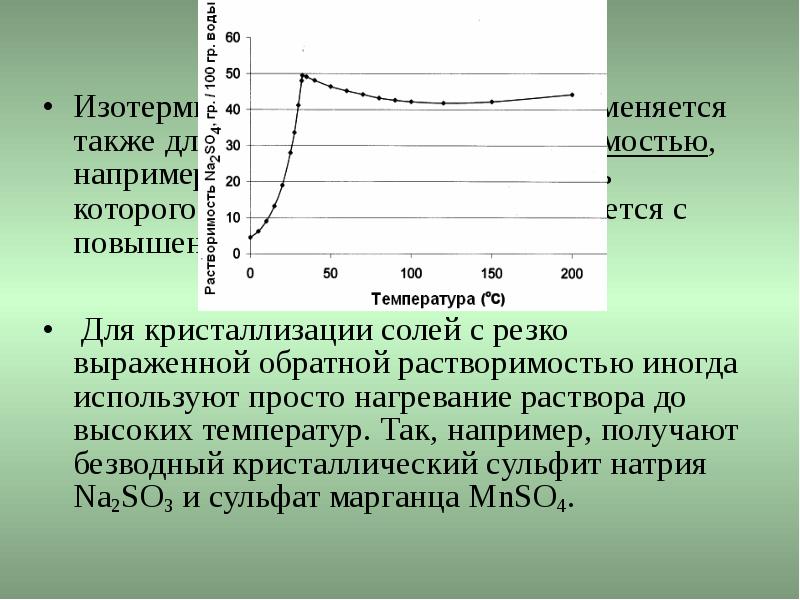
Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na2SO4 , растворимость которого, начиная с 32,4° С, уменьшается с повышением температуры. Изотермическая кристаллизация применяется также для солей с обратной растворимостью, например для Na2SO4 , растворимость которого, начиная с 32,4° С, уменьшается с повышением температуры. Для кристаллизации солей с резко выраженной обратной растворимостью иногда используют просто нагревание раствора до высоких температур. Так, например, получают безводный кристаллический сульфит натрия Na2SO3 и сульфат марганца MnSO4.
Кристаллизация высаливанием При добавлении к раствору вещества, понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и кристаллизацию. Вещества, добавляемые в раствор, обычно имеют одинаковый ион с кристаллизуемой солью. Характерными примерами являются: высаливание NaCl из рассолов за счет введения в них хлористого магния; получение безводного сульфата натрия добавлением к его растворам NaCl; Для высаливания Na2SO4 из водного раствора можно использовать аммиак, метиловый или этиловый спирты и др.
В производственных условиях процесс кристаллизации состоит из следующих операций: В производственных условиях процесс кристаллизации состоит из следующих операций: собственно кристаллизации, отделения кристаллов от маточных растворов, перекристаллизации (в случае необходимости), промывки и сушки кристаллов.
Процесс кристаллизации из растворов включает две стадии: образование кристаллических зародышей и их дальнейший рост. Процесс кристаллизации из растворов включает две стадии: образование кристаллических зародышей и их дальнейший рост. На образования центров кристаллизации влияет степень пересыщения, а также температура, растворимые примеси, перемешивание раствора, готовая кристаллическая поверхность, нерастворимое примеси и др.
Центры кристаллизации возникают гомогенно в объеме начальной фазы и гетерогенно на поверхностях посторонних твердых частиц (первичное зародышеобразование ), а также вблизи поверхности ранее сформировавшихся кристаллов новой фазы (вторичное зародышеобразование). Центры кристаллизации возникают гомогенно в объеме начальной фазы и гетерогенно на поверхностях посторонних твердых частиц (первичное зародышеобразование ), а также вблизи поверхности ранее сформировавшихся кристаллов новой фазы (вторичное зародышеобразование).
На рост, как и на образование кристаллов влияют различные факторы: пересыщение раствора, его перемешивание, рост температуры, нерастворимые примеси. Более крупные кристаллы получаются при медленном их росте и небольших степенях пересыщения раствора. При этом необходимо оптимальное перемешивание. На рост, как и на образование кристаллов влияют различные факторы: пересыщение раствора, его перемешивание, рост температуры, нерастворимые примеси. Более крупные кристаллы получаются при медленном их росте и небольших степенях пересыщения раствора. При этом необходимо оптимальное перемешивание.
При массовой кристаллизации вещества из раствора происходит перераспределение примесей между остающейся жидкой фазой (фильтратом, маточным раствором) и кристаллами. Примеси либо накапливаются в маточном распоре, либо в кристаллах. Встречаются случаи, когда они почти равномерно распределяются между твердой и жидкой фазами и очистки кристаллов не происходит. При массовой кристаллизации вещества из раствора происходит перераспределение примесей между остающейся жидкой фазой (фильтратом, маточным раствором) и кристаллами. Примеси либо накапливаются в маточном распоре, либо в кристаллах. Встречаются случаи, когда они почти равномерно распределяются между твердой и жидкой фазами и очистки кристаллов не происходит.
Дробная кристаллизация Дробная, или фракционная, кристаллизация применяется при наличии в растворе одновременно нескольких подлежащих извлечению веществ. Дробная кристаллизация — многостадийный процесс. На первой стадии исходный раствор делят на две фракции: концентрат (твердая фаза, обогащенная одним из компонентов) и хвосты (раствор, обедненный этим компонентом). Для этого производится частичная кристаллизация компонентов раствора путем охлаждения, добавления веществ, понижающих растворимость, или же изотермическим испарением. На второй стадии дробной кристаллизации каждую из фракций, полученных в результате первой стадии, делят вновь на две фракции и т. д.
Эффективность разделения зависит от соотношения количеств разделяемых компонентов, их растворимости, а также от условий дробной кристаллизации. Эффективность разделения зависит от соотношения количеств разделяемых компонентов, их растворимости, а также от условий дробной кристаллизации. В том случае, когда разделяемые вещества присутствуют в соизмеримых количествах, каждый компонент образует самостоятельную твёрдую фазу. Если один из компонентов присутствует в микроколичествах, он может не образовывать самостоятельной твёрдой фазы, а соосаждаться с макрокомпонентами.
При сокристаллизации из растворов следует различать два основных типа систем: При сокристаллизации из растворов следует различать два основных типа систем: В одних случаях происходит очистка конечных кристаллов от примеси и концентрирование в маточном растворе. В других случаях, наоборот, примесь концентрируется в твердой фазе и происходит очистка от нее маточного раствора. Основная цель применяемых в промышленной и препаративной практике процессов кристаллизации — достижение максимальной очистки кристаллов от примеси.
кристаллизация это процесс, в котором твердое тело образуется с атомами или молекулами в организованных структурах, которые называются кристаллическими сетями. Кристаллы и кристаллические сети могут образовываться в результате осаждения раствора, путем синтеза и, в некоторых случаях, путем прямого осаждения газа..
Структура и природа этой кристаллической сети будет зависеть от условий, в которых происходит процесс, включая время, прошедшее до достижения этого нового состояния. Кристаллизация как процесс разделения чрезвычайно полезна, поскольку она позволяет гарантировать, что структуры получаются только из желаемого соединения..

Кроме того, этот процесс гарантирует, что прохождение других частиц не будет разрешено, учитывая упорядоченную природу кристалла, что делает этот метод отличной альтернативой для очистки растворов. Много раз в химии и химическом машиностроении необходимо использовать процесс разделения смешения.
Эта потребность возникает либо для повышения чистоты смеси, либо для получения ее конкретного компонента, и по этой причине существует несколько методов, которые можно использовать в зависимости от фаз, в которых обнаружена эта комбинация веществ..
- 1 Что такое кристаллизация??
- 1.1 Нуклеация
- 1.2 Рост кристаллов
- 2.1 Рекристаллизация
- 2.2 В промышленной сфере
- 3.1 Кристаллизация при охлаждении
- 3.2 Кристаллизация выпариванием
Из чего состоит кристаллизация??
Кристаллизация требует двух шагов, которые должны произойти, прежде чем может быть образование кристаллической сети: во-первых, должно быть достаточно накопления атомов или молекул на микроскопическом уровне, чтобы началось так называемое зародышеобразование.
Эта стадия кристаллизации может происходить только в переохлажденных жидкостях (т. Е. Охлажденных ниже точки замерзания, не делая их твердыми) или перенасыщенных растворах..
После начала зародышеобразования в системе ядра могут быть сформированы достаточно стабильными и достаточно большими, чтобы начать второй этап кристаллизации: рост кристаллов.
зарождение
На этом первом этапе определяется расположение частиц, которые будут образовывать кристаллы, и наблюдается влияние факторов окружающей среды на образовавшиеся кристаллы; например, время, необходимое для появления первого кристалла, называется временем зарождения.
Существует две стадии нуклеации: первичная и вторичная нуклеация. В первом случае новые ядра образуются, когда в середине нет других кристаллов или когда другие существующие кристаллы не влияют на их образование..
Первичное зародышеобразование может быть гомогенным, при котором нет влияния на часть твердых веществ, присутствующих в среде; или он может быть гетерогенным, когда твердые частицы внешних веществ вызывают увеличение скорости нуклеации, которое обычно не происходит.
При вторичном зародышеобразовании новые кристаллы образуются под воздействием других существующих кристаллов; это может произойти из-за сил резания, которые делают сегменты существующих кристаллов новыми кристаллами, которые также растут с собственной скоростью.
Этот тип зародышеобразования выгоден в системах с высокой энергией или в потоке, где вовлеченная жидкость вызывает столкновения между кристаллами.
Рост кристаллов
Это процесс, в котором кристалл увеличивает свой размер путем агрегации большего количества молекул или ионов в промежуточные положения своей кристаллической сети..
В отличие от жидкостей, кристаллы растут равномерно только тогда, когда молекулы или ионы входят в эти положения, хотя их форма будет зависеть от природы рассматриваемого соединения. Любое неправильное расположение этой структуры называется дефектом кристалла..
Рост кристалла зависит от ряда факторов, среди которых, среди прочего, поверхностное натяжение раствора, давление, температура, относительная скорость кристаллов в растворе и число Рейнольдса..
Самый простой способ обеспечить рост кристаллов до больших размеров и их высокую чистоту - это контролируемое и медленное охлаждение, которое предотвращает образование кристаллов за короткое время и попадание посторонних веществ внутрь. они.
Кроме того, важно отметить, что с маленькими кристаллами намного сложнее манипулировать, хранить и перемещать, и их фильтрация из раствора стоит дороже, чем более крупные. В подавляющем большинстве случаев самые крупные кристаллы будут наиболее желательными по этим и другим причинам..
Как метод разделения
Необходимость в очистке растворов является общей в химии и химической инженерии, поскольку может возникнуть необходимость в получении продукта, который гомогенно смешан с другими или другими растворенными веществами..
Вот почему было разработано оборудование и методы для проведения кристаллизации как процесса промышленного разделения..
Существуют различные уровни кристаллизации, в зависимости от требований, и могут быть выполнены в небольшом или крупном масштабе. Следовательно, его можно разделить на две основные классификации:
перекристаллизация
Это называется перекристаллизацией в технику, которая используется для очистки химикатов в меньших масштабах, обычно в лаборатории.
Это делается с помощью раствора желаемого соединения вместе с его примесями в подходящем растворителе, стремясь тем самым осаждать в виде кристаллов некоторые из двух частиц, которые впоследствии будут удалены..
Существует несколько способов перекристаллизации растворов, среди которых перекристаллизация с растворителем, с несколькими растворителями или с горячей фильтрацией..
-Единый растворитель
-Различные растворители
При перекристаллизации нескольких растворителей используют два или более растворителей, и проводят тот же процесс, что и с растворителем. Преимущество этого процесса состоит в том, что соединение или примесь будут осаждаться при добавлении второго растворителя, поскольку они не растворимы в нем. В этом методе перекристаллизации нет необходимости нагревать смесь.
-Горячая фильтрация
В промышленной сфере
В промышленной области мы хотим осуществить процесс, называемый фракционной кристаллизацией, который представляет собой метод, который очищает вещества в соответствии с их различиями в растворимости..
Эти процессы напоминают процессы перекристаллизации, но используют разные технологии для обработки больших количеств продукта.
Применяются два метода, которые будут лучше объяснены в следующем утверждении: кристаллизация охлаждением и кристаллизация испарением.
Будучи крупномасштабным, этот процесс генерирует отходы, но они обычно рециркулируются системой для обеспечения абсолютной чистоты конечного продукта..
Типы кристаллизации
Как указано выше, существует два типа крупномасштабной кристаллизации: охлаждение и испарение. Также были созданы гибридные системы, где оба явления происходят одновременно.
Кристаллизация при охлаждении
В этом методе раствор охлаждают, чтобы уменьшить растворимость желаемого соединения, заставляя его начать осаждаться с желаемой скоростью..
В химическом машиностроении (или процессах) кристаллизаторы используются в форме резервуаров со смесителями, которые циркулируют хладагенты в отсеках, которые окружают смесь, так что оба вещества не вступают в контакт, пока происходит теплопередача хладагента в раствор..
Для удаления кристаллов используются скребки, которые толкают твердые фрагменты в яму.
Кристаллизация выпариванием
Это еще один вариант достижения осаждения кристаллов растворенного вещества с использованием процесса испарения растворителя (при постоянной температуре, в отличие от предыдущего метода), чтобы концентрация растворенного вещества превышала уровень растворимости..
Наиболее распространенными моделями являются так называемые модели с принудительной циркуляцией, которые удерживают раствор кристаллов в однородной суспензии через резервуар, управляя их потоком и скоростью, и обычно генерируют кристаллы большего размера, чем те, которые образуются при кристаллизации. охлаждением.
примеров
Кристаллизация - это процесс, часто используемый в промышленности, и можно привести несколько примеров:
- При добыче соли из морской воды.
- В производстве сахара.
- При образовании сульфата натрия (Na2SW4).
- В фармацевтической промышленности.
- При изготовлении шоколада, мороженого, масла и маргарина, в дополнение ко многим другим продуктам.
Читайте также:

