Клональное микроразмножение картофеля доклад
Обновлено: 16.05.2024
Одним из главных факторов, гарантирующих достижение потенциально возможного урожая картофеля в любых почвенно-климатических условиях, является высококачественный, свободный от вирусной и бактериальной инфекции посадочный материал 1. Растения, содержащие патологии различного происхождения, в своем урожае образуют клубни низкого качества (по содержанию сухого вещества, крахмала, витаминов), а также существенно (на 1980%) снижают урожайность. В таком материале количество крахмала может уменьшиться на 3-5%, а содержание витаминов — в 2-3 раза 5.
В последние годы большое значение приобрела культура in vitro и для поддерживающей селекции картофеля. Создание банка здоровых сортов позволяет вовлечь в селекционный процесс родительские формы, свободные от вирусов, бактерий и грибов, и получать в результате скрещивания новые генотипы с высокими качественными характеристиками.
Одной из важнейших задач интенсивного семеноводства картофеля является ускоренное размножение оздоровленных клубней. В модульной технологии ускоренного размножения семенного картофеля сочетаются два взаимозависимых компонента современного семеноводства — освобождение клубней от инфекции и размножение полученного высококачественного материала с минимально возможным накоплением патогенов. Она может включать как все модули, так и часть из них.
Модуль I. Оздоровление исходного материала, размножение in vitro, получение меристемных пробирочных растений, получение мини-клубней.
Модуль II. Размножение оздоровленного материала на основе микроспорофита, а также управления процессом роста апикальной меристемы этиолированных побегов (патенты РФ №№ 2261587, 2365089 и 2415558).
Модуль III. Получение клубней с использованием ярусного способа размножения (оформлена заявка на изобретение).
Модуль IV. Использование агротехнических приемов для увеличения коэффициента размножения семенного материала в производственных условиях.
Основные принципы работы при поддержании банка здоровых сортов картофеля в полевой культуре и in vitro
В современной классификации семенного картофеля к категории исходного материала относится картофель, освобожденный от вирусной и других инфекций методами биотехнологии и клонового отбора. Применение биотехнологического метода заключается в использовании лабораторного способа оздоровления перспективных сортов и гибридов картофеля, получении новых линий in vitro и их ускоренном микрокло- нальном размножении. Преимущества данного метода по сравнению с традиционным клоновым отбором состоит в сокращении периода получения здоровых линий, их ускоренном микроклональном размножении в искусственных лабораторных условиях и производства необходимого количества мини-клубней. Однако применение исключительно биотехнологического метода, по мнению ряда исследователей, может привести к проявлению различных модификаций и соответственно сказаться на сортовой чистоте производимого семенного материала. Метаморфозы могут проявиться как при оздоровлении сортов, так и в результате их длительного депонирования in vitro.
Технологический процесс введения в культуру in vitro основан на применении метода ростовых черенков (рис.1). Подготовку образцов к введению в культуру начинают по мере прорастания клубней. Проросшие клубни нумеруют и индивидуально тестируют на наличие вирусной инфекции методом им- муноферментного анализа (ИФА). Клубни, свободные от фитопатогенной инфекции, размещают в темноте для получения этиолированных ростков. К черенкованию приступают при достижении ростков длиной не менее 10-20 см. Снятые с каждого клубня ростки индивидуально стерилизуют, в асептических условиях разрезают на черенки и размещают в пробирки с питательной средой.

Рис.1. Применение метода ростовых черенков при введении новых линий в культуру ткани
Через 20-30 дней после введения в культуру ткани формируются растения с 5-6 листочками. При использовании метода ростковых черенков с одного клубня удается получить не более 10-15 микрорастений. Данный исходный материал проходит повторное тестирование на наличие скрытой зараженности. Свободные по результатам диагностики линии in vitro черенкуют, и часть микрорастений (10-15) поступают для формирования банка in vitro на основе БЗСК, остальные — для клонального микроразмножения, включения в семеноводческие программы и производства исходного материала в виде микрорастений.
Преимущество применяемого метода отбора базовых клонов с использованием многократного улучшающего отбора и ускоренного размножения оздоровленного исходного материала картофеля состоит в систематическом мониторинге качества сорто- образцов в полевых питомниках БЗСК и в культуре in vitro. Главным критерием оценки материала по сравнению с проведением отбора в питомниках первичного семеноводства (традиционный метод) является применение непрерывного многократного улучшающего отбора в питомниках БЗСК в сочетании с высокочувствительными диагностическими методами оценки материала на наличие фитопатогенной инфекции и получении здорового клубневого материала.
Получение здорового исходного материала на основе БЗСК и его ускоренное клональное микроразмножение в культуре in vitro позволяет с максимальной эффективностью поддерживать биологический потенциал сортов картофеля, сохранять типичность сортов на том уровне, на котором они были созданы селекционерами, и производить необходимый объем пробирочного материала для оригинального семеноводства.
В 2011 г. во время проведения Международной научно-практической конференции, посвященной 80- летию ВНИИКХ (12-14 июля), была осуществлена независимая экспертная оценка качества сортов и линий in vitro из БЗСК. Оздоровленный исходный материал ВНИИКХ в виде микрорастений был протестирован по шести основным вирусам картофеля представителями европейской компании Bioreba (Швейцария). Данная компания является одной их ведущих на европейском рынке по производству оборудования, реактивов и диагностике сельскохозяйственных культур на наличие патологий различного происхождения. По результатам проведенной экспертизы весь набор протестированных сортов и линий in vitro (94 образца) оказался свободным от вирусной инфекции. Проведенная экспертная оценка позволяет приравнивать полученный исходный материал из БЗСК к категории предбазисного (Pre-Basic Seed) семенного материала по стандарту ЕЭК ООН.
Проведение лабораторного тестирования ИФА по листовым пробам в период вегетации микрорастений и послеуборочного зимнего клубневого контроля мини-клубней подтвердило высокое исходное качество производимого материала. По результатам диагностики исследуемые партии оказались свободными от вирусной инфекции.
В 2011 г. полученный урожай мини-клубней использовали для закладки питомника первого полевого поколения. Контроль качества производимой высокой категории семенного картофеля в период вегетации растений подтвердил надежное качество исходного материала, полученного на основе БЗСК.
Результаты исследований отражают преимущество применяемого метода отбора базовых клонов в полевом питомнике БЗСК с использованием многократного улучшающего отбора и ускоренного размножения оздоровленного исходного материала на основе БЗСК в культуре in vitro. Внедрение данного элемента технологии в семеноводство позволяет обеспечивать систематический мониторинг качества сортообразцов в полевых питомниках, в культуре in vitro и на первых этапах размножения семенного картофеля в оригинальном семеноводстве.
Использование микроспорофита в качестве единицы размножения
Потенциальные возможности вегетативного способа размножения клубней практически безграничны и лимитируются лишь факторами времени и возможностями материальной базы для процессов регенерации растений из частей клубня или побега, укоренения эксплантантов в субстрате и вегетации полученных организмов при формировании нового урожая.
Для изучения возможности укоренения непосредственно в субстрате элементов морфологии клубня, обладающих малой массой и размерами, нами были проведены опыты с апексами, протоспорофитами и микроспорофитами.
В качестве контроля использовали этиолированные ростки длиной 15-20 мм, у которых были сформированы корешки длиной 2-5 мм и более. Для получения апексов срезали верхушки этиолированных ростков длиной 4-5 мм и массой 0,03-0,09 г.
Протоспорофит получали посредством отчуждения зачатка бокового этиолированного побега с участком покровных тканей и основной паренхимы коры этиолированного побега предыдущего порядка. На протоспорофите отсутствовали корешки или корневые бугорки. Масса протоспорофита 0,05-0,2 г.
Микроспорофит получали так же, как и протоспорофит, однако в отличие от протоспорофита он имел 1-5 и более корешков длиной от 1 до 3 мм. Масса микроспорофита 0,09-0,3 г.
Анализируя качественные характеристики по- беговых фрагментов, представленных апексами и протоспорофитами, можно сказать, что они являют собой промежуточное звено между технологиями регенерации частей растений in vitro и укоренения ростковых микрофрагментов непосредственно в субстрате. Как исходный материал для культуры меристем они обладают слишком большими размерами (около 5 мм) и массой (0,05-0,2 г). Если же целью является размножение уже освобожденного от инфекции материала, то эффективность использования апексов и протоспорофитов слишком низка, так как их приживаемость непосредственно в субстрате (0,50,8%) не может быть признана достаточной для получения положительных конечных результатов. Попытки укоренения апексов и протоспорофитов показали, что длительность процесса формирования корневой системы превышает возможности поддержания их жизнеспособности. Недостаточное поступление влаги из субстрата приводит к увяданию, а затем высыханию тканей, что в итоге завершается их отмиранием. Увеличение же влажности воздуха создает гораздо большую опасность в связи с началом быстрого процесса побурения и загнивания паренхимных тканей стеблевой части апекса и протоспорофита.
Некоторые модификации микроспорофита обладают повышенной жизнеспособностью. При устойчивом функционировании даже одного корешка после высадки в субстрат у микроспорофита происходит быстрое формирование корневой системы. Анализ особенностей онтогенеза микроспорофитов показал, что после укоренения они обладали практически одинаковыми свойствами независимо от исходных данных (количества имеющихся корешков). Вместе с тем именно процесс укоренения качественно разделял исходные формы по их потенциальным возможностям.
Для ускоренного размножения возможно использование росткового микрофрагмента (микроспорофита), представляющего собой отделенный от этиолированного ростка зачаток бокового побега с участком покровных тканей и основной паренхимы коры этиолированного побега предыдущего порядка массой 0,09-0,3 г. Модификационный вариант микроспорофита с 5 и более корешками длиной от 1 до 3 мм обладает повышенной жизнеспособностью. За счет возможности получения большого количества микроспорофитов от одного материнского клубня коэффициент размножения превышает 1:300.
Ярусный способ размножения
Исследование проведено на опытном участке кафедры растениеводства ИСХПР НовГУ. Способ основан на стимуляции ветвления базовых ростков клубня картофеля до посадки с последующим увеличением зоны столоно- и клубнеобразования. Для подготовки клубней их апикальную часть надрезают и обрабатывают раствором тиомочевины. Проращива-

ние проводят в темноте при температуре 14-16°С и относительной влажности воздуха 90-95%. При формировании на базовых этиолированных ростках первого порядка 3-4 узлов проводят отчуждение апексов, что стимулирует ветвление побегов.
После посадки клубни присыпают перегнойной землей слоем 10 см, а по достижении высоты побегов 21-25 см над уровнем перегнойной земли побеги присыпают питательным субстратом разной плотности.
Подсыпку повторяют несколько раз по мере достижения высоты побегов 21-25 см над уровнем субстрата.
При подсыпке оставляют свободными над поверхностью субстрата вершины побегов длиной 1-5 см, а плотность субстрата уменьшают с каждой подсыпкой.
За счет многократного подсыпания субстрата происходит формирование клубней на вегетативных побегах растения, при этом коэффициент размножения в опытном варианте увеличивается до 30,9 против 21,7 на контроле.
Увеличение коэффициента размножения семенных клубней в производственных условиях за счет использования агротехнических приемов
Для увеличения коэффициента размножения на семенных участках применяют загущенную посадку клубней. Раннее удаление наземной массы способствует снижению инфицированности клубней, а также увеличивает удельный выход семенной фракции. За счет проведения сеникации можно в 1,6-1,7 раза увеличить количество клубней семенной фракции. В наших опытах с проведением предуборочной обработки максимальный эффект был получен с применением в качестве сениканта 30%-го раствора аммофоса (рис.2).
Существенно значимым показателем эффективности выращивания семенного картофеля является выход с гектара клубней семенной фракции не только в массе, но и в количественном выражении. Общее количество клубней, полученных на гектаре посадок, зависит от вида предуборочной обработки. Так, при проведении скашивания за 10 дней до уборки остановка в прибавлении массы привела к тому, что некоторые клубни достигли к моменту проведения обработки размеров и массы семенной фракции, в то время как на контроле рост их продолжался до параметров крупной (продовольственной) фракции.
В варианте с проведением обработки растений картофеля 30%-м настоем суперфосфата за 30 дней до уборки, а также при использовании в качестве се- никанта 30%-го раствора ЖКУ и 30%-го раствора аммофоса общее число клубней по сравнению с контролем возросло на 56,7-127,6 тыс. на одном гектаре. Некоторые зачатки клубней за счет интенсификации оттока пластических веществ из листьев и стеблей и вследствие этого быстрого роста увеличились в массе до параметров фракции мелких клубней (фуражной). По этой же причине часть клубней из фуражной фракции увеличила массу до фракции семенной.
Применение модульной технологии ускоренного размножения клубней картофеля при прочих равных условиях позволяет получить нужное количество посадочного материала в более короткие сроки и, следовательно, снизить уровень поражения клубней патогенами.
Анисимов Б.В. Качество семенного картофеля — на уровень мировых стандартов: Информ. бюл. М.: МСХ РФ, 2000. 20 с.
Шпаар Д., Иванюк В., Шуман П., Постиков А. и др. Картофель. Минск : ФУА информ, 1999. С.211-213.
Карманов С.Н., Коршунов В.П. Пути интенсификации картофелеводства. М., 1988. С.16-26.
Коршунов А.В., Анисимов Б.В. Семеноводство картофеля, контроль качества и сертификации / Россельхозака- демия, ВНИИКХ. М., 2003. 291 с.
Анисимов Б.В. Сортовые ресурсы и передовой опыт семеноводства картофеля. М.: Росинформагротех, 2000. 148 с.
Жукова М.И. Борьба с вирусными болезнями в Белоруссии // Защита и карантин растений. 1998. №6. С.19-20.
Муромцев Г.С. Биотехнология в растениеводстве // Селекция и семеноводство. 1990. №4. С.2-9.
Трофимец Л.Н., Анисимов Б.В., Меличенко Г.И. Развитие безвирусного семеноводства картофеля // Селекция и семеноводство. 1990. №4. С.44-49.
Поспиши П.Ф. Методы биотехнологии в растениеводстве // Междунар. агропром. журн. 1989. №3. С.91-95.
Коршунов А.В. Картофелеводство должно развиваться интенсивно // Картофель и овощи. 1997. №2. С.2-4.
Волкова Р.И., Бурова В.В., Курлович М.М. Технология производства элиты картофеля, оздоровленного методом апикальных меристем // Разработки и совершенствование методов селекции первичного семеноводства картофеля: Сб. науч. тр. ЛСХИ. Л., 1988. С.110-114.
Г.М. Сафроновская, кандидат с.-х. наук.
Отличный вкус картофеля — это не только признак сорта, но и грамотно применённая агротехника. Вкус любого сорта картофеля портится при нарушении агротехники выращивания. Клубни одного и того же сорта в разные годы, выращенного на разных почвах, отличаются по вкусу. Это объясняется различием в составе биохимических элементов. Наилучшие кулинарные качества имеет картофель при соотношении крахмала и белков 12:16. При преобладании крахмала над белками в 8 раз — клубни не разварятся, а при свыше в 16 раз — они растрескаются при варке в кожуре. Особенный вкус картофелю придают глютаминовая и аспарагиновая кислоты. На вкусовые качества также влияют содержащиеся в нем жиры, эфирные масла и спирты.
С течением времени картофель вырождается. Особенно быстро это происходит при несбалансированном питании. Поэтому сортовой состав культуры периодически требует обновления. При приобретении семенного картофеля в первую очередь интересуются его возрастом (репродукцией). Чем моложе семенной материал, тем он здоровее и дороже стоит.
Сегодня, кроме традиционных методов размножения картофеля (выращивания из семян и клубней), его оздоровленный семенной материал получают путем микроклонального (меристемного) размножения. Микроклональное размножение незаменимо для постоянного получения в короткие сроки значительного количества качественного семенного безвирусного картофеля (использование зараженного посадочного материала ведет к значительному недобору урожайности и качества клубней, увеличивает затраты на химические методы борьбы с болезнями).
Как оздоравливают посадочный материал? Используют культивирование картофеля из апикальной меристемы (in vitro). Меристема — это особая ткань растений, которая сохраняет способность к образованию новых клеток, угнетая синтез вирусных нуклеопротеидов (вирус не поражает меристемы на верхушках побегов). За счет деления меристемы растения растут, образуя листья, стебли, корни и цветки. Меристемная ткань сохраняется в узлах побега, почках, кончиках корней, у основания черешков листьев и цветоносах.
На первом этапе меристемные ткани отделяют от нужного экземпляра растения и помещают на питательные среды в стерильные пробирки, выдерживая их в специальном шкафу в течение 20-40 дней при освещении до 14 часов в сутки.
Через 1,0-1,5 месяца на микрочеренках образуются зачатки всех вегетативных органов растения. Подрощенные микрочеренки делят на 5-7 частей, которые снова проращивают в пробирках в течение 20-30 дней.
Когда меристемные микрочеренки образуют достаточную корневую систему, проводят их укоренение и адаптацию. Их пересаживают из пробирок в заполненные легким торфом горшочки, которые для привыкания растений к естественным условиям выращивания помещают в защищенную среду на 4-6 недель. В этот период растения уязвимы и плохо приживаются.
После укоренения и адаптации новые растения картофеля доращивают по свойственной картофелю агротехнике, высаживая в теплицу, а затем и в открытый грунт.
Полученный микроклональным способом оздоровленный картофель наследует все признаки конкретного сорта и в дальнейшем может размножаться любым способом. При микроклональном размножении сорт картофеля не приобретает никаких новых свойств.
Важное преимущество полученного микроклональным размножением оздоровленного семенного картофеля — повышение урожайности клубней на 30-70% и предотвращение их потерь во время хранения на 30-50%.
Перед существующими традиционными способами размножения этот метод имеет следующие преимущества:
- получение генетически однородного посадочного материала;
- освобождение растений от вирусов;
- высокий коэффициент размножения;
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной фазе развития;
- возможность проведения работ в течение года и экономия площадей для выращивания посадочного материала.
Выращивание картофеля по современным технологиям
Меристемный метод размножения (in vitro) давно и широко применяется в современных технологиях выращивания семенного картофеля. В странах ЕС для производства столового картофеля введено требование использования только девирусированных семян, что позволяет получать высокую урожайность и снижать применение химических СЗР.
Известно, что такой технологический прием на посадках картофеля, как декапитация (механическое удаление верхушек стеблей на 5 см), позволяет увеличить общую листовую поверхность. При этом влияет на формирование высокой фотосинтетической площади листьев и урожайность, снижает поражаемость клубней некоторыми болезнями (Гаспарян И.Н., Евстратова Л.П.).
Современные научные исследования. Приведём результаты исследований доктора наук Людмилы Трипольской из Вокеского ф-ла Центра аграрных и лесных наук Литвы (Вильнюс), по изучению влияния биологически активных продуктов на основе аминокислот, а также декапитации стеблей на продуктивность меристемных микроклонов раннего картофеля сорта Goda и позднего сорта Aista.
Однако при пересадке микроклонов в теплицы частично нарушается корневая система. Растения попадают в среду с большей концентрацией солей, изменяющимся температурным режимом и часть микроклонов плохо приживается. Испытывая стресс, растения могут снижать продуктивность. Поэтому после посадки микроклонов в субстрат для снижения стресса применяли биоактивный продукт Prolis (пролиновую аминокислоту), а также увеличивающий осмос клетки Pompa (глютаминовая аминокислота + K2SO4), что защищало растения от повышенной концентрации солей. Спустя 30 дней биоактивные продукты вносили повторно по листьям согласно схеме опыта. Удаление верхушек стеблей проводили в начале и в фазу полной бутонизации картофеля.
- Фон (N60P40K80 кг/га).
- Prolis после посадки микроклонов в субстрат.
- Prolis + Pompa после посадки микроклонов в субстрат.
- Prolis после посадки микроклонов в субстрат и через 30 дней по листьям.
- Prolis + Pompa после посадки микроклонов в субстрат и через 30 дней по листьям.
- Декапитация верхушек стеблей картофеля в начале бутонизации (ВВСН 50).
- Декапитация верхушек стеблей картофеля в фазу полной бутонизации (ВВСН 57).
Полученные из микроклонов семенные клубни дифференцировали по величине: большими считали клубни с диаметром более 2 см, средними — 1-2 см, а менее 1 см относили к мелким и их повторно высаживали в теплице. Количество клубней, выращенное из одного микроклона растения, достигало 7-18 штук.
В период вегетации раннего и позднего сортов картофеля исследовали влияние изучаемых биопродуктов и удаления верхушек стеблей на биохимический состав растений — содержание азота в растениях и накопление сахаров в листьях в период цветения ( рис. 1).
Рис. 1. Содержание азота (%) в листьях раннего и позднего картофеля в фазу цветения при обработке микроклонов биопрепаратами и декапитации
Реакция раннего и позднего сортов картофеля разная. Установлено, что растения позднего сорта картофеля Aista накапливали азота в период цветения больше, чем раннего Goda. Декапитация также увеличивала ассимиляцию азота растениями в фазу цветения, но срок проведения декапитации не влиял на поглощение азота.
Биоактивные препараты и особенно декапитация значительно снижали накопление сахаров в листьях в период цветения, скорее всего, в силу их интенсивного оттока в столоны и формирующиеся клубни картофеля.
Изучение продуктивности картофеля раннего сорта Goda показало, что на фоне с минеральными удобрениями формировалось в среднем 8,6 клубней при средней массе 1 клубня 14,8 г (рис. 2, 3). Их количество увеличивалось при обработках микроклонов биопродуктом Prolis до 9,1-9,5 штук/раст. Декапитация на количество клубней не влияла, но в период полной бутонизации она увеличивала массу клубня до 18,1 г. Наибольшая масса 1 клубня (19,9 г) была при двукратной обработке сорта Goda биопрепаратами Prolis + Pompa. Только при двукратном применении этих биопрепаратов получили увеличение массы клубней с 1 растения до 144 и 155 г и масса клубней коррелировала с содержанием азота в листьях в период цветения. Для семенного картофеля важен размер клубней. При двукратной обработке Prolis и Pompa и декапитации в период полной бутонизации на клубни более 2 см приходилось 60% и меньше всего (10-11%) была доля клубней менее 1 см.
ТОП-13 вредителей картофеля
На продуктивность картофеля позднего сорта Aista исследуемые продукты оказывали несколько иное влияние. Отмечалась более сильная зависимость массы клубней от содержания азота в фазу цветения в листьях. Количество клубней на 1 растении увеличивалось от 7,4 шт. на фоне до 9,6 штук от однократного применения смеси биопрепаратов Prolis и Pompa, да и декапитация оказывала большее влияние. Чем меньше было количество клубней на растении, тем меньше была масса одного клубня. Наибольшее количество клубней формировали растения при применении продукта Prolis один раз за вегетацию.
Рис. 2. Масса клубней (г) с 1 растения микроклона раннего и позднего картофеля при обработке биопрепаратами и декапитации
Рис. 3. Влияние обработки биопрепаратами и декапитации на массу 1 клубня (г) у микроклонов раннего и позднего картофеля
В итоге установлено, что влияние биоактивных препаратов на продуктивность микроклонов зависело от генотипа картофеля. От обработки микроклонов растений биопрепаратами отмечалась лишь тенденция повышения массы клубней раннего картофеля. Декапитация в фазу полной бутонизации значительно увеличивала массу клубней.
Продуктивность микроклонов позднего картофеля существенно возрастала от уменьшающего стресс биоактивного препарата Prolis и его смеси с увеличивающим осмос клетки биопрепаратом Pompa дважды за вегетацию. Более эффективным на позднем сорте картофеля было удаление стеблей растений в фазу полной бутонизации (ВВСН 57).
Безушибочный картофель, итоги семеноводства
По мнению ученого из Литвы, экономическая оправданность обработок растений картофеля биопрепаратами и удаление верхушек в период бутонизации понятны. Такие приёмы увеличения продуктивности семенного картофеля широко используются в экологических хозяйствах Нидерландов.
Федеральное государственное бюджетное учреждение
РОССИЙСКИЙ СЕЛЬСКОХОЗЯЙСТВЕННЫЙ ЦЕНТР
Выращивание картофеля методом микроклонального размножения
Для обеспечения устойчивого производства картофеля, большое значение имеет повышение качества семенного материала. При многолетнем использовании картофель накапливает болезни, которые приводят к его вырождению. Болезни передаются от больных растений к здоровым и далее переносятся из поколения в поколение при вегетативном размножении картофеля. Серьезные болезни картофеля вызывают фитопатогенные вирусы, которые приводят к значительным потерям урожая.
В хозяйстве производство семенного картофеля включает в себя приобретение пробирочных растений перспективных сортов и их ускоренное размножение в лабораторных условиях. Пробирочные растения размножаются путем деления растений на черенки.
Выращиваются растения из полученных черенков на многокомпонентной питательной среде, наиболее отвечающей потребностям роста и развития растений. Расчеренкованные растения доращиваются на стеллажах, оборудованных люминесцентными лампами, и в последующем высаживаются в теплицы для получения мини клубней (исходного материала).

На исходном материале, в период вегетации проводятся обследования с визуальной оценкой каждого растения. Первое обследование проводят при высоте растений 10-15 см, второе - в период цветения, третье-перед удалением ботвы.
В 2020 году хозяйство планирует высадить 20 тысяч штук пробирочных растений трех сортов: Ред Скарлетт, Фаворит, Романо. Таким образом, метод микроклонального размножения растений в пробирках наиболее эффективен при ускоренном размножении здоровых растений. Применение этого метода позволяет в течение четырех-пяти месяцев получить 20-25 тысяч растений, пригодных для высадки в грунт, то есть из одного растения можно получить 3227-3755 клубней.

Для каждого огородника, хоть профессионала, хоть любителя, важно знать, каким образом можно размножать свои посадки. Способов существует достаточно много, и одним из наиболее интересных и действенных является метод микроклонального размножения. Что это такое, как работает и все основные его премудрости - в нашем материале.
Что же это?
Начнем сразу с самого главного. В словосочетании "микроклональное размножение" второе слово понятно всем, а вот первое - только избранным. Проясним ситуацию. Что же есть такое "микроклональное"?
Если говорить "умным" научным языком, то это особый подвид вегетативного размножения с использованием техники под названием "инвитро" (in vitro), который дает возможность получить растения в более короткие сроки. Понятнее и подробнее будем разбираться дальше, и для этого сначала напомним о том, что представляет собой вегетативное размножение, и поясним, что означает термин "инвитро".
В научных дебрях
Из курса школьной биологии нам известно, что размножать растения можно двумя путями: семенным (когда мы разбрасываем в почву семена) и вегетативным. Вегетативное размножение является бесполым, оно происходит с помощью отделения некой части от растения-родителя. Почкование, укоренение молодых побегов, пересадка луковиц - все это вегетативное размножение.
Казалось бы, с помощью семян увеличивать численность растений гораздо проще - нет такой мороки. Однако у этого метода есть немало минусов; в отдельных случаях воспользоваться семенами вообще невозможно - и вегетативный способ, неоспоримое преимущество которого перед первым состоит в сохранении совокупности генов растения-родителя, остается единственно доступным и удобным. Но к сожалению, недостатков хватает и у него. Например, отсутствие нужной эффективности (у таких, допустим, растений, как дуб, сосна и так далее), "пожилые" древесные породы (которым больше 15 лет) не способны размножаться черенкованием, подобные процедуры довольно трудоемки и энергозатратны, не всегда полученные растения соответствуют норме и образцу (могут быть зараженными) - ну и так далее.

И именно для этих случаев существует технология микроклонального размножения растений, которая, как Чип и Дейл, спешит на помощь. Как уже говорилось выше, она осуществляется в технике "инвитро", что с латинского языка переводится как "в пробирке". Таким образом, данная методика позволяет "клонировать" в "пробирке" растение с генами точь-в-точь такими, как и у родительской особи. Это происходит благодаря тому, что клетка способна давать жизнь новому организму под влиянием внешних факторов.
У технологии микроклонального размножения есть, бесспорно, целый ряд достоинств и преимуществ. О них далее и поговорим.
Чем метод микроклонального размножения лучше
Многим! И в первую очередь отсутствием вирусов и инфекций у выведенных растений (потому, что для этого используются особые клетки - они называются меристемными, особенность их заключается в непрестанном делении и наличии физиологической активности на протяжении всей жизни). Также у растений, "добываемых" таким способом, присутствует достаточно высокий объем размножения, а весь селекционный процесс проходит гораздо быстрее. С помощью технологии микроклонального размножения возможно осуществить эту процедуру и для тех растений, для которых обычными, "традиционными" методами это сделать крайне проблематично. Наконец, в технике "инвитро" выращивать растения можно в течение всего года, не ограничиваясь каким-либо одним промежутком. Так что плюсов у подобной методики действительно много. И прежде чем углубляться в суть микроклонального размножения растений, коснемся немного истории возникновения данного способа. Кому и как пришла в голову такая идея?
История метода
Первым успешный опыт над орхидеями произвел ученый-француз еще в пятидесятых годах прошлого столетия. При этом не он стал изначально заниматься техникой "инвитро" - ее разрабатывали и до него, и вполне успешно. Однако именно Жан Морель - таково имя француза-экспериментатора - решился на подобный опыт и осуществил его вполне удачно. Работы же, рассказывающие про данную технику, появились еще на несколько десятилетий до него - в двадцатых годах прошлого же столетия.

"Пробирочный клон" древесного растения - конкретно осины - был получен в шестидесятых годах. Работать с деревом оказалось труднее, нежели с цветами и иными видами растений, однако и эти трудности через определенный промежуток времени были преодолены. В настоящее время более 200 видов деревьев из более чем сорока семейств можно получать "пробирочным" способом. Технология микроклонального размножения растений оправдывает себя и дает свои плоды.
Подробнее о методе
Как уже можно было догадаться, в разработке и применении микроклонального размножения растений существует много своих тонкостей. Так, например, есть особые этапы у данной технологии, соблюдать которые для получения желаемого результата просто необходимо. Нужно понимать, что пренебрежение последовательностью действий или каким-то этапом может принести абсолютно не тот итог, на который рассчитывает селекционер. Итак, об этапах данной методики мы и поговорим далее.
Этапы микроклонального размножения растений
Подобная технология предполагает четыре "ступеньки" на пути к получению заветных "клонов". Постараемся рассказать о них как можно более ненаучно, поскольку термины биотехнологии - вещь все же не самая понятная для широкой аудитории. И, кстати, один из этих терминов тут же и поясним: эксплант - так ученые в данной области именуют отделенный от родительского организма новый организм. То есть тот самый "подопытный", который и будут выращивать далее.
Итак, перейдем к нашим "ступенькам". Первый шажок - это выбор собственно родителя - или донора. К этому вопросу следует подойти с максимальной серьезностью и ответственностью, потому что для получения хорошего, крепкого, здорового растения мы и "оригинал" должны подобрать такой же. Яблоко-то от яблони, как известно, недалеко падает.
На этом же этапе необходимо изолировать и стерилизовать экспланты, после чего организовать такие условия, чтобы рост этих самых эксплантов в технике "инвитро" происходил максимально комфортно.
Вторая "ступенька" проще некуда - это само размножение. Оно возможно через месяц-полтора, когда мини-череночки уже достигли размера горошинок и имеют зачатки всех вегетативных органов. За ним, в свою очередь, следует укоренение побегов, которые получились на предыдущем этапе. Его проводят, когда растение уже образовало хорошую корневую систему.

Последний шаг - помощь растениям в адаптации к "жизни" в почве, выращивание их в теплице, последующая пересадка в землю либо реализация - так сказать, "отправление в большой мир". Этот этап, как это ни странно, наиболее трудоемкий и многозатратный, поскольку очень часто, к сожалению, бывает такое, что, оказавшись в почве, растение начинает терять листья, останавливаться в росте – а затем и вовсе оно может погибнуть. Все это происходит потому, что пробирочные растения при пересадке в грунт теряют очень много воды. Следовательно, необходимо в процессе пересаживания предотвратить подобную возможность – для чего рекомендуется опрыскивать листья 50-процентным водным раствором глицерина или смесью парафина. Делать это необходимо на протяжении всего акклиматизационного периода. Кроме того, в некоторых случаях целесообразной является намеренная микоризация – то есть искусственное внедрение в ткани растения грибов, которые заражают его. Проводится это для того, чтобы растение получило как можно больше полезных питательных и органических веществ, а также было защищено от различных патогенов.
Вот и все этапы микроклонального размножения, в которых, как мы видим, нет ничего глобально сложного или сверхъестественного, однако, повторим еще раз, все это мероприятие требует большой ответственности и внимания.
Влияющие факторы
- Сортовые, видовые и физиологические особенности растения-родителя – оно должно быть здоровым, интенсивно расти, при необходимости обработано температурным воздействием.
- Возраст, строение и происхождение экспланта.
- Длительность культивирования.
- Эффективность стерилизации.
- Удачная питательная среда.
- Гормоны, минеральные соли, углеводы, витамины.
- Температура и освещение.
Что нужно для микроразмножения
К растениям, которые будут размножать вышеуказанным образом, предъявляется одно очень важное требование - помимо того, что они должны быть здоровы. Это непременное сохранение генетической стабильности на протяжении всех вышеупомянутых этапов. Такому требованию лучше всего отвечают апикальные меристемы, а также пазушные почки стеблевого происхождения, поэтому именно их и предпочитают использовать для интересующей нас процедуры.
Вышеупомянутые термины должны быть непонятны простому обывателю. Ниже попробуем растолковать, что это за звери такие и с чем их подавать к столу.
Апикальные меристемы
Выше мы уже упоминали о существовании особых меристемных клеток - иначе говоря, образовательных. Это клетки, которые непрестанно делятся, всегда находятся в состоянии физической активности - благодаря чему нарастает масса растения и образуется особая ткань этого самого растения. Она и называется меристемой. Видов меристем бывает много разных. В целом их можно поделить на общие и специальные. В понятие общих меристем входят три группы, которые как бы вытекают одна из другой. Самая первая меристема у растения - меристема зародыша, из которой как раз-таки и берет начало интересующая нас апикальная меристема.
Слово "апикальный" произошло от латинского "апикс" и переводится оно как "вершина". Таким образом, это верхушечная система тканей, находящаяся на самом кончике зародыша - и именно из нее впоследствии формируется побег и начинается его рост и развитие. Значит, говоря об апикальной меристеме как об объекте для микроклонирования, мы должны понимать, что берем для наших нужд верхушечку зародыша.

С пазушными почками немного проще. Что такое почки, знают все. Пазушная почка - та, что родилась из пазухи листа. Пазуха листа, в свою очередь, это угол между листом и его стеблем; оттуда будет как раз и расти почка либо же побег. Вот эту самую часть, то есть будущий боковой побег, и берут тоже для последующего микроразмножения.
Теперь, когда свет над завесой тайны немного пролит, можно перейти, наконец, и к методам микроклонального размножения растений.
Способы размножения микро-образом
Микроклональное размножение тем еще хорошо, что предполагает в своей основе возможность использования сразу нескольких различных техник. Постараемся как можно проще осветить каждую из них. Всего насчитывается четыре метода микроклонального размножения растений.
Первый. Активация уже существующих в растении меристем
Что это значит? В растении, даже таком крошечном микрокусочке, уже заложены определенные меристемы. Это верхушка стебля и пазушные его почки. Для того чтобы микроклонировать растение, можно "в пробирке" "разбудить" эти спящие доселе меристемы. Достигается это либо удалением верхушечной меристемы микроросточка, вернее, его стебля, а затем черенкованием побега в технике "инвитро" либо же внедрением в питательную среду растения особых веществ, которые активизируют рост и развитие пазушных побегов. Метод активации "спящих" меристем является основным, наиболее популярным и действенным, а разработан он был еще в семидесятых годах минувшего столетия. Первым "подопытным кроликом" в применении микроклонального размножения растений подобного типа стала земляника. Важно заметить, впрочем, что бесконечно размножать культуры подобным образом запрещено, поскольку это чревато потерей способности к укоренению, а в некоторых случаях – гибелью растения.
Второй. Появление адвентивных почек силами самого растения
У любой изолированной части растения есть поистине волшебная способность, своя суперсила. Если при микроклональном размножении питательная среда растения и все прочие условия жизни благоприятны и комфортны, то оно может восстанавливать недостающие части. Происходит своеобразная регенерация - ткани растения образуют адвентивные, или придаточные почки - то есть такие, что возникают как бы "из старых запасов", а не из новых тканей. Такие почки необычны тем, что появляются, как правило, в тех местах, откуда их возникновения никак не ждешь - на корнях, к примеру. Именно подобным способом часто размножают многие цветы, опять же - землянику. Это второй по популярности и действенности метод микроклонального размножения растений.
Третий. Соматический эмбриогенез
Активно подобным методом микроклонального размножения растений пользуются при размножении масличной пальмы. Все дело в том, что, поскольку у нее нет ни побегов, ни боковых ростков, вегетативное размножение ее невозможно (ну или, во всяком случае, весьма и весьма затруднительно), как невозможно и черенкование. Таким образом, вышеуказанная методология единственная из всех наиболее доступна и оптимальна при работе с данным растением.
Четвертый. Работа с каллусной тканью
Данный метод из всех четырех вышеприведенных является, пожалуй, наименее востребованным. В первую очередь, это связано с тем, что слишком частое разделение клеток каллусной ткани способно привести к генным нарушениям и мутациям разного уровня. Поскольку сохранение генотипа очень важно для микроклонального размножения, и культура тканей должна соблюдаться на высшем уровне. Кроме того, при вышеуказанных нарушениях проявляются и иные недостатки: низкорослость, восприимчивость к болезням и так далее. Впрочем, в некоторых случаях исключительно подобным способом и возможно размножение – например, для сахарной свеклы иного метода попросту не подобрать.
Далее мы для примера скажем пару слов о клонировании конкретных растений, но прежде –нужно поделиться информацией об оздоровлении растений, использующихся в качестве посадочного материала. Каким образом этого можно добиться?
Оздоровление
О клонировании картофеля

При микроклональном размножении картофеля его выращивают в пробирках по два черенка, пробирки помещаются под свет люминесцентных ламп силой от шести до восьми тысяч люкс, температура сохраняется ночью в пределах восемнадцати градусов, днем – приблизительно двадцать пять. В России именно картофель выращивают с помощью клонирования наиболее активно.
О клонировании яблони: что нужно знать
В микроклональном размножении яблони широко применяется первый способ – размножение с помощью пазушных почек. Отмечается высокая способность данной культуры к укоренению и приживаемость большего количества эксплантов.

Их помещали в жидкую питательную среду, которая постоянно – ежедневно – обновлялась. Температура для пробирочных растений также поддерживалась на уровне двадцати пяти градусов днем, эксперимент проводился в течение трех-четырех недель.
Интересные факты

Такова информация о микроклональном размножении растений – теме насколько сложной, настолько и интересной.

Микроклональное размножение растений

Микроклональное размножение растений
ЦО: описать методы микроклонального размножения растений
Эксплант Группа клеток, отделенная от материнского организма

Группа клеток, отделенная от материнского организма. Используется в биологических исследованиях, связанных с микроклональным размножением растений. У двудольных растений, эксплантами могут являться, например, части гипокотилей, стеблей, корней, семядоли, пыльники и прочее. При культивировании эксплантов на питательных средах различного состава, можно наблюдать каллусогенез или органогенез (образование корней, побегов и пр.)
Области применения клонального микроразмножения в селекции для поддержания и размножения растений с уникальными генотипами; для быстрого размножения новых и уже существующих сортов; массового получения оздоровленного…

Области применения клонального микроразмножения
в селекции для поддержания и размножения растений с уникальными генотипами;
для быстрого размножения новых и уже существующих сортов;
массового получения оздоровленного посадочного материала у растений, подверженных вирусным заболеваниям;
для быстрого размножения некоторых гетерозиготных садовых культур, обычно размножающихся семенами и расщепляющихся при скрещивании;
для быстрого клонального размножения in vitro лучших экземпляров взрослых древесных растений, разведение и селекция которых осуществляется медленно вследствие длительности процесса полового размножения;
для сохранения редких и исчезающих видов.
Каллус Недифференцированные клетки, являющиеся тотипотентными и способными поэтому дать начало целому растению

Недифференцированные клетки, являющиеся тотипотентными и способными поэтому дать начало целому растению. Являются объектом генетической инженерии.
Тотипотентность клетки Свойство клетки под влиянием экзогенных воздействий давать начало целому растительному организму

Свойство клетки под влиянием экзогенных воздействий давать начало целому растительному организму
Адвентивные побеги Адвентивные побеги — побеги, которые образуются на любом участке стебля, корня или листа
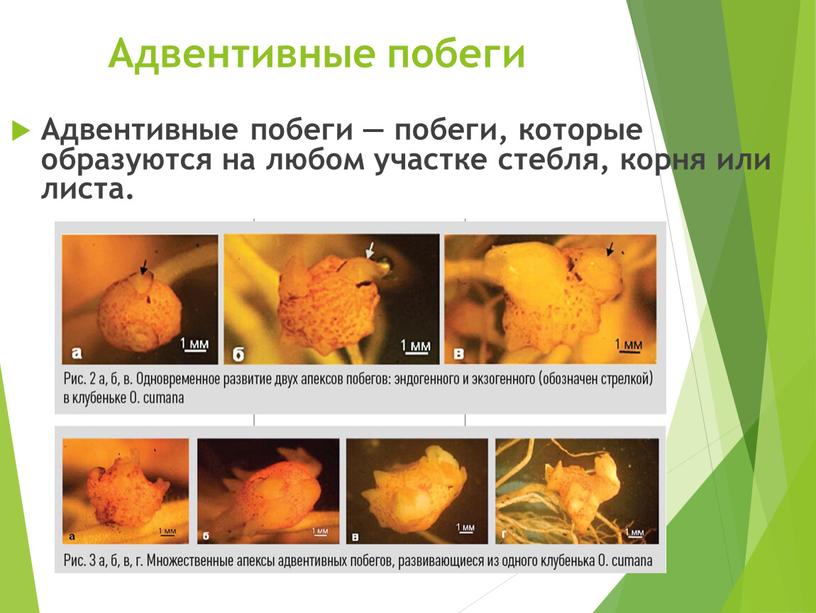
Адвентивные побеги — побеги, которые образуются на любом участке стебля, корня или листа.
Индукция соматического эмбриогенеза
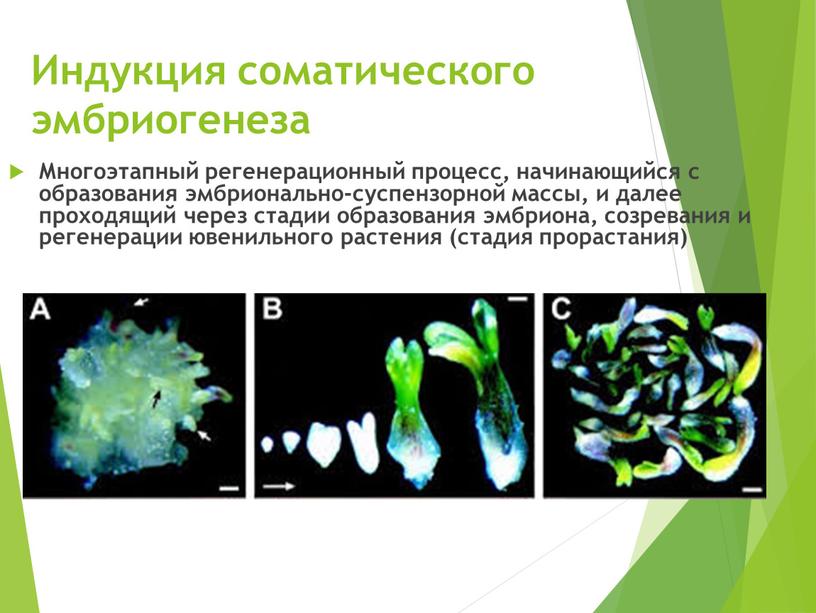
Индукция соматического эмбриогенеза
Многоэтапный регенерационный процесс, начинающийся с образования эмбрионально-суспензорной массы, и далее проходящий через стадии образования эмбриона, созревания и регенерации ювенильного растения (стадия прорастания)
Методы микроклонального размножения

Методы микроклонального размножения
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному.
В основе получения таких растений лежит способность соматических клеток растений полностью реализовать свой потенциал развития, т.е. свойство тотипотентности.
Первый и основной метод – активизация пазушных меристем
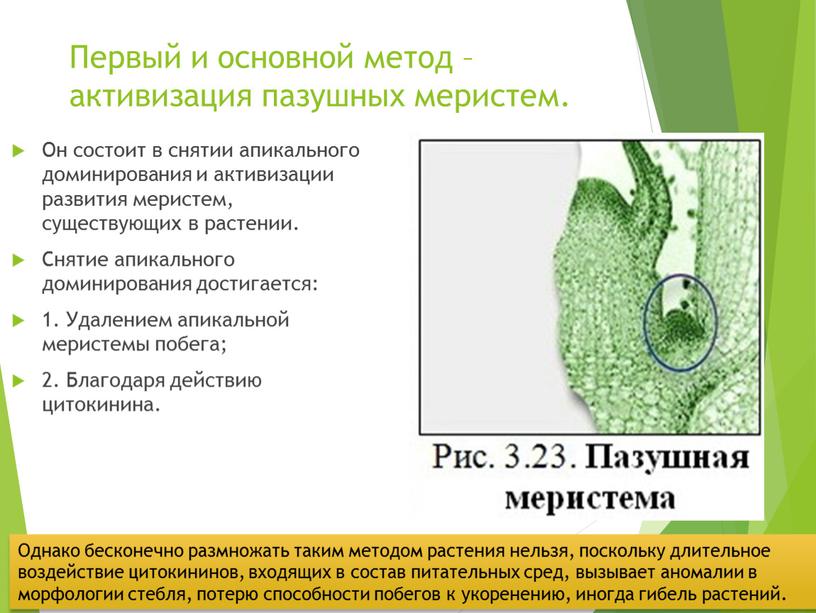
Первый и основной метод – активизация пазушных меристем.
Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении.
Снятие апикального доминирования достигается:
1. Удалением апикальной меристемы побега;
2. Благодаря действию цитокинина.
Однако бесконечно размножать таким методом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда гибель растений.
Метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис

Метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис. 3.24.
Презентация микроклональное размножение
Презентация микроклональное размножение
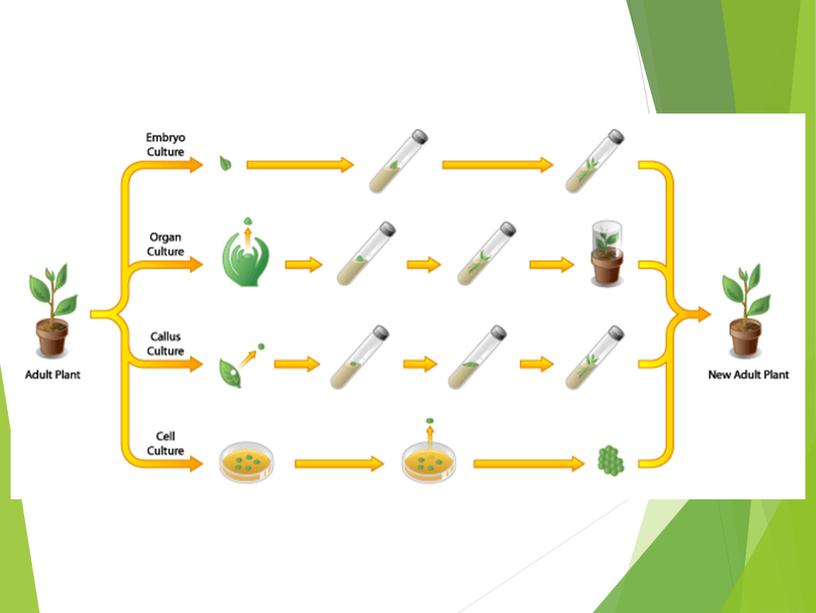
Преимущества получение генетически однородного посадочного материала; освобождение растений от вирусов за счет использования меристемной культуры; высокий коэффициент размножения сокращение продолжительности селекционного процесса; ускорение перехода растений…

получение генетически однородного посадочного материала;
освобождение растений от вирусов за счет использования меристемной культуры;
высокий коэффициент размножения
сокращение продолжительности селекционного процесса;
ускорение перехода растений от ювенильной к репродуктивной фазе развития;
размножение растений, трудно размножаемых традиционными способами;
возможность проведения работ в течение всего года;
возможность автоматизации процесса выращивания.
Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения: высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104…

Этот метод имеет ряд преимуществ перед существующими традиционными способами размножения:
высокий коэффициент размножения (105–106 – для травянистых, цветочных растений, 104–105 – для кустарниковых древесных, 104 – для хвойных);
возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
получение генетически однородного посадочного материала;
освобождение растений от вирусов за счет использования меристемной культуры;
ускорение перехода растений от ювенильной к репродуктивной фазе развития;
сокращение продолжительности селекционного процесса;
получение растений, трудно размножаемых традиционными способами;
возможность автоматизации процесса выращивания.
Процесс клонального микроразмножения можно разделить на несколько этапов: 1 – й этап 2–й этап 3–й этап 4–й этап
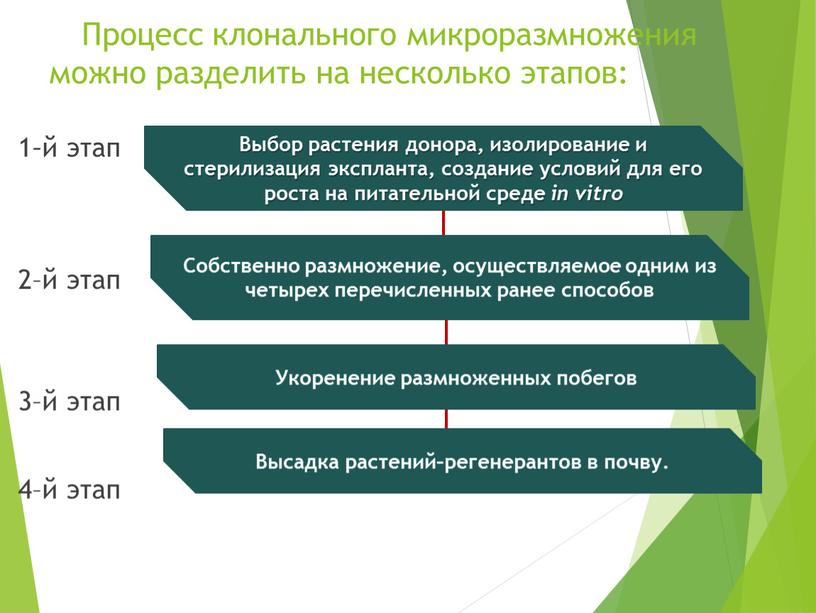
Процесс клонального микроразмножения можно разделить на несколько этапов:
Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо
Собственно размножение, осуществляемое одним из четырех перечисленных ранее способов
Укоренение размноженных побегов
Высадка растений–регенерантов в почву.
Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо

Выбор растения донора, изолирование и стерилизация экспланта, создание условий для его роста на питательной среде in vitrо
Требования
Получения хорошо растущей стерильной культуры.
Используют среду МС, с различными биологически активными веществами и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. Продолжительность первого этапа – от 1 до 2 месяцев.
Собственно размножение, осуществляемое одним из четырех перечислен-ных ранее способов

Собственно размножение, осуществляемое одним из четырех перечислен-ных ранее способов
Требования
Используют питательную среду МС с оптимальным соотношением и концентраций цитокининов (БАП - 1 - 10 мг/л) и ауксинов (ИУК и НУК - до 0,5 мг/л).
Не допускается культивирование растительных тканей в питательных средах с повышенным содержанием цитокининов (10 мг/л), т.к. происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к формированию растений с измененной морфологией.
Укоренение размножен-ных побегов

Укоренение размножен-ных побегов
Требования
Замена основного состава среды. Уменьшение в 2-4 раза концентрации минеральных солей в среде МС, снижение концентрации сахара до 0,5–1 % и полное исключение цитокининов (оставляют лишь ауксины). В качестве стимулятора корнеобразования используют ИМК, ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
- выдерживание микропобегов в течение 2–24 ч в стерильном концентрированном растворе ауксина (20–50 мг/л) с последующим их культивированием на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
- культивирование микропобегов в течение 3–4 недель непосредственно на питательной среде, содержащей ауксин в невысоких концентрациях (1–5 мг/л).
Высадка растений–регенерантов в почву

Высадка растений–регенерантов в почву.
Требования
Время для пересадки пробирочных растений – весна или начало лета. Растения с двумя–тремя листьями и хорошо развитой корневой системой вынимают из колб или пробирок пинцетом.
Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85–90 °С в течение 1–2 ч. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20–22 °С), освещенностью не более 5 тыс. лк и влажностью 65–90 %.
Для лучшего роста растений создают условия искусственного тумана или горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами.
Читайте также:

