Кислоты как электролиты доклад
Обновлено: 23.04.2024
Электролиты чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат электролит. Важный класс электролитов - полиэлектролиты.
Электролиты являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы электролитов. Благодаря им возможно создания новых химических источников тока и совершенствования технологических процессов разделения веществ - экстракции из растворов и ионного обмена.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов.
Сила электролита в значительной степени зависит от природы растворителя. Мерой воздействия растворителя является диэлектрическая проницаемость, значение которой для воды весьма высока и при 20 градусах равно 81. Именно для воды свойство ослаблять химические связи между ионами особенно сильно.
Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.
Цель данного реферата дать определение понятию электролиты, выявить их свойства и различия, а также подробно рассмотреть диссоциации кислот, оснований и солей.
Электролитическая диссоциация.
Одним из важнейших факторов растворимости являются силы межмолекулярного взаимодействия возникающие между частицами растворенного вещества и молекулами растворителя. В ряде случаев действие этих сил приводит к тому, что дробление веществ на мельчайшие частицы в растворе идет дальше и растворение сопровождается диссоциацией молекул на ионы. Например:
Представьте, что газообразный хлористый водород попадает в воду и начинает взаимодействовать с молекулами растворителя. При этом молекулы HCl связываются с молекулами воды силами межмолекулярного взаимодействия. Обобщенно такой процесс называется гидратацией, а связанные с HCl молекулы воды – гидратной оболочкой.
В случае с раствором хлороводорода (соляная кислота) дальнейшая гидратация молекул HCl приводит к разрыву связи H–Cl и образованию в растворе гидратированных подвижных ионов H + (водн) и Cl – (водн). Ионы несут электрический заряд – положительный и отрицательный. Раствор, в котором теперь присутствуют подвижные ионы, становится электропроводным. Поэтому процесс распада вещества в растворе на ионы называется электролитической диссоциацией.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы.
Теорию электролитической диссоциации в 80-х годах XIX века предложил выдающийся шведский химик Сванте Аррениус (1859-1927). Сегодня нам кажется вполне естественным, что растворенные вещества могут распадаться на ионы. Мы знаем, почему устойчивы именно такие, а не другие ионы – это знание опирается на современные представления о строении атомов. Например, элемент Na (электронная оболочка 1s 2 2s 2 2p 6 3s 1 ) может существовать в виде устойчивого катиона Na + , имеющего уже электронную оболочку чрезвычайно стабильной частицы – атома инертного газа неона (1s 2 2s 2 2p 6 ). В отличие от нейтрального атома неона, заряженная частица Na + хорошо взаимодействует с молекулами полярного растворителя – воды. Анион Cl – имеет электронную оболочку инертного газа аргона (…3s 2 3p 6 ). Таким образом, на процесс диссоциации влияет не только взаимодействие ионов с растворителем, но и фактор устойчивости самих ионов.
По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H + и Cl – . Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота).
Однако вполне похожее соединение – фтороводород HF – не проявляет свойств сильного электролита и в растворе ток проводит плохо. Здесь, наоборот, в уравнении диссоциации нужна более длинная обратная стрелка:
Константа и степень диссоциации.
В месте с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд:
Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H + и Cl – в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало.
Напротив, Кд фтороводорода намного меньше единицы (ее значение уже можно определить более точно – см. следующий параграф). Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H + и F – .
Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества.
Помимо константы диссоциации, мерой силы электролита может служить степень диссоциации α. Это отношение числа распавшихся на ионы молекул (n1) к общему числу молекул (n0), изначально попавших в раствор:
сильные электролиты – α близка к 1 (или 100%);
слабые электролиты – α около 0,01 (1% и менее).
Поскольку вода – полноправный участник процесса диссоциации, ее иногда включают в химическое уравнение. Например, для уксусной кислоты процесс ее диссоциации в воде можно записать так:
Такие уравнения как бы подчеркивают, что ионы в водном растворе не изолированы, а связаны с молекулами растворителя. Для иона Н + это взаимодействие очень характерно: благодаря его связыванию с не поделенной электронной парой атома кислорода молекулы Н2О образуется достаточно прочный комплекс Н2О---Н + или, как его условно называют, ион гидроксония Н3О + . Конечно, молекулы воды взаимодействуют и с анионом CH3COO – (и любыми другими анионами), но это обстоятельство в уравнениях диссоциации обычно не отражают просто по традиции (и чтобы не загромождать уравнения).
Поскольку к процессу диссоциации применим принцип Ле Шателье, последнее уравнение указывает нам на еще одну важную закономерность: если разбавлять раствор уксусной кислоты, т.е. добавлять в него воду, то по принципу Ле Шателье должен активизироваться процесс, связанный с расходованием воды, т.е. прямая реакция (распад на ионы). В этом случае в растворе должен активизироваться процесс образования ионов из молекул. Иными словами, при разбавлении растворов слабых электролитов степень диссоциации возрастает.
Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10 –5 . Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α 2 С. Отсюда:
Подставляя в эту формулу численные значения, получим:
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Диссоциация кислот, оснований, солей.
При диссоциации кислот роль катионов играют ионы водорода (H + ), других катионов при диссоциации кислот не образуется:
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляет кислотный остаток.
одноосновные кислоты: HCl, HF, HNO3;
двухосновные кислоты: H2SO4, H2CO3;
трехосновные кислоты: H3PO4.
Ступенчатая диссоциация двухосновной кислоты:
Ступенчатая диссоциация трехосновной кислоты:
При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй - 0,15%; третьей - 0,005%.
При диссоциации оснований роль анионов играют гидроксид-ионы (ОH - ), других анионов при диссоциации оснований не образуется:
однокислотные основания - KOH, NaOH;
двухкислотные основания - Ca(OH)2;
трехкислотные основания - Al(OH)3.
ZnOH + ↔ Zn 2+ + OH -
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными.
Диссоциация Zn(OH)2, как основания:
ZnOH + ↔ Zn 2+ + OH -
Диссоциация Zn(OH)2, как кислоты:
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Нормальные (средние) соли получаются полным одновременным замещением всех атомов водорода в кислоте на атомы металла - это сильные электролиты, полностью диссоциируют в воде с образованием катоинов металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
Кислые соли содержат в своем составе кроме атомов металла и кислотного остатка, еще один (несколько) атомов водорода - диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
Основные соли содержат в своем составе кроме атомов металла и кислотного остатка, еще одну (несколько) гидроксильных групп - диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
Mg(OH)Cl ↔ Mg(OH) + + Cl -
Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
CaClBr ↔ Ca 2+ + Cl - + Br -
Заключение.
Итак, подведем итоги: Электролитами называют вещества, растворы и сплавы которых с другими веществами электролитически проводят гальванический ток.
Признаком электролитической проводимости в отличии от металлической должно считать возможность наблюдать химическое разложение данного вещества при более или менее продолжительном прохождении тока. В химически чистом состоянии электролиты обыкновенно обладают ничтожно малой электропроводностью.
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например электролит золочения)
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. В источниках тока электролит может находиться в жидком состоянии (обычно это водный раствор) или загущённым до состояния геля.
В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки — металлическая фольга (алюминий) или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких конденсаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки.

Электролиты – вещества, расплавы или растворы которых проводят электрический ток. К электролитам относятся кислоты, основания и большинство солей.
Диссоциация электролитов
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. Первые в виде ионов существуют еще до перевода их в растворенное или расплавленное состояние. К электролитам относятся соли, основания, кислоты.
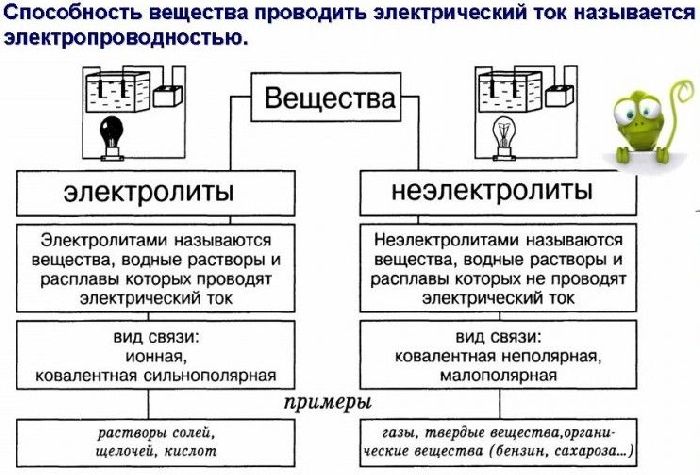
Рис. 1. Таблица отличие электролитов от неэлектролитов.
Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся: почти все растворимые соли, многие неорганические кислоты (например, H2SO4, HNO3, HCl), гидроксиды щелочных и щелочноземельных металлов. Слабые электролиты при растворении в воде незначительно диссоциируют на ионы. К ним относятся почти все органические кислоты, некоторые неорганические кислоты (например, H2CO3), многие гидроксиды (кроме гидроксидов щелочных и щелочноземельных металлов).
Рис. 2. Таблица сильные и слабые электролиты.
Вода также является слабым электролитом.
Как и другие химические реакции, электролитическую диссоциацию в растворах записывают в виде уравнений диссоциации. При этом для сильных электролитов рассматривают процесс как идущий необратимо, а для электролитов средней силы и слабых – как обратимый процесс.
Кислоты – это электролиты, диссоциация которых в водных растворах протекает с образованием ионов водорода в качестве катионов. Многоосновные кислоты диссоциируют ступенчато. Каждая следующая ступень идет все с большим и большим трудом, так как образующиеся ионы кислотных остатков являются более слабыми электролитами.
Основания – электролиты, диссоциирующие в водном растворе с образованием гидроксид-иона ОН- в качестве аниона. Образование гидроксид-иона является общим признаком оснований и обуславливает общие свойства сильных оснований: щелочной характер, горький вкус, мылкость на ощупь, реакцию на индикатор, нейтрализацию кислот и т. д.
Щелочи, даже малорастворимые (например, гидроксид бария Ba(OH)2) диссоциируют нацело, пример:
Соли – это электролиты, диссоциирующие в водном растворе с образованием катиона металла и кислотного остатка. Соли диссоциируют не ступенчато, а нацело:
Теория электролитической диссоциации
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов.
Теория электролитической диссоциации (С. Аррениус, 1887) в современном понимании включает следующие положения:
- электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные (катионы) и отрицательные (анионы). Ионизация происходит легче всего для соединений с ионной связью (солей, щелочей), которые при растворении (эндотермический процесс разрушения кристаллической решетки) образуют гидратированные ионы.
Гидратация ионов – экзотермический процесс. Соотношение затраты и выигрыша энергии определяет возможность ионизации в растворе. При растворении вещества с полярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов. Этот процесс является обратимым и может идти как полностью, так и частично.
- гидратированные ионы устойчивы, беспорядочно передвигаются в растворе. Под действием электрического тока движение приобретает направленный характер: катионы движутся к отрицательному поясу (катоду), а анионы – к положительному (аноду).
- диссоциация (ионизация) – обратимый процесс. Полнота ионизации зависит от природы электролита (соли щелочи диссоциируют практически нацело), его концентрации (с увеличением концентрации ионизация идет труднее), температуры (повышение температуры способствует диссоциации), природы растворителя (ионизация происходит только в полярном растворителе, в частности, в воде).
Что мы узнали?
Электролиты – это соли, кислоты, основания, способные проводить электрический ток. Электролиты бывают сильные и слабые. Также в статье приводится информация кратко о соединениях электролитов.

Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые . Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые) . Подробно про классификацию кислот можно прочитать здесь.


1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например , оксид серы (VI) реагирует с водой с образованием серной кислоты:
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например , хлор реагирует с водородом:
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз раствора сульфата меди (II):
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например , соляная кислота диссоциирует почти полностью:
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
Например , сернистая кислота диссоциирует в две ступени:
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами .
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например , гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.

Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.

4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например , уксусная кислота взаимодействует с гидроксидом алюминия:

5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например , йодоводород можно окислить хлоридом меди (II):
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит . Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода

Например , соляная кислота взаимодействует с нитратом серебра в растворе:
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей .
Например , карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например , гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например , гидроксокарбонат меди (II) растворяется в серной кислоте:
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например , гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:

При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например , железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

9 класс
Химические свойства кислот как электролитов
Выполнила: учитель химии ГБОУ СОШ №443 Жирова Ю.А.- первая категория
9-й урок

Из списка выберите кислоты
Na2SO4, LiOH, HNO2 , Na2O, H3PO4, SO3, Н2СО3 , Са(ОН)2, ВаО, H2SiO3
Вспомним! Кто такие кислоты?

HNO2, H3PO4, Н2СО3 , H2SiO3
Вспомним! Кто такие электролиты?

HnAcd = nH+ + Acdn-
Вспомним! Общее уравнение электролитической диссоциации?
Где:
Acd – кислотный остаток
Кислоты - это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотных остатков.

Общие химические свойства кислот
1. Обладают кислым вкусом
2. Изменяют окраску индикаторов

лакмус
метилоранж
фенолфталеин
Действие кислот на индикаторы

Химические свойства кислот

3. Взаимодействие с основаниями с образованием соли и воды
ОПЫТ

Запишем уравнения проведённых реакций
2NaOH + H2SO4 = Na2SO4 + 2H2O
Запись уравнения реакций с помощью формул веществ называют молекулярным уравнением
реакции

Однако, в растворе вещества диссоциируют на ионы и взаимодействия происходят между ионами
Перепишем молекулярное уравнение следующим образом:
формулы сильных электролитов запишем в виде ионов,
а формулы неэлектролитов оставим в молекулярном виде

2Na+ + 2OH-
2NaOH + H2SO4 = Na2SO4 + 2H2O
+ 2H+ +SO4 2- =
2Na+ +2SO42-
+ 2H2O
Такую запись называют полным ионным уравнением
реакции

2Na+ + 2OH- + 2H+ +SO4 2- = 2Na+ +2SO42- + 2H2O
2OH- + 2H+ = 2H2O
Таким образом получают сокращенное ионное уравнение
реакции

2OH- + 2H+ = 2H2O
Катион водорода взаимодействует с гидроксид-анионами с образованием воды
Это значит, что протекает реакция
нейтрализации
кислотная
среда
щелочная
среда
нейтральная
среда

Реакции обмена, протекающие в растворах с участием сильных электролитов, называют реакциями ионного обмена.

Взаимодействие кислот с нерастворимым основанием
ОПЫТ

М(OH)n↓ + сильная кислота (nH+ + Acdn-) → Мn+ + 2H2O
Cu(OH)2 ↓ + 2HCl = CuCl2 + 2H2O
Cu(OH)2 ↓ + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 ↓ + 2HNO3 = Cu(NO3)3 + 2H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение

Cu(OH)2↓ + 2H+ = Cu2+ + 2H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение

9 класс
Химические свойства кислот как электролитов
Выполнила: учитель химии ГБОУ СОШ №443 Жирова Ю.А.- первая категория
10-й урок

4. Взаимодействие с оксидами металлов с образованием соли и воды
ОПЫТ

MO + сильная кислота (nH+ + Acdn-) → Mn+ + 2H2O
CuO + 2HCl = CuCl2 + H2O
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HNO3 = Cu(NO3)3 + H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение

CuO + 2H+ = Cu2+ + H2O
Всем трём молекулярным уравнениям соответствует одно сокращённое ионное уравнение

5. Взаимодействие с металлами с образованием соли и водорода
Из сильных кислот по-особому взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации.

Будучи сильными электролитами, эти вещества в растворе существуют не в виде молекул, а в виде ионов:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-

M + сильная кислота (nH+ + Acdn-) → Mn+ + H2↑
Ионное уравнение этого процесса:
Zn + 2H+ = Zn2+ + H2↑

Запишите молекулярные уравнения реакций:
между цинком и соляной кислотой
между цинком и серной кислотой

Электрохимический ряд напряжений металлов
Возможность протекания такой реакции определяется положением металла в ряду активности – электрохимическом ряду напряжений металлов
Активность металлов уменьшается
Условия реакции:
1)

Условия реакции:
2)
В результате этой реакции должна образоваться растворимая соль.
Условия реакции:
3)
С металлами IA- и IIA- групп не записывают, т.к.эти металлы одновременно взаимодействуют и с водой, образуя щёлочь и водород.

6. Взаимодействие с солями с образованием другой соли и другой кислоты
Реакция между растворами электролитов возможна только в том случае, если образуется газ, осадок или слабый электролит (вода)
Правило Бертоле:

1. Выделение газа
Na2CO3 = 2Na+ + CO32-
2H+ + CO32- = H2O + CO2↑
Сокращённое ионное уравнение для всех карбонатов

2. Выпадение осадка
2H+ + SiO32- = H2SiO3 ↓
2HCl + Na2SiO3= H2SiO3 ↓ + 2NaCl

§ 6, читать до конца, упр.4-6
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 610 739 материалов в базе
Материал подходит для УМК
§ 6. Химические свойства кислот как электролитов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 10.10.2021 759
- PPTX 926.1 кбайт
- 80 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Жирова Юлия Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Время чтения: 2 минуты
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
Время чтения: 2 минуты
Минобрнауки и Минпросвещения запустили горячие линии по оказанию психологической помощи
Время чтения: 1 минута
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Читайте также:

