Химические источники энергии доклад
Обновлено: 30.06.2024
В настоящее время ХИТ используются почти во всех областях техники и народного хозяйства. Количество отдельных первичных элементов и аккумуляторов, изготавливаемых ежегодно во всем мире, исчисляется миллиардами. Это обусловлено рядом их эксплуатационных преимуществ – независимостью от посторонних источников тепла или излучения, постоянной готовностью к действию. Работают бесшумно, широкие диапазоны электрической мощности.
Современное производство ХИТ представляет собой самостоятельную отрасль электротехнической промышленности. Отдельные типы ХИТ выпускаются в массовом масштабе на высокопроизводительном оборудование при высокой степени механизации и автоматизации.
Содержимое работы - 1 файл
Курсовой ХИТ.docx
Химические источники тока (ХИТ) – это устройства, в которых энергия химической реакции непосредственно превращается в электрическую энергию.
Основу химических источников тока составляют два электрода (анод, содержащий окислитель, и катод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно- восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В настоящее время ХИТ используются почти во всех областях техники и народного хозяйства. Количество отдельных первичных элементов и аккумуляторов, изготавливаемых ежегодно во всем мире, исчисляется миллиардами. Это обусловлено рядом их эксплуатационных преимуществ – независимостью от посторонних источников тепла или излучения, постоянной готовностью к действию. Работают бесшумно, широкие диапазоны электрической мощности.
Современное производство ХИТ представляет собой самостоятельную отрасль электротехнической промышленности. Отдельные типы ХИТ выпускаются в массовом масштабе на высокопроизводительном оборудование при высокой степени механизации и автоматизации.
1 История создания
В 1836 году появление элемента Даниэля-Якоби.
Рисунок 2 – Элемент Даниэля – Якоби.
Гальванический элемента Даниэль - Якоби (рис.2) состоит из медной пластины, погруженной в раствор CuS04, и цинковой пластины, погруженной в раствор ZnS04. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Даниэля - Якоби протекают следующие процессы:
1) Реакция окисления цинка. Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) Реакция восстановления ионов меди. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
3) Движение электронов во внешней цепи;
4) Движение ионов в растворе: анионов к аноду, катионов к катоду.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, то есть электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
После создания элемента Даниэль-Якоби количество предложенных вариантов первичных элементов начало бурно расти.
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Он предложил накапливать электрическую энергию с помощью двух свинцовых пластин, погруженных в раствор серной кислоты. Дальнейшее усовершенствование свинцовых аккумуляторов связано с работами Фора, начавшего в 1881 г. наносить на свинцовые пластины пасту из оксидов свинца, и Фолькнера, в 1884 г. заменившего свинцовые гладкие пластины свинцовыми решетками.
В 1865 году французский химик Ж. Лекланшел предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В России первые аккумуляторы были изготовлены в Минном офицерском классе в Кронштадте в 1884 г. под руководством Η. Ф. Иорданского и Е. П. Тверитинова. До Великой Октябрьской социалистической революции промышленность ХИТ в России была представлена в основном мелкими предприятиями, более крупные из которых принадлежали иностранным фирмам. После Великой Октябрьской социалистической революции производство ХИТ пришлось создавать заново, и оно превратилось в крупную, хорошо развитую отрасль промышленности.
2 Основные характеристики ХИТ
Основные характеристики ХИТ — количество энергии, которое можно от них получить и напряжение, при котором они работают. Напряжение при разряде зависит от ЭДС применяемой электронной пары, от разности потенциалов электродов при отсутствии отбора от них тока, от поляризации электродов при работе (от изменений потенциалов электродов при отборе от них тока) и от падения напряжения на преодоление внутреннего омического сопротивления ХИТ. Величина ЭДС обусловлена свойствами активных материалов электродов, составом и концентрацией электролита и температурой ХИТ. С ростом температуры ЭДС, как правило, немного возрастает.
Напряжение при разряде Up:
Eполр — поляризация электродов при разряде, В;
I — сила тока при разряде, А;
r — омическое сопротивление аккумулятора, Ом.
Напряжение разряда в сильной степени зависит от конструктивных и технологических особенностей источника тока, температуры и других многочисленных факторов.
Во время разряда ХИТ при постоянном токе и при неизменных прочих условиях обычно наблюдается постепенное снижение напряжения во времени. Типичные зависимости Uр(τ) – разрядные кривые.
Довольно быстрое падение напряжения часто наблюдается в самом начале разряда (особенно у свежезаряженных аккумуляторов). В таких случаях иногда условно за начальное напряжение Uнач принимают более устойчивое значение, измеренное через установленный промежуток времени.
Падение напряжения в конце разряда может быть резким или постепенным. После достижения определенного конечного напряжения Uкон разряд приходиться прекращать, даже если при этом реагенты еще не полностью не израсходованы. Конечное напряжение выбирают в зависимости от особенностей аппаратуры потребителя. Если допустимый диапазон напряжений мал, необходимо ограничивать глубину разряда источника тока.
Удобным для расчета электрической энергии является среднее напряжение U в данных условиях разряда, которое определяется как среднее арифметическое значение напряжений, измеренных через равные интервалы времени в течение разряда:
Напряжение при заряде U3:
Поляризация при разряде возникает в силу ряда причин. Основная — это пассивация электродов, из-за которой при разряде потенциал положительного электрода становится отрицательнее, а отрицательного — положительнее, чем в отсутствие тока. Пассивация, в первую очередь, происходит из-за покрытия поверхности активных масс пленками, плохо проводящими ток. В ряде случаев (например, у железного электрода) это тончайшая пленка кислорода или оксидов, иногда пленка состоит из слоя трудно растворимых солей (например, в свинцовом аккумуляторе). Как известно из курса теоретической электрохимии, на потенциалы электродов и ЭДС влияет концентрация электролита, с которым соприкасаются электроды. При разрядах и зарядах ХИТ из-за участия ионов в химическом процессе и переносе тока часто происходит местное (локальное) изменение концентрации электролита непосредственно у поверхности электродов и в их порах. Эти изменения концентрации электродов изменяет их потенциалы: появляется концентрационная поляризация. При разряде она так же, как и пассивация, снижает напряжение ХИТ и при заряде увеличивает его. Если произошло общее изменение концентрации электролита в сосуде, то и после прекращении разряда в отсутствие тока ЭДС может быть ниже, чем была до разряда (например, в свинцовых аккумуляторах).
При заряде поляризацию, увеличение потенциалов электродов по сравнению с потенциалами в отсутствие тока, вызывают концентрационные явления (концентрационная поляризация) и необходимость преодолевать замедленный характер некоторых стадий электрохимического процесса (перенапряжение).
Чем большую плотность тока требуется создать на электродах, тем быстрее должны происходить процессы на них. Для ускорения процессов приходится затрачивать энергию, что и проявляется в возрастании потенциалов и напряжения.
Электрическая энергия, получаемая при разряде ХИТ, равна:
Максимальное количество электричества, которое ХИТ отдает при полном его разряде, называется разрядной емкостью С. Соответственно максимальная энергия, получаемая при полном разряде, называется энергозапасом. Естественно, что разрядная емкость и энергозапас зависят от количества реагентов, заложенных в источнике тока. Чем больше его количество, тем дольше может поддерживаться токообразующая реакция и тем больше емкость и энергозапас.
Под номинальной емкостью С 0 и номинальным энергозапасом понимают параметры, относящиеся к номинальному режиму разряда и гарантируемые изготовителем.
3 Типы химических источников тока
По возможности или невозможности повторного использования химические источники тока делятся:
гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
3.1 Гальванический элемент
Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. Гальванический элемент представляет собой замкнутую систему, состоящую из двух гальванических полуэлементов (гальванических пар).
Гальванические элементы – это источники тока, в которых вещества, образовавшиеся в процессе разряда, не могут быть превращены в исходные активные материалы. Поэтому ГЭ – это первичные элементы, или ХИТ одноразового действия.
Активные компоненты закладываются в них заранее, и срок работы ГЭ определяется запасом активных компонентов. После расхода активных компонентов ГЭ выходит из строя.
Типы гальванических элементов
Стремление преодолеть трудности, вызванные утечкой раствора электролита из таких элементов, как элемент Даниэля - Якоби, послужило толчком к разработке сухих элементов. Удобство таких портативных источников тока заключается в том, что все их составные части представляют собой твердые или пастообразные вещества, упаковка которых предотвращает их попадание на окружающие предметы.

Среди различных типов энергии, которые существуют, у нас есть химическая энергия. Он содержится или возникает в результате химических реакций между молекулами одного или нескольких соединений. Это внутренняя энергия, которой обладает тело, основанная на типах химических связей, которые оно имеет внутри и которая возникает между его компонентами. Эту энергию можно измерить в зависимости от количества, которое может высвободиться в результате химических реакций между ними.
В этой статье мы расскажем вам все, что вам нужно знать о химической энергии и ее важности.
Características principales

Химическая энергия всегда связана с материей, когда химические связи атомов и молекул, составляющие материю, изменяются, появляется химическая энергия. Это может произойти в присутствии источника тепла или другого вещества, которое обменивается с частицами, генерируя обычно тепло, свет или другие формы энергии, получаемые в результате реакции.
Следовательно, химическая энергия - это форма потенциальной энергии, содержащейся в химических веществах. Как только эти вещества участвуют в реакции, они будут преобразованы в другие полезные формы энергии. Так, например, работает процесс сжигания бензина и других ископаемых углеводородов.
Использование этой формы энергии может быть относительно новым в истории человечества, но его нет в мировой истории: с древних времен жизнь использовала процессы получения энергии, такие как фотосинтез и химический синтез, чтобы использовать молекулярно-химический потенциал веществ. Например, бензин преобразует химическую энергию в кинетическую при использовании в движущихся транспортных средствах.
Согласно закону сохранения энергии, энергия может быть преобразована, но не может быть создана или уничтожена. Кроме того, химическая энергия - это форма потенциальной энергии, которая используется для преобразования в другие формы энергии, которые имеют практическое применение в жизни человека, такие как световая энергия, тепловая энергия, кинетическая энергия и т. Д., Для выполнения работы.
Преимущества и недостатки химической энергетики
Этот вид энергии используется в промышленности и производстве, поскольку имеет определенные преимущества. Давайте посмотрим, в чем заключаются различные преимущества химической энергии:
- Имеет отличную производительность: Благодаря его высоким характеристикам не требуется большого количества химической энергии для получения энергии от его молекул.
- Позволяет изменить дело: Химические реакции, которые происходят при производстве этого типа энергии, могут производить различные типы веществ, которые во многих случаях могут быть использованы для получения новых материалов.
- Это позволяет повторно использовать и использовать отходы: например, биоэтанол и другие виды биотоплива образуются из органических веществ, которые без использования этого типа энергии бесполезно разлагаются.
Имейте в виду, что у этого типа энергии есть и недостатки. Давайте посмотрим, в чем заключаются различные недостатки химической энергетики:
- Он имеет побочные продукты: Это продукты, которые могут стать загрязняющими веществами, например ископаемое топливо, которое при использовании выделяет токсичные газы в атмосферу и загрязняет окружающую среду.
- Они требуют постоянных входов: мы должны иметь в виду, что для того, чтобы химическая реакция имела место, она должна иметь потребление или сгорание органических веществ, которые постоянно поддерживают химическую реакцию.
Химическая энергия пищи

Пища, которую мы едим каждый день, является идеальным примером химической энергии и ее использования. Эти продукты содержат различные органические вещества, необходимые для обеспечения нашего организма энергией, как если бы они были топливом для автомобильных двигателей.
Эти органические вещества расщепляются в нашем организме, чтобы получить глюкозу, которая окисляется во время клеточного дыхания и выделяет большое количество тепла в виде калорий для поддержания функций организма. Избыточная глюкоза превращается в жир, который служит резервом для будущих потребностей. Это тип использования химической энергии глюкоза для производства механической энергии, которую мы используем, чтобы двигаться, говорить, стоять, бегать, так далее. Они также служат для увеличения электрической энергии, используемой нейронами и позволяющей нам думать.
Виды химической энергии
Выделяют 6 основных типов реакции:
- Горение: Он используется для получения значительной части энергии, с которой работают автомобили и электричество.
- Синтез: Это энергия, которая выделяется, когда два простых вещества соединяются, чтобы сформировать более сложное.
- Простая прокрутка: атом одного вещества переходит в другое вещество.
- Двойная смена: атомы двух веществ обмениваются друг с другом.
- Разложение: сложное вещество становится более простым.
примеров

Когда мы узнаем, что такое химическая энергия и каковы ее преимущества и недостатки, пришло время увидеть некоторые из наиболее распространенных примеров:
- Ископаемое топливо: Здесь преобладают бензин, дизельное и нефтяное топливо. Все они состоят из ряда молекул, основанных на атомах углерода и водорода, чьи связи могут быть разорваны в присутствии кислорода для высвобождения большого количества энергии. Это называется горением.
- Еда: Как мы уже упоминали ранее, пища, которую мы едим, содержит глюкозу, которая может окисляться в нашем организме. Разрывая связи, мы можем получить калорийную нагрузку для поддержания энергии тела.
- Биолюминесценция: Мы знаем, что есть живые организмы, которые для выживания способны излучать свет своим телом. Например, у нас есть фонарь, который обитает в глубинах океанов и которым необходима биолюминесценция, чтобы привлекать добычу. Эта световая энергия исходит из химической энергии, которую ваше тело хранит в симбионтных отношениях с некоторыми бактериями.
- Космические путешествия: ракеты, отправляющиеся в космическое пространство для изучения Вселенной, работают через контролируемые химические реакции с различными веществами, такими как водород и жидкий кислород. Эти вещества преобразуются в огромное количество кинетической энергии, которая используется для движения ракеты.
Я надеюсь, что с этой информацией вы сможете больше узнать о химической энергии и ее характеристиках.
Содержание статьи соответствует нашим принципам редакционная этика. Чтобы сообщить об ошибке, нажмите здесь.
Химические источники тока — это устройства и приборы которые в процессе химической окислительно-восстановительной реакции выделяют напряжение. Также они называются электрохимическими, гальваническими элементами. Основной принцип действия их основан на взаимодействии химических реагентов которые вступая, в реакцию друг с другом вырабатывают электроэнергию, в виде постоянного тока. Этот процесс происходит без механического или теплового воздействия, что является основными факторами играющими превосходящую роль среди других генераторов постоянного напряжения. Химические источники тока, сокращённо ХИТ, уже давно нашли применение не только в быту, но и на производстве.
Немного истории создания ХИТ
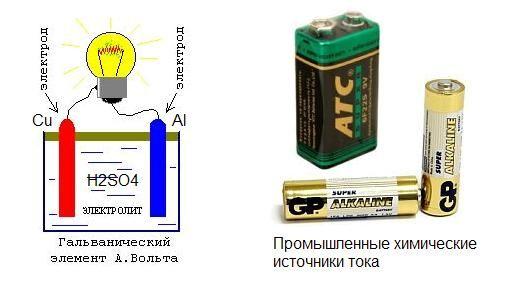
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Принцип действия
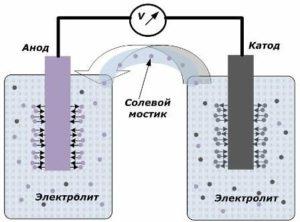
Устройства вырабатывающее электрический ток содержит два электрода, которые помещаются между электролитом. Именно на их границе соприкосновения и появляется небольшой потенциал. Один из них называют катодом, а другой анодом. Все эти элементы вместе образуют электрохимическую систему.
Во время возникновения окислительно-восстановительной реакции между электродами один элемент отдаёт мельчайшие частицы электроны другому. Поэтому она и не может происходить вечно, а со временем просто теряются свойства каждого элемента этой цепи.
Электроды могут быть представлены в виде пластин или решёток из металла. После погружения их в среду с электролитом меду их выводами возникает разность потенциалов, которая именуется напряжением разомкнутой цепи. Даже при удалении хотя бы одного из электродов с электролита процесс генерации напряжения прекращается.
Состав электрохимических систем
В качестве электролита используются следующие химические вещества:
- Водные растворы на основе щелочей, кислот, солей и т. д.;
- Растворы с ионной проводимостью на неводной основе, которые получены при растворении солей в неорганических или органических растворителях;
- Твердые соединения, содержащие ионную решетку, где один из ионов является подвижным;
- Матричные электролиты. Это особый вид жидких растворов и расплавов, которые находятся в порах твёрдого непроводящего элемента — электроносителя;
- Расплавы солей;
- Ионообменные электролиты с униполярной системой проводимости. Твёрдые тела с фиксированной ионогенной группой одного знака.
Классификация гальванических элементов и их подбор
Генераторы электрического тока получающегося во время химической реакции разделяются по:
- Размерам;
- Конструктивным особенностям;
- Способу и реагенту, за счёт которого, и получается электроэнергия.
Все элементы вырабатывающее ток во время химической реакции делятся на:
- Заряжаемые, которые в процессе эксплуатации могут неоднократно заряжаться от источника постоянного тока, они называются аккумуляторами;
- Не заряжаемые, то есть источники одноразового использования которые после завершения химической реакции просто приходят в негодность и должны быть утилизированы. Попросту это гальванический элемент или батарейка.
Для того чтобы подобрать источник электроэнергии, основанный на химической реакции, нужно понимать его характеристики, к которым относятся:
- Напряжение между анодом и катодом при разомкнутой цепи. Этот показатель чаще всего зависит от выбранной электрохимической системы, а также концентрации и вылечены всех составляющих;
- Мощность источника;
- Показатель силы тока;
- Емкость;
- Электротехнические показатели, то есть количество циклов заряда и разряда;
- Диапазон рабочих температур;
- Срок хранения между тем временем как элемент был создан и до начала его эксплуатации;
- Полный срок службы;
- Прочность, то есть защита корпуса от различных механических повреждений и влияний, а также вибраций;
- Положение работы, некоторые из них работают только в горизонтальных положениях;
- Надёжность;
- Простота в эксплуатации и обслуживании. В идеале отсутствие необходимости малейшего вмешательства в работу в течение всего срока эксплуатации.
При выборе нужной батареи или аккумулятора обязательно нужно учесть его электрические номиналы такие как напряжение и ток, а также ёмкость. Именно она является ключевой для сохранения работоспособности, подключаемого к источнику прибора.
Современные химические источники тока и их применение

Современный быт человека тяжело приставить без этих мобильных генераторов энергии, с которыми он сталкивается в течение всей жизни, начиная с детских игрушек и заканчивая, допустим, автомобилем.
Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда.
В медицине широко используются источники химической энергии при создании любого аппарата, помогающего человеку полноценно жить. Например, для слуховых аппаратов и электрокардиостимуляторов которые могут работать только от переносных источников напряжения, чтобы не сковывать человека проводами.
В производстве применяются целые системы аккумуляторных батарей для обеспечения напряжением цепей отключения и защит в случае пропадания входящего высокого напряжения на подстанциях. И также широко применяется это питание во всех транспортных средствах, военной и космической технике.
Одним из видов распространённых батарей являются литиевые источники электрического тока, так как именно этот элемент обладает высоким показателем удельной энергии. Дело в том что только этот химический элемент, оказывается, обладает сильным отрицательным потенциалом среди всех известных и изученных человеком веществ. Литий-ионные батареи выделяются среди всех остальных элементов питания по величине вырабатываемой энергии и низким габаритам, что позволяет применять их в самых компактных и мелких электронных устройствах.
Способы утилизации химических источников энергии

Проблема утилизации разных по габаритах химических источников напряжения является экологической проблемой всей планеты. Современные источники содержат в себе до тридцати химических элементов которые могут нанесите ощутимый вред природным ресурсам, поэтому для их утилизации разработаны целые программы и построены специализированные цеха по переработке. Некоторые методы позволяют не только качественно перерабатывать эти вредные вещества, но и возвращать в производство, тем самым защитив окружающую среду. В целях извлечения цветных металлов из батарей и аккумуляторов в настоящий момент разработаны и применены в цивилизованных странах, следящих и заботящихся об окружающей среде, целые пирометаллургические и гидрометаллургические комплексы. Самый же распространённый способ утилизации отработанных химических источников тока является метод, работающий на соединении этих процессов. Главным его достоинством считается высокая степень извлечения с минимальным количеством отходов.
Этот метод пирометаллургической, гидрометаллургической и механической переработки включает в себя восемь основных стадий:
- Измельчение;
- Магнитная сепарация;
- Обжиг;
- Дополнительное измельчение;
- Выделение крупных и мелких элементов с помощью грохочения;
- Водное очищение и выщелачивание;
- Сернокислотное выщелачивание;
- Электролиз.
Организация правильного сбора и утилизации ХИТ позволяет максимально уменьшить негативное влияние как на окружающую природу, так и на здоровье самого человека.


Источники тока химические (сокращенно ХИТ) — приспособления, в которых энергия окислительно-восстановительной реакции преобразуется в электрическую. Другие их названия — электрохимический элемент, гальванический элемент, электрохимическая ячейка. Принцип их действия заключается в следующем: в результате взаимодействия двух реагентов происходит химическая реакция с выделением энергии постоянного электрического тока. В прочих источниках тока процесс получения электроэнергии происходит по многоступенчатой схеме. Сначала выделяется тепловая энергия, затем она превращается в механическую и лишь после этого в электрическую. Преимущество ХИТ — одноступенчатость процесса, то есть электричество получается сразу, минуя стадии получения тепловой и механической энергий.

История
Как появились первые источники тока? Химические источники получили название гальванических элементов в честь итальянского ученого восемнадцатого века — Луиджи Гальвани. Он был врачом, анатомом, физиологом и физиком. Одним из направлений его исследований было изучение реакций животных на различные внешние воздействия. Химический способ получения электроэнергии был открыт Гальвани случайно, во время одного из опытов над лягушками. Он подсоединил к оголенному нерву на лягушачьей лапке две металлические пластины. При этом произошло мускульное сокращение. Собственное объяснение этого явления Гальвани было неверным. Но результаты его опытов и наблюдений помогли его соотечественнику Алессандро Вольта в последующих исследованиях.
Вольта изложил в своих трудах теорию возникновения электрического тока в результате химической реакции между двумя металлами при контакте с мускульной тканью лягушки. Первый химический источник тока выглядел как емкость с соляным раствором, с погруженными в него пластинами из цинка и меди.
В промышленных масштабах ХИТ начали производиться еще во второй половине девятнадцатого века, благодаря французу Лекланше, который изобрел первичный марганцево-цинковый элемент с солевым электролитом, названный его именем. Через несколько лет эта электрохимическая ячейка была усовершенствована другим ученым и являлась единственным первичным химическим источником тока до 1940 года.
Устройство и принцип работы ХИТ
Устройство химических источников тока включает в себя два электрода (проводники первого рода) и находящийся между ними электролит (проводник второго рода, или ионный проводник). На границе между ними возникает электронный потенциал. Электрод, на котором происходит окисление восстановителя называют анодом, а тот, на котором происходит восстановление окислителя, — катодом. Вместе с электролитом они составляют электрохимическую систему.
Побочным результатом окислительно-восстановительной реакции между электродами является возникновение электрического тока. Во время такой реакции восстановитель окисляется и отдает электроны окислителю, который их принимает и за счет этого восстанавливается. Присутствие между катодом и анодом электролита является необходимым условием реакции. Если просто смешать между собой порошки из двух разных металлов, никакого выделения электроэнергии не произойдет, вся энергия выделится в виде тепла. Электролит нужен, чтобы упорядочить процесс перехода электронов. Чаще всего в его качестве выступает солевой раствор или расплав.
Электроды выглядят как металлические пластины или решетки. При их погружении в электролит возникает разность электрических потенциалов между ними — напряжение разомкнутой цепи. Анод имеет тенденцию к отдаче электронов, а катод - к их принятию. На их поверхности начинаются химические реакции. Они прекращаются при размыкании цепи, а также когда израсходован один из реагентов. Размыкание цепи происходит при удалении одного из электродов или электролита.

Состав электрохимических систем
Источники тока химические в качестве окислителей используют кислородсодержащие кислоты и соли, кислород, галоиды, высшие оксиды металлов, нитроорганические соединения и т. д. Восстановителями в них являются металлы и их низшие оксиды, водород и углеводородные соединения. Как электролиты используются:
- Водные растворы кислот, щелочей, солевые и т. д.
- Неводные растворы с ионной проводимостью, полученные при растворении солей в органических или неорганических растворителях.
- Расплавы солей.
- Твердые соединения с ионной решеткой, в которой один из ионов подвижен.
- Матричные электролиты. Это жидкие растворы или расплавы, находящиеся в порах твердого непроводящего тела — электроносителя.
- Ионообменные электролиты. Это твердые соединения с фиксированными ионогенными группами одного знака. Ионы другого знака при этом подвижны. Это свойство делает проводимость такого электролита униполярной.

Гальванические батареи
Источники тока химические состоят из гальванических элементов — ячеек. Напряжение в одной из таких ячеек невелико — от 0,5 до 4В. В зависимости от потребности, в ХИТ используют гальваническую батарею, состоящую из нескольких последовательно соединенных элементов. Иногда применяется параллельное или последовательно-параллельное соединение нескольких элементов. В последовательную цепь всегда включают исключительно одинаковые первичные ячейки или аккумуляторы. Они должны иметь одни и те же параметры: электрохимическую систему, конструкцию, технологический вариант и типоразмер. Для параллельного соединения допустимо использование элементов разного типоразмера.

Классификация ХИТ
Химические источники тока отличаются по:
- размеру;
- конструкции;
- реагентам;
- природе энергообразующей реакции.
Эти параметры определяют эксплуатационные свойства ХИТ, подходящие для конкретной области применения.
Классификация электрохимических элементов основана на различии в принципе работы устройства. В зависимости от этих характеристик, различают:
- Первичные химические источники тока — элементы одноразового действия. В них имеется определенный запас реагентов, который расходуется при реакции. После полного разряда такая ячейка теряет работоспособность. По-другому первичные ХИТ называют гальваническими элементами. Верным будет и называть их просто — элемент. Самые простые примеры первичного источника питания — "батарейка" А-А.
- Перезаряжаемые химические источники тока — аккумуляторы (их также называют вторичными, обратимыми ХИТ) являются многоразовыми элементами. Путем пропускания тока от внешней цепи в обратном направлении через аккумулятор после полного разряда израсходованные реагенты регенерируются, вновь накапливая химическую энергию (заряжаясь). Благодаря возможности подзарядки от внешнего постоянного источника тока это устройство используется в течение долгого времени, с перерывами на подзарядку. Процесс выработки электрической энергии называется разрядом аккумулятора. К таким ХИТ можно отнести элементы питания многих электронных устройств (ноутбуки, мобильные телефоны и т. п.).
- Тепловые химические источники тока — приборы непрерывного действия. В процессе их работы происходит непрерывное поступление новых порций реагентов и удаление продуктов реакции.
- В комбинированных (полутопливных) гальванических элементах имеется запас одного из реагентов. Второй подается в устройство извне. Срок работы устройства зависит от запаса первого реагента. Комбинированные химические источники электрического тока используются как аккумуляторы, если есть возможность восстановления их заряда путем пропускания тока от внешнего источника.
- ХИТ возобновляемые перезаряжаются механическим или химическим путем. Для них существует возможность замены после полного разряда израсходованных реагентов на новые порции. То есть они не являются устройствами непрерывного действия, а, подобно аккумуляторам, периодически подзаряжаются.

Характеристики ХИТ
К основным характеристикам химических источников тока относятся:
- Напряжение разомкнутой цепи (НРЦ или разрядное напряжение). Этот показатель, прежде всего, зависит от выбранной электрохимической системы (сочетание восстановителя, окислителя и электролита). Также на НРЦ влияют концентрация электролита, степень разряженности, температура и другое. НРЦ зависит от значения проходящего через ХИТ тока.
- Мощность.
- Ток разряда — зависит от сопротивления внешней цепи.
- Емкость — максимальной количество электричества, которое ХИТ отдает при полном его разряде.
- Энергозапас — максимальная энергия, получаемая при полном разряде устройства.
- Энергетические характеристики. Для аккумуляторов, это, прежде всего, гарантированное количество зарядно-разрядных циклов без снижения емкости или напряжения заряда (ресурс).
- Температурный диапазон работоспособности.
- Срок сохраняемости — максимально допустимый промежуток времени между изготовлением и первым разрядом устройства.
- Срок службы — максимально допустимый общий срок хранения и работы. Для топливных элементов значение имеют сроки службы при непрерывной и прерывистой работе.
- Общая энергия, отдаваемая за весь срок службы.
- Механическая прочность по отношению к вибрации, ударам и т. п.
- Возможность работы в любом положении.
- Надежность.
- Простота в обслуживании.
Требования к ХИТ
Конструкция электрохимических элементов должна обеспечивать условия, способствующие наиболее эффективному протеканию реакции. К этим условиям относятся:
- предотвращение утечек тока;
- равномерная работа;
- механическая прочность (в том числе герметичность);
- разделение реагентов;
- хороший контакт между электродами и электролитом;
- отвод тока от зоны реакции до внешнего вывода с минимальными потерями.
Источники тока химические должны отвечать следующим общим требованиям:
- самые высокие значения удельных параметров;
- максимальный температурный интервал работоспособности;
- самое большое напряжение;
- минимальная стоимость единицы энергии;
- стабильность напряжения;
- сохранность заряда;
- безопасность;
- простота обслуживания, а в идеале отсутствие необходимости в нем;
- длительный срок службы.
Эксплуатация ХИТ
Главное преимущество первичных гальванических элементов — отсутствие необходимости какого-либо обслуживания. Перед началом их использования достаточно провести проверку внешнего вида, срока годности. При подключении важно соблюсти полярность и проверить целостность контактов прибора. Более сложные химические источники тока — аккумуляторы, требуют уже более серьезного ухода. Цель их обслуживания — максимальное продление срока службы. Уход за аккумуляторной батареей заключается в:
- поддержании чистоты;
- контроле напряжения разомкнутой цепи;
- поддержании уровня электролита (для доливки можно использовать только дистиллированную воду);
- контроле концентрации электролита (с помощью ареометра — простого прибора для измерения плотности жидкостей).
При эксплуатации гальванических элементов необходимо соблюдать все требования, относящиеся к безопасному использованию электроприборов.
Классификация ХИТ по электрохимическим системам
Виды химических источников тока, в зависимости от системы:
- свинцовые (кислотные);
- никель-кадмиевые, никель-железные, никель-цинковые;
- марганцево-цинковые, медно-цинковые, ртутно-цинковые, хлорно-цинковые;
- серебряно-цинковые, серебряно-кадмиевые;
- воздушно-металлические;
- никель-водородные и серебряно-водородные;
- марганцево-магниевые;
- литиевые и т. д.
Современное применение ХИТ
Источники тока химические в настоящее время применяются в:
- транспортных средствах;
- переносных приборах;
- военной и космической технике;
- научном оборудовании;
- медицине (электрокардиостимуляторы).
Привычные примеры ХИТ в быту:
- батарейки (сухие батареи);
- аккумуляторные батареи переносных бытовых приборов и электроники;
- источники бесперебойного питания;
- автомобильные аккумуляторы.
Особенно широкое применение получили литиевые химические источники тока. Это связано с тем, что литий (Li) обладает самой высокой удельной энергией. Дело в том, что он отличается самым отрицательным электродным потенциалом среди всех прочих металлов. Литий-ионные аккумуляторы (ЛИА) опережают все прочие ХИТ по величинам удельной энергии и рабочего напряжения. Сейчас они постепенно осваивают новую сферу — автомобильный транспорт. В дальнейшем разработки ученых, связанные с усовершенствованием литиевых элементов питания, будут двигаться в направлении сверхтонких конструкций и крупных сверхмощных аккумуляторных батарей.
Читайте также:

