Этиловый спирт доклад по химии 10 класс
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и значение в медицине. Но потребление спиртных напитков в мире характеризуется огромными цифрами, достигающими размеры экологических катастроф. От этого страдает все общество, в первую очередь под угрозу ставится подрастающее поколение: дети, подростки, молодежь, а также здоровье будущих матерей. Ведь алкоголь особенно активно влияет на несформировавшийся организм, постепенно разрушая его. Проблема употребления алкоголя очень актуальна в наши дни.
Объектом нашего исследования стал этиловый спирт
Проблема: спирт друг или враг?
Предмет исследования: этанол
Гипотеза: этиловый спирт имеет широкое применение, но при неразумном его использовании может быть вреден
Целью данного исследования стало: изучить вредное воздействие спирта на различные органы и системы органов живых организмов
Для достижения цели были поставлены следующие задачи:
1. Изучить литературу и Интернет-ресурсы о спиртах.
2. Познакомиться с историей появления и изучения спиртов.
3. Из источников информации выявить воздействие спирта на живые организмы.
4. Обобщить полученные данные и сделать выводы.
В глубокой древности познакомился человек с необычным веселящим действием некоторых напитков. Самое обычное молоко, мед, соки плодов, постояв на солнце, меняли не только свой внешний вид, вкус, но приобретали способность возбуждать, вселять ощущение легкости, беззаботности, благополучия.
К сожалению, печальные последствия употребления спиртного привлекали к себе меньше внимания, чем улучшения настроения, сопутствующее употреблению алкоголя. Понять людям спирт враг или друг - главная задача нашего проекта.
Историческое происхождение.
Виноделие зародилось в древнем Египте, когда люди обнаружили, что виноградный сок быстро скисал, но перебродив, долго сохранялся, не портясь.
Этиловый спирт – это органическое соединение, относящееся к классу спиртов.
Спиртами (устар. алкого́ли, англ. alcohols; от лат. spiritus - дух) называют производные углеводородов, в молекулах которых один или несколько атомов водорода, замещены гидроксильными группами.
Гидроксильная группа – OH является функциональной группой спиртов.
По своим физическим свойствам этанол - бесцветная жидкость со слабым запахом и жгучим вкусом. Легче воды, с водой смешивается во всех отношениях .Легко воспламеняется и горит слабо светящимся голубоватым пламенем. Кипит при температуре 78,39 °C
В соответствии с современными воззрениями, этиловый спирт относят к ксенобиотикам – веществам, которые не содержатся в человеческом организме, но влияют на его жизнедеятельность:
Спирт – это лекарственное средство, имеющее дезинфицирующее и антибактериальное действие.
Спирт – это яд, нарушающий естественные биологические процессы, разрушающий внутренние органы и психику и при чрезмерном употреблении влекущий смерть.
Применение этанола
Этиловый спирт широко используют в различных областях промышленности и прежде всего в химической. Из него получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы.; широко применяется как растворитель в лакокрасочной промышленности. Является компонентом антифриза и стеклоомывателей.
Еще одна область широкого применения - это медицина. Этиловый спирт 95 % в данном случае используется чаще всего, ведь он обладает прекрасными антисептическими свойствами, поэтому используются для обработки операционного поля или в некоторых методиках обработки рук хирурга; а также растворяет многие вещества, что позволяет с его помощью делать эффективные настойки, микстуры и прочие препараты. Кроме того, при хранении анатомических препаратов также используется спирт этиловый медицинский.
Парфюмерия и косметика
Спирты довольно широко используются в качестве душистых веществ для составления композиций в парфюмерно-косметической промышленности.
В пищевой промышленности является основой всех алкогольных напитков. Кроме того, этиловый спирт используется в качестве компонента (растворителя) некоторых пищевых и ароматических эссенций (ароматизаторов), широко используемых в кулинарии, при выпечке кондитерских изделий, производстве шоколада, конфет, напитков, мороженного, варений, желе, джемов, конфитюров и пр. Этиловый спирт уже давно используют в качестве пищевой добавки – Е1510.
Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.
Применение в новых технологиях. Все чаще в последние годы говорят об использовании этанола в качестве топлива для ракетных двигателей, двигателей внутреннего сгорания в чистом виде.
Этанол и воздействие на организм.
О том, что алкоголь оказывает отрицательное влияние на нервную систему и мозг, было известно давно. Один из крупнейших мыслителей древности Аристотель, много веков тому назад писал, что “пьянство – добровольное безумие”.
Этиловый спирт — сильный наркотик. Попадая в организм, он быстро всасывается в кровь и приводит организм в возбужденное состояние, при котором человеку трудно контролировать свое поведение. Человек становится более раздражительным, теряет присущее ему ранее чувство ответственности.
Из внутренних органов так же страдают печень, желудок, сердце, репродуктивная система. В экспериментальной части нашей работы мы провели исследования действия этанола на клетки, органы и системы органов.
Опыт 1. Воздействие этанола на печень
В пробирку налил 5 мл этанола и опустил в него кусочек свежей куриной печени. Через 3 минуты наблюдал изменение окраски тёмно - коричневого цвета печени до белого.
Вывод: этанол разрушает эритроциты и клетки тканей печени (обжигает, сваривает). В организме происходит окисление этанола в уксусный альдегид, а затем в уксусную кислоту и конечное образование СО2 и Н2О с выделением энергии. В этом состоит обманчивое впечатление, что спирт согревает. В результате образуется вещество (альдегид), которое в несколько раз более ядовито, чем сам спирт!
Опыт 2. Воздействие этанола на сердечно - сосудистую систему
В пробирку налил 2 мл дихромата калия, подкисленного двумя каплями серной кислоты, добавил в неё столько же этанола. Опустил в неё кусочек куриного сердца. Через 5 минут наблюдал изменение окраски тканей сердца, появление резкого запаха.
Вывод: этанол разрушает упругую структуру сердечной мышцы. Этот процесс усложняется еще и тем, что даже после однократного применения спирта, сердце подвергается неоднократной алкогольной атаке. Потому что алкоголь содержится в крови, а газообмен происходит в легких посредством крови, которая проходит через сердце.
Опыт 3. Воздействие спирта на пищеварительную систему (денатурация мышечных белковых волокон под воздействием спирта)
Опыт. Опустите по кусочку мяса в крепкие растворы этанола и этанола с поваренной солью. Что произойдёт с мясом через 5 мин?
Вывод: этанол разрушает волокна желудка (идёт денатурация белка). Поваренная соль усиливает этот процесс .Поэтому очень вредно употреблять алкогольные напитки с солеными продуктами (пиво и чипсы, орешки).
Опыт 4. Воздействие этанола на репродуктивную систему
В 3 пробирки налил по 4 мл раствора куриного белка (известно, что цитоплазма половых клеток содержит значительное количество белка) . Пробирку № 1 оставил для контроля, пробирку № 2 нагрел до кипения, в пробирку № 3 добавил этанола.
Вывод: этанол, как и высокая температура, разрушает белок. Яйцеклетки закладываются у девочек ещё в утробе матери. Тем более опасным становится употребление беременной женщиной алкогольных напитков.
В зависимости от концентрации и способов применения спирт может быть и врагом и другом. Найдя необходимую литературу и изучив её, мы узнали много интересного о этаноле; историю его появления, значение в пищевой и химической промышленности, и какой огромный вред он может приносить людям. Алкоголь распадается в организме до конечных продуктов – углекислого газа и воды – только при крайне незначительном потреблении этанола, примерно 20г. в сутки. Введение небольшого количества (до 20г.) спирта в организм приводит к расширению кожных кровеносных сосудов, что используется издавна при переохлаждениях.
Если превысить эту дозу, то в организме в целом и в печени в частности неизбежно накапливается избыток самого алкоголя и его продуктов распада. А это ведет к побочным и весьма нежелательным процессам:
- накопление в организме ацетальдегида вызывает тошноту, рвоту, головную боль, чувство страха;
- разрушению нервных клеток (100г. выпитого алкоголя вызывает гибель 33 000 нейронов);
- поражению печени (цирроз);
- снижению и утрате репродуктивной функции (импотенции);
- дегенеративным изменениям генетического аппарата.
В большинстве случаев спирт лучше применять наружно. В зависимости от количества выпитого алкоголя вы рискуете уподобиться, по утверждению восточных мудрецов, животным:
и, наконец, свинье.
Жизнь прекрасна и удивительна, и, к сожалению, коротка настолько, что не стоит пропускать ее прекрасные мгновенья, смотря на все вокруг мутным взглядом.
Спирты — сложные органические соединения, углеводороды, обязательно содержащие один или несколько гидроксилов (групп ОН—), связанных с углеводородным радикалом.
История открытия
По мнению историков, уже за 8 веков до нашей эры человек употреблял напитки, содержащие этиловый спирт. Их получали методом сбраживания фруктов или меда. В чистом виде этанол был выделен из вина арабами примерно в VI-VII веках, а европейцами — на пять столетий позже. В XVII веке перегонкой древесины был получен метанол, а в XIX веке химики установили, что спирты — это целая категория органических веществ.
Классификация
— По количеству гидроксилов спирты делят на одно-, двух-, трех-, многоатомные. Например, одноатомный этанол; трехатомный глицерин.
— По тому, с каким числом радикалов связан атом углерода, соединенный с группой ОН—, спирты разделяют на первичные, вторичные, третичные.
— По характеру связей радикала спирты бывают предельными, непредельными, ароматическими. В ароматических спиртах гидроксил связан не напрямую с бензольным кольцом, а через другой (другие) радикалы.
— Соединения, в которых ОН— прямо связана с бензольным циклом, считаются отдельным классом фенолов.
Свойства
В зависимости от того, сколько в молекуле углеводородных радикалов, спирты могут быть жидкими, вязкими, твердыми. Водорастворимость уменьшается с ростом количества радикалов.
Простейшие спирты смешиваются с водой в любых пропорциях. Если же в молекулу входит более 9 радикалов, то вообще не растворяются в воде. Все спирты хорошо растворяются в органических растворителях.
— Спирты горят, выделяя большое количество энергии.
— Вступают в реакции с металлами, в результате чего получаются соли — алкоголяты.
— Взаимодействуют с основаниями, проявляя качества слабых кислот.
— Реагируют с кислотами и ангидридами, проявляя оснóвные свойства. Результатом реакций являются сложные эфиры.
— Воздействие сильными окислителями приводит к образованию альдегидов или кетонов (в зависимости от вида спирта).
— При определенных условиях из спиртов получают простые эфиры, алкены (соединения с двойной связью), галогенуглеводороды, амины (производные от аммиака углеводороды).
Спирты токсичны для человеческого организма, некоторые — ядовиты (метилен, этиленгликоль). Этилен оказывает наркотическое воздействие. Опасны и пары спиртов, поэтому работы с растворителями на основе спирта должны производиться с соблюдением техники безопасности.
Тем не менее, спирты участвуют в естественном метаболизме растений, животных и человека. К категории спиртов относятся такие жизненно важные вещества как витамины A и D, стероидные гормоны эстрадиол и кортизол. Более половины липидов, поставляющих энергию нашему организму, имеют в своей основе глицерин.
Применение
В нашем магазине можно купить спирты разного вида.
Бутиловый спирт
Одноатомный спирт. Применяется в качестве растворителя; пластификатора при изготовлении полимеров; модификатора формальдегидных смол; сырья для органического синтеза и получения душистых веществ для парфюмерии; добавки к топливу.
Фурфуриловый спирт
Одноатомный спирт. Востребован для полимеризации смол и пластиков, как растворитель и пленкообразователь в лакокрасочной продукции; сырье для органического синтеза; связующий и уплотняющий агент при производстве полимербетона.
Изопропиловый спирт (пропанол-2)
Вторичный одноатомный спирт. Активно используется в медицине, металлургии, химпроме. Заменитель этанола в парфюмерных, косметических, дезинфицирующих продуктах, средствах бытовой химии, антифризах, очистителях.
Этиленгликоль
Глицерин
Трехатомный спирт. Востребован в косметологии, пищепроме, медицине, как сырье в орг. синтезе; для изготовления взрывчатого вещества нитроглицерина. Применяется в сельском хозяйстве, электротехнике, текстильной, бумажной, кожевенной, табачной, лакокрасочной индустрии, в производстве пластиков и средств бытовой химии.
Маннит
Шестиатомный (многоатомный) спирт. Применяется как пищевая добавка; сырье для изготовления лаков, красок, олиф, смол; входит в состав ПАВ, парфюмерных продуктов.

Одноатомные спирты
Ключевые слова конспекта: Функциональная группа. Спирты. Предельные одноатомные спирты. Изомерия положения функциональной группы. Водородная связь. Реакция этерификации.
Этиловый спирт и его действие на организм
Изготавливать алкогольные напитки люди научились ещё до нашей эры. С давних времён способ получения вин сбраживанием фруктовых соков дошёл до наших дней.
Дурманящий компонент алкогольных напитков впервые был выделен алхимиками только в XI в. и получил название aqua vitae — жизненная вода. Вскоре за ним закрепилось название винный спирт. Употребление алкоголя нашими предками преследовало практическую цель: за счёт вина, разбавленного водой, или пива организм получал до 25 % энергии. До сих пор можно услышать, как пиво за его калорийность называют жидким хлебом.
Коварство алкогольных напитков заключается в том, что они очень быстро вызывают привыкание, а их токсическое действие на организм проявляется не сразу. Однозначно доказано, что любое, даже незначительное, употребление алкоголя вредит здоровью человека. При попадании винного спирта в организм происходят психические и неврологические изменения, снижаются острота мышления и чёткость восприятия, формируется неадекватное поведение. Кроме этого, под действием алкоголя происходит обезвоживание организма, кровеносные сосуды расширяются, усиливается ток крови в капиллярах, в результате чего появляется ощущение тепла и покраснение кожи. В больших количествах алкоголь приводит к тяжёлым отравлениям и гибели клеток печени.
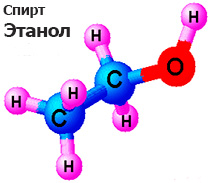
Химическое название винного спирта вам уже знакомо: этиловый спирт, или этанол. Его химическая формула С2Н5ОН. Его молекулы содержат функциональную гидроксильную группу —ОН.
Гомологический ряд предельных одноатомных спиртов
Этиловый спирт относится к одному из классов кислородсодержащих органических соединений — спиртам.

В молекуле этилового спирта содержится одна гидроксильная группа, связанная с остатком предельного углеводорода — этильным радикалом. Именно поэтому этиловый спирт относится к гомологическому ряду предельных одноатомных спиртов. Их состав соответствует общей формуле CnH2n+1OH.
Этиловый спирт, содержащий в молекуле два углеродных атома, является вторым представителем предельных одноатомных спиртов. Родоначальник гомологического ряда — метиловый спирт СН3ОН.
Химические формулы и названия первых представителей гомологического ряда предельных одноатомных спиртов приведены в таблице.

Номенклатура и изомерия спиртов
По международной номенклатуре названия спиртов образуют от названия соответствующего алкана с добавлением суффикса -ол, указывающего на принадлежность вещества к данному классу органических соединений. Обратите внимание, что при составлении названия спиртов углеродные атомы нумеруют с того конца цепи, к которому ближе гидроксильная группа.
Два последних спирта (см. табл.) обладают одной и той же молекулярной формулой С3Н7ОН, а вот химическое строение у них различное. Пропанол-1 и пропанол-2 — это изомеры, различающиеся положением функциональной группы в молекуле. Это ещё один вид структурной изомерии.

Физические свойства спиртов
В отличие от углеводородов, гомологические ряды которых начинаются с газообразных веществ, в ряду предельных одноатомных спиртов нет газов. Кроме того, в противоположность углеводородам, практически нерастворимым в воде, спирты с числом углеродных атомов от 1 до 4 смешиваются с водой в любых соотношениях. Оба эти свойства обусловлены способностью спиртов за счёт гидроксильных групп образовывать между молекулами особые связи, которые называют водородными связями.

За счёт водородных связей молекулы спиртов ассоциированы в жидкости (рис. 23, а) и хорошо растворимы в воде (рис. 23, б).
Спирты — прекрасные растворители органических веществ.
Способы получения спиртов

В промышленности спирты получают присоединением воды к этиленовым углеводородам. Например, в присутствии кислот этилен вступает в реакцию гидратации с образованием этилового спирта:

Ввести в молекулу органического вещества гидроксильную группу можно и с помощью реакции замещения. Так, при обработке галогеналканов водным раствором щёлочи атом галогена замещается группой ОН:
Химические свойства спиртов
Подобно большинству органических веществ, спирты горят. Пламя, образующееся при горении спиртов с небольшим числом атомов углерода в молекуле, бледно-голубое, практически не коптит, при горении выделяется большое количество теплоты:
Горючесть спиртов позволяет использовать их в качестве добавки к автомобильному бензину. В некоторых странах (Бразилия, США, Венесуэла) миллионы автомобилей адаптированы к использованию в качестве топлива чистого этанола.
Данную реакцию можно использовать для обнаружения спиртов.
Из курса химии основной школы вам известно, что вода бурно реагирует с активными металлами (щелочными, щелочноземельными) с выделением водорода:
2Н—О—Н + 2Na = 2NaOH + H2↑

По строению молекулы спиртов напоминают молекулы воды, только вместо одного из двух атомов водорода они содержат углеводородный радикал. Как и вода, спирты способны взаимодействовать со щелочными металлами. При этом также выделяется водород и образуется производное спирта, подобное солям:

Ещё одно важное свойство спиртов — взаимодействие с карбоновыми кислотами с образованием сложных эфиров:
Реакцию образования эфира называют реакцией этерификации.
Применение спиртов
Область применения спиртов чрезвычайно широка. Метанол используют в качестве сырья для производства формальдегида, уксусной кислоты, пластмасс, лекарственных веществ. В некоторых странах его также используют как добавку к моторному топливу. В нашей стране в этих целях метанол не используют. Он очень ядовит! Уже 5—7 мл метанола, попавшие в организм, вызывают полную потерю зрения в результате поражения сетчатки глаза, а 30 мл и более могут привести к летальному исходу.
Этиловый спирт благодаря своей растворяющей способности используют в качестве растворителя лаков и красок. Также его применяют как компонент моющих жидкостей, в парфюмерной и фармацевтической промышленности. Кроме того, этиловый спирт широко применяют в медицине для дезинфекции, компрессов, обтираний и др.
На основе этилового спирта в промышленности получают десятки органических веществ: сложные эфиры, галогенпроизводные углеводородов, уксусную кислоту. Помимо спиртных напитков, этанол в небольших количествах содержат и продукты, получаемые брожением: кефир (0,1—0,2 %), квас (0,5—1 %), кумыс (до 3 %).
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:

Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:

| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.

Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |

Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |

2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |

4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |

3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Читайте также:





