Доклад на тему углерод
Обновлено: 07.07.2024
Углерод — химическое вещество, находящейся в Периодической таблице химических элементов под номером 6 и обозначающееся символом С. На этом можно бы было и закончить, но на самом деле углерод — основа жизни на Земле.
На самом деле все органические вещества на Земле в основном состоят из углерода, кислорода и водорода. Конечно, присутствуют и другие вещества, но эти три элемента присутствуют в органической формуле всегда, причем в больших количествах. Поэтому жизнь на Земле ученые считают развившейся именно на углеродной основе.
Где находится углерод? Он находится везде, но в самом доступном для извлечения виде он присутствует буквально перед нами — в воздухе, в составе выдыхаемого животными и растениями углекислого газа. На самом деле углекислый газ — СО2 — продукт горения, происходящего в организме, то есть окисления. Из атмосферы он извлекается растениями для строительства своего тела, при этом в процессе фотосинтеза кислород выделяется обратно в атмосферу, а углерод усваивается самими растениями. При гниении или поедании, а также сжигании он снова соединяется с кислородом и образует углекислый газ. Простой на первый взгляд химический процесс на самом деле является основой жизни на нашей планете.
Газ ли углерод? Не только. В мире известно множество кристаллических модификаций углерода — известный всем вам графит, который используют в карандашах, алмаз, использующийся в добывающей промышленности, в обработке материалов и в изготовлении ювелирной продукции и некоторые другие, в том числе графен — единственное пока в мире двумерное кристаллическое вещество, не имеющее высоты.
Значит, углерод газ и кристалл. Как бы не так. Широко известны и распространены аморфные виды состояния углерода - уголь, служащий сырьем для химической промышленности и для отопления путем сжигания в печах, активированный уголь, использующийся в качестве абсорбента, антрацит, кокс, и даже сажа, которая растворяется в воде, при этом получается жидкий углерод.
Является ли углерод самым главным веществом в мире? Конечно нет! Любое вещество, отраженное в Периодической таблице, важно для существования как жизни на нашей отдельной планете, такой огромной, но на самом деле пылинке во Вселенной, так и для существования самой Вселенной, но роль углерода, конечно, нельзя отрицать.
Вариант 2
На нашей планете существует огромное множество различных интереснейших с научной точки зрения, и важнейших с точки зрения обычной бытовой жизни элементов. Они могут быть самыми разными, как и обычными и совсем не примечательными простейшими веществами, так и уникальными, со своим сложнейшим составом элементами, что делает их уникальными, однако все эти элементы объединяет множество различных признаков, такие как атомная масса, например, или порядок в таблице элементов, но, самым главным признаком, пожалуй, будет их важность для людей и всей человеческой цивилизации. Одним из важнейших первородных элементов является углерод.
Как ни странно, слово углерод происходит от “Рождающий уголь”, что как бы говорит о природе самого элемента, который является своеобразным зачинщиком всех остальных элементов, которые и произошли от первых начальных элементов, таких как углерод к примеру. Именно поэтому углерод и называют одним из важнейших элементов, который поддерживает всё существующее в нашем мире, и который в тоже время является одним из основополагающих элементов в системе, которую он, собственно, и поддерживает.
Углерод – один из простейших элементов, однако, не самый последний из них, о чём уже было сказано выше. Углерод, так или иначе, с самого начала существования нашей планеты, наряду с кислородом, создавал благоприятные условия для создания и зарождения полнейшей экосистемы, и становления её такой, какой она является сегодня, а именно, устоявшейся системой, с направлением на постоянную прогрессию и эволюцию. Исходя из этого, можно сделать вывод, что углерод играет весьма важную роль в человеческой жизни, и делает само её существование и нормальное функционирование возможным, так как, если составить простейшую цепочку логических выводов, то станет ясно следующее, если бы не было углерода как такового, то планета попросту не смогла бы создать тот климат, который мы знаем сегодня, соответственно, отсюда вытекает невозможность зарождения жизни. Это значит, что ничего бы больше не появилось и жизнь бы в один прекрасный момент не зародилась. Поэтому углерод и является одним из самых важнейших элементов на нашей планете.
Углерод - основа всей живой природы.
Углерод
Интересные ответы
Смерч – это сильный вихрь, сметающий все на своем пути. Он образовывается в грозовом облаке и с большой силой воронкой опускается до поверхности земли, всасывая в эту воронку все на своем пути. В Северной Америке такое явление называют торнадо.
Уникальный писатель, бесподобный драматург, автор бессмертных повестей, Родился писатель 21 мая в 1924 году в городе Смоленск.
Сотни миллионов лет назад сверхконтинент Пангея разделился на два более мелких – северную Лавразию и южную Гондвану. Дальнейшее движение литосферных плит медленно сформировало Индийский океан, третий по площади на Земле.
Рыжий помощник из свиты Воланда
Цемент это измельчённый клинкер с различными добавками. Химически это выглядить так: оксида кальция (СаО), он занимает самое большое количество процентов 67%

Научные доклады
Углерод является химическим элементом IV группы периодической системы Менделеева. О его существовании было известно еще в глубокой древности, а вот имя человека, открывшего углерод, до сих пор является тайной.
Благодаря способности атомов углерода соединяться не только друг с другом, но и с атомами других элементов, многообразие его соединений поражает.
Углерод в природе
Также много минералов и ископаемых содержат углерод. Среди углеродсодержащих минералов выделяют кальцит СаСО3, СаМg(СО3)2 и магнезит МgСО3. А вот горючие ископаемые практически все построены на углеродной основе. Некоторые угли на 99% состоят из углерода. Кроме того этот элемент на 0,1% составляет земную кору и является частью атмосферы и гидросферы, где растворен СО2.
Модификации химического элемента углерода
Элементарный углерод образует 3 модификации:
- Алмаз. Это прозрачное, кристаллическое, бесцветное вещество. Оно сильно преломляет солнечные лучи. Находясь в возбужденном состоянии, валентные атомы углерода распариваются и образовываются 4-ре неспаренных электрона. Также при возникновении ковалентных связей под определенным углом образуется кристаллическая атомная решетка, которая есть только у алмаза. В алмазе каждый углеродный атом окружен еще 4-ьмя другими атомами. Исключительная твердость камня объясняется плотным размещением атомов. Кстати электрический ток он плохо проводит. В 1961 году запустили производство синтетических алмазов из графита. Основная масса, из которой образуются алмазы – это алмазная пыль и небольшие кристаллы. Если его нагреть до температуры выше 1000°С, то он превращается в графит.
- Графит. Представляет собой кристаллическое серо-черное вещество, жирное на ощупь, с металлическим блеском, не слишком твердое. Его атомы образовывают с соседними атомами 3 ковалентных σ-связи. Так образовывается сетка из шестиугольников. Элемент обладает низкой механической прочностью и с легкостью распадается на чешуйки, которые прочны. Между слоями атомов существует связь, частично металлического характера. Графит прекрасно проводит электрический ток.
- Карбин. Представляет мелкокристаллический порошок черного окраса. Атомы имеют кристаллическую структуру и соединены тройными и одинарными связями в виде линейные цепочки. Существует в разных формах. Ученые обнаружили, что карбин есть и в космосе: его нашли в метеоритном веществе. Характеризуется полупроводниковыми свойствами. При температуре 2300°С переходит в гранит.
- Уголь. Являет собой измельченный графит. Образуется без доступа воздуха при термическом разложении соединений, содержащих углерод. Самые важные сорта это древесный уголь, кокс, сажа. Структура углей пористая.
Химические свойства углерода
Уголь, алмаз и графит при обычных температурах химически инертны. Их активность увеличивается с повышением температуры. Окислителями углерода являются некоторые металлы, которые образуют карбиды при высоких температурах. Графит и уголь с водородом образовывают углеводороды, например, метан. С кислородом элемент проявляет восстановительные свойства, а когда он полностью сгорает, то образует оксид углерода. Уголь может окисляться концентрированными горячими азотными и серными кислотами. Примечательно, что углерод крайне устойчив к щелочам.
Где применяется углерод?
Алмазами обрабатываются твердые металлы – они режутся и шлифуются. Также им можно сверить и гравировать стекло, бурить горные породы. Если сам элемент отшлифовать и огранить, то получиться бриллиант, который используется в ювелирной сфере. Графит является ценным материалом для промышленности. Из него делают плавильные тигли, литейные формы, огнеупорные изделия, трубы и аппараты, карандаши, краски и смазочный материал. Чистейший гранит используют для замедления нейтронов в ядерных реакторах. Из карбина изготавливают полупроводники. Кокс применяется при выплавке руд и металлов, древесный уголь важный для кузнечного дела и металлургической промышленности. Сажей наполняют резины для того, чтобы повысить их прочность, она выступает компонентом печатных красок, крема для обуви, туши.

Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12 С (98,892%) и 13 С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14 С с периодом полураспада 5,73*10 3 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s 2 2s 2 2p 2 . Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
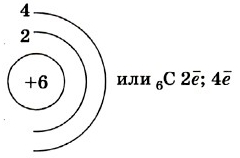
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C 0 + O2 – t° = CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C 0 + O2 – t° = 2C +2 O угарный газ
— с водяным паром
C 0 + H2O – 1200° = С +2 O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C 0 + 2CuO – t° = 2Cu + C +4 O2
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
Ca + 2C 0 = CaC2 -4
Вступая в реакцию с водородом, углерод образует метан:
Роль в природе
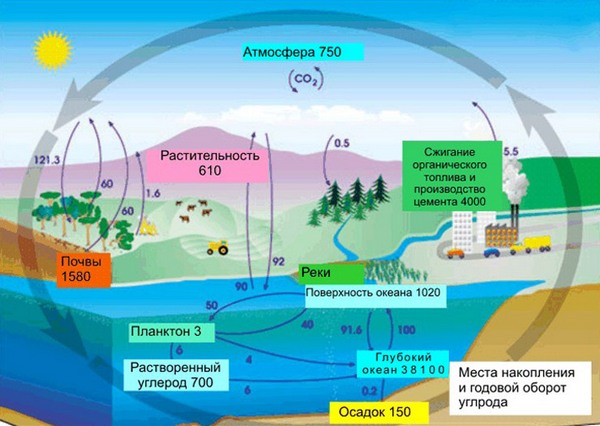
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
Применение
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
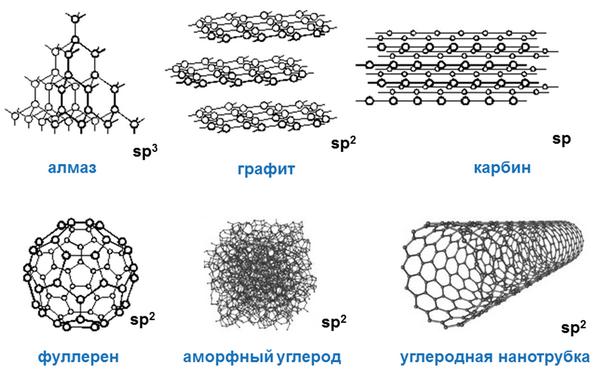
Три формы углерода
Углерод — удивительное вещество, физические свойства которого и даже внешний вид описать однозначно просто невозможно. Этот элемент — рекордсмен по количеству аллотропных модификаций. Три формы углерода:
• кристаллическая: алмазы, наноалмазы, фуллерены, фуллерит, графиты, карбины, лонсдейлиты, углеродные нанотрубки и нановолокна, графен, волокна и структуры;
• аморфная: угли (древесный, в том числе активированный уголь, антрацит и др.), коксы, сажа, углеродная нанопена, стеклоуглерод, техуглерод;
• кластерная: астралены, диуглерод, углеродные наноконусы.

Молекулы кристаллического углерода характеризуются правильной кристаллической решеткой. Большинство форм кристаллического углерода отличаются очень высокой твердостью и тугоплавкостью. Алмаз обладает высокой плотностью, почти не проводит тепло и ток. Графит, наоборот, имеет невысокую плотность и слоистое строение; проводит ток, может возгоняться, минуя жидкое состояние.
Вещества, относящиеся к аморфным формам, не являются чистой формой углерода, но содержат углерод в очень значительных количествах. Для аморфного углерода характерна высокая теплоемкость, свойства полупроводников, невысокая плотность, относительно невысокая термостойкость — при температуре выше 1600 °С он превращается в графит. Как правило, их основой являются разные формы мелкокристаллического графита в виде неупорядочной структуры.
Углеродные кластеры — сложные соединения с очень интересными свойствами. Им, а также другим перспективным материалам на основе углерода, мы посвятим одну из ближайших статей.
Химические свойства
С химическими свойствами немного проще. В нормальных условиях углерод практически не вступает в реакции с другими элементами и веществами, инертен к кислотам, щелочам, галогенам. При высоких температурах проявляет сильные восстановительные свойства. Наиболее химически активны аморфные виды углерода, наиболее инертны — кристаллические. Графит по химической активности занимает серединное положение. При высоких температурах углерод окисляется кислородом (горит), образует несколько видов оксидов.
Графит и аморфный углерод при высоких температурах реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).
Следующая статья будет о содержании углерода в природе, его опасности и сферах применения.

Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
История открытия углерода
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…

Круговорот углерода в природе
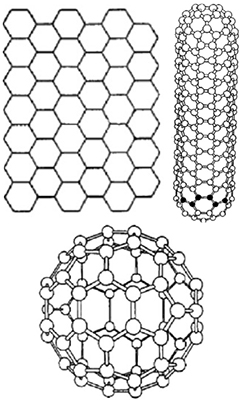
Аллотропные модификации углерода
Углерод — уникальный химический элемент, который образует так называемые аллотропные модификации, или, проще говоря, различные формы. Эти модификации подразделяются кристаллические, аморфные и в виде кластеров.

Аллотропные формы углерода: a) лонсдейлит; б) алмаз;
в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Аморфные формы образованы углеродом с небольшими примесями других химических элементов. Основные представители этой группы: уголь (каменный, древесный, активированный), сажа, антрацит.
Самыми сложными и высокотехнологичными являются соединения углерода в виде кластеров. Кластеры — это особая структура, при которой атомы углерода расположены таким образом, что образуют полую форму, которая заполнена изнутри атомами других элементов, например, воды. В этой группе не так уж и много представителей, в неё входят углеродные наноконусы, астралены и диуглерод.
Применение углерода
Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле — природный газ и нефть. Соединения углерода широко применяются в химической и металлургической промышленности, в строительстве, в машиностроении и медицине. Аллотропные модификации в виде алмазов используют в ювелирном деле, фуллерит и лонсдейлит в ракетостроении. Из соединений углерода изготавливаются различные смазки для механизмов, техническое оборудование и многое другое. Промышленность в настоящее время не может обойтись без углерода, он используется везде!
Читайте также:

