Доклад на тему теплоемкость газов
Обновлено: 19.04.2024
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
За единицу количества энергии в системе СИ применяют джоуль (Дж). В системе СИ джоуль является универсальной единицей, применяемой для измерения всех видов энергии: тепловой, механической, лучистой и пр. В качестве тепловой единицы 1 Дж представляет собой такое ее количество, которое появляется в результате превращения механической работы 1 Дж в теплоту. В качестве единицы механической энергии джоуль представляет собой работу, совершаемую силой, равной 1 ньютону при перемещении ею тела на расстояние 1 м в направлении действия силы (1 Дж = Н-м = 1 кг •м 2 /с 2 ).
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость μ c — кДж/(кмоль•К), массовую теплоемкость с — кДж/(кг•К) и объемную теплоемкость с' — кДж/(м 3 •К).
Как было указано выше, 1 м 3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м 3 его при нормальных условиях (рн = 101 325 Па (760 мм рт. ст.) и Т н = 273 К (t н = 0°С).
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
с=μ c / μ , (1)
а объемная теплоемкость
с / = μ c / 22,4 (2)
Объемная и массовая теплоемкости связаны между собой зависимостью
где рн — плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то

cm = (3)

представляет собой среднюю теплоемкость в пределах t1 - t2 . Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как с=
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении.
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
а) мольную — при постоянном объеме (μсv и μcvm) и постоянном давлении (μcp и μсрт);
б) массовую — при постоянном объеме (сv и cvm) и постоянном давлении (сp и срт);
в) объемную—при постоянном объеме (c'v и c'vm) и постоянном давлении (с'р и с'рт).
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость (уравнение Майера):

μcp— μcv = μR 8,314 кДж/(кмоль•К). (4)
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 5.1).
Таблица 5.1- Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (с= cоnst)
Теплоемкость газа - это количество энергии, которое поглощает тело при его нагревании на один градус. Проанализируем основные характеристики данной физической величины.

Определения
Удельная теплоемкость газа представляет собой величины единицы массы конкретного вещества. Ее единицами измерения являются Дж/(кг·К). Количество теплоты, которое поглощается телом в процессе изменения его агрегатного состояния, связано не только с начальным и конечным состоянием, но и со способом перехода.

Подразделение
Теплоемкость газов делят на величину, определяемую при неизменном объеме (Cv), постоянном давлении (Ср).
В случае нагревания без изменения давления некоторое количество тепла расходуется на производство работы расширения газа, а часть энергии затрачивается для увеличения внутренней энергии.
Теплоемкость газов при постоянном давлении определяется количеством теплоты, которое расходуется на повышение внутренней энергии.
Газообразное состояние: особенности, описание
Теплоемкость идеального газа определяется с учетом того, что Сp-Сv=R. Последнюю величину называют универсальной газовой постоянной. Ее величина соответствует 8,314 Дж/(моль·К).
При проведении теоретических вычислений теплоемкости, например описания связи с температурой, недостаточно пользоваться только термодинамическими методами, важно вооружиться элементами статической физики.
Теплоемкость газов предполагает вычисление среднего значения энергии поступательного движения некоторых молекул. Такое движение суммируется из вращательного и поступательного движения молекулы, а также из внутренних колебаний атомов.
В статической физике есть информация о том, что на каждую степень свободы вращательного и поступательного движения приходится для газа величина, которая равна половине универсальной газовой постоянной.

Интересные факты
У частицы одноатомного газа предполагается три поступательных степени свободы, поэтому удельная теплоемкость газа имеет три поступательные, две вращательные, одну колебательную степени свободы. Закон их равномерного распределения приводит к приравниванию удельной теплоемкости при неизменном объеме к R.
В ходе экспериментов было установлено, что теплоемкость двухатомного газа соответствует величине R. Подобное несоответствие теории с практикой объясняется тем, что теплоемкость идеального газа связана с квантовыми эффектами, поэтому при проведении расчетов важно использовать статистику, базирующуюся на квантовой механике.
Исходя из основ квантовой механики, любая система частиц, которые совершают колебания либо вращения, включая молекулы газа, обладает только некоторыми дискретными значениями энергии.
Если энергии теплового движения будет в системе недостаточно для возбуждения колебаний определенной частоты, подобные движения не вносят своего вклада в суммарную теплоемкость системы.
Теплоемкость газов – важная характеристика состояния, от которой зависит функционирование всей термодинамической системы.
Температура, при достижении которой закон равнораспределения можно будет применить к колебательной либо вращательной степени свободы, характеризуется квантовой теорией, связывает постоянную Планка с константой Больцмана.

Двухатомные газы
Промежутки между вращательными энергетическими уровнями таких газов составляют незначительное количество градусов. Исключение составляет водород, в котором значение температуры определяется сотнями градусов.
Именно поэтому теплоемкость газа при постоянном давлении сложно описать законом равномерного распределения. В квантовой статистике при определении теплоемкости учитывают, что ее колебательная часть в случае понижения температуры быстро снижается, достигает нулевого значения.
Подобное явление объясняет тот факт, что при комнатных температурах практически нет колебательной части теплоемкости, для двухатомного газа она соответствует постоянной R.
Теплоемкость газа при постоянном объеме в случае низких температурных показателей определяется с помощью квантовой статистики. Существует принцип Нернста, который называют третьим началом термодинамики. Исходя из его формулировки, молярная теплоемкость газа будет убывать при понижении температуры, стремиться к нулевому показателю.

Особенности твердых тел
Если теплоемкость смеси газов можно объяснить с помощью квантовой статистики, то для твердого агрегатного состояния тепловое движение характеризуется незначительными колебаниями частиц вблизи положения равновесия.
У каждого атома есть три колебательные степени свободы, поэтому в соответствии с законом равнораспределения молярную теплоемкость твердого тела можно рассчитать как 3nR, причем n – количество атомов в молекуле.
На практике подобное число является тем пределом, к которому стремится при высоких температурных показателях величина теплоемкости твердого тела.
Максимум можно получить при обычных температурах у некоторых элементов, включая металлы. При n=1 выполняется закон Дюлонга и Пти, а вот для сложных веществ достичь такого предела достаточно сложно. Поскольку в реальности предел невозможно получить, происходит разложение либо плавление твердого вещества.
История квантовой теории
Основателями квантовой теории считаются Эйнштейн и Дебай в начале двадцатого века. Она базируется на квантовании колебательных движений атомов в определенном кристалле. В случае невысоких температурных показателей теплоемкость твердого тела оказывается в прямо пропорциональной зависимости от абсолютной величины, взятой в кубе. Эта зависимость была названа законом Дебая. В качестве критерия, который позволяет отличать низкие и высокие температурные показатели, берется их сравнение с дебаевской температурой.
Определяется такая величина спектром колебаний атома в теле, поэтому серьезно зависит от особенностей его кристаллической структуры.
QD – это величина, которая имеет несколько сотен К, но, к примеру, у алмаза она существенно выше.
В величину теплоемкости металлов значительный вклад вносят электроны проводимости. Для ее вычисления используют квантовую статистику Ферми. Электронная проводимость для атомов металлов прямо пропорциональна абсолютной температуре. Поскольку она является незначительной величиной, она учитывается только при значениях температуры, стремящихся к абсолютному нулю.
Способы определения теплоемкости
В качестве основного экспериментального метода выступает калориметрия. Для проведения теоретического расчета теплоемкости используется статистическая термодинамика. Он допустим для идеального газа, а также для кристаллических тел, проводится на основе экспериментальных данных о строении вещества.
Эмпирические методики расчета теплоемкости идеального газа базируются на представлении о химическом строении, вкладе отдельных групп атомов в Ср.
Для жидкостей также применяют методы, которые основываются на применении термодинамических циклов, которые позволяют переходить от теплоемкости идеального газа к жидкости через производную температуры энтальпии процесса испарения.
В случае раствора расчет теплоемкости в качестве аддитивной функции не допускается, так как избыточная величина теплоемкости раствора в основном существенна.
Чтобы провести ее оценку, потребуется молекулярно-статистическая теория растворов. Самым сложным считается выявление теплоемкости гетерогенных систем в термодинамическом анализе.

Заключение
Изучение теплоемкости позволяет проводить расчеты энергетического баланса процессов, протекающих в химических реакторах, а также в иных аппаратах химического производства. Кроме того, эта величина необходима для подбора оптимальных видов теплоносителей.
В настоящее время осуществляется экспериментальное определение теплоемкости веществ для различных температурных интервалов – от низких значений до высоких величин – основной вариант определения термодинамических характеристик вещества. При проведении вычислений энтропии и энтальпии вещества применяют интегралы теплоемкости. Информация о теплоемкости химических реагентов в определенном температурном интервале позволяет рассчитывать тепловой эффект процесса. Информация о теплоемкости растворов позволяет рассчитывать их термодинамические параметры при любых температурных значениях в рамках анализируемого промежутка.
Сложно вести полноценные математические вычисления без учета термодинамических характеристик вещества, его агрегатного состояния. Именно поэтому для жидкостей, газов, твердых веществ используют такую характеристику как удельная теплоемкость, позволяющую характеризовать энергетические параметры вещества.
В случае, если результатом теплообмена становится передача телу некоего количества теплоты Q , то его температура и внутренняя энергия претерпевают изменения.
Необходимое для нагревания 1 к г вещества на 1 К количество теплоты Q носит название удельной теплоемкости вещества c , а ее формула выглядит следующим образом:
В большом количестве ситуаций удобной для использования является молярная теплоемкость C :
C = M · c , где M представляет собой молярную массу вещества.
Теплоемкость, полученная таким способом, не является однозначной характеристикой вещества. Исходя из первого закона термодинамики, можно сказать, что изменение внутренней энергии тела зависимо не только от количества полученной теплоты, но и от величины совершенной телом работы. В разных условиях осуществления процесса теплопередачи тело может совершать различную работу. Таким образом, переданное телу одинаковое количество теплоты способно провоцировать изменения его внутренней энергии и, соответственно, температуры.
Подобной неоднозначностью при определении теплоемкости характеризуются только газообразные вещества. Объем в процессе нагрева практически не меняет своей величины, что сводит работу расширения к нулю. По этой причине вся полученная телом теплота уходит на изменение его внутренней энергии. Газ в процессе теплопередачи может значительно менять свой объем и совершать работу, чем отличается от твердых тел и жидкостей. Таким образом, теплоемкость газообразного вещества имеет зависимость от характера термодинамического процесса.
Изопроцессы в газах
Чаще всего рассматриваются два значения теплоемкости газов:
- C V являющаяся молярной теплоемкостью в изохорном процессе ( V = c o n s t ) ;
- C p представляющая собой молярную теплоемкость в изобарном процессе ( p = c o n s t ) .
При условии постоянного объема газ не совершает работы: A = 0 . Исходя из первого закона термодинамики для 1 м о л я газа, можно сказать, что справедливым является следующее выражение:
Q V = C V ∆ T = ∆ U .
Изменение величины Δ U внутренней энергии газа прямо пропорционально изменению значения Δ T его температуры.
В условиях процесса при постоянном давлении первый закон термодинамики дает такую формулу:
Q p = ∆ U + p ( V 2 - V 1 ) = C V ∆ T + p V .
В котором Δ V является изменением объема 1 м о л я идеального газа при изменении его температуры на Δ T . Таким образом, можно заявить, что:
C p = Q p ∆ T = C V + p ∆ V ∆ T .
Из уравнения состояния идеального газа, записанного для 1 м о л я , может выражаться отношение Δ V Δ T :
В котором R представляет собой универсальную газовую постоянную. При условии постоянства давления p = c o n s t , можно записать следующее: p ∆ V = R ∆ T или ∆ V ∆ T = R p .
Из этого следует, что выражающее связь между молярными теплоемкостями C p и C V соотношение имеет вид (формула Майера):
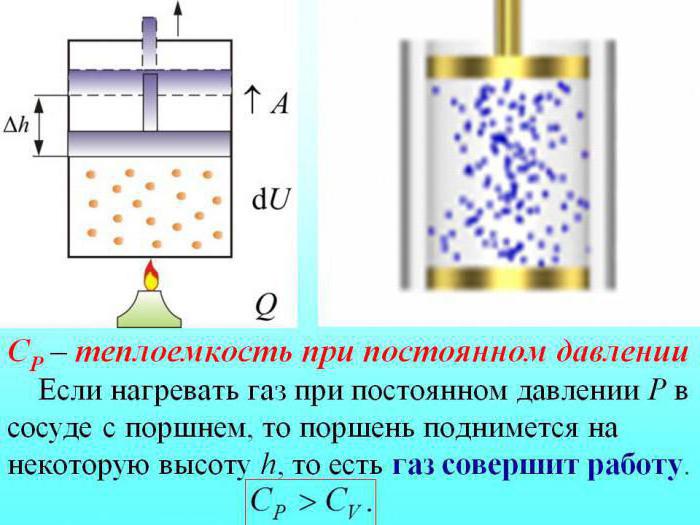
В процессе с неизменным давлением молярная теплоемкость C p газа всегда превышает молярную теплоемкость C V в процессе с не подверженным изменениям объемом, что демонстрируется на рисунке 3 . 10 . 1 .
Рисунок 3 . 10 . 1 . Два возможных процесса нагревания газа на Δ T = T 2 – T 1 . При p = c o n s t газ совершает работу A = p 1 ( V 2 – V 1 ) . Поэтому C p > C V .
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом занимает важное место в термодинамике и обозначается в виде греческой буквы γ .
Данное отношение включено в формулу для адиабатического процесса.
Между двумя изотермами, обладающими температурами T 1 и T 2 на диаграмме ( p , V ) реальны различные варианты перехода. Так как для всех подобных переходов изменение величины температуры Δ T = T 2 – T 1 является одним и тем же, выходит, что изменение значения
Δ U внутренней энергии тоже одинаково. С другой стороны, совершенные при этом работы A и количества теплоты Q , полученные в результате теплообмена, выйдут разными для различных путей перехода. Из этого следует, что газа имеет относительно приближенное к бесконечности число теплоемкостей. C p и C V представляют собой частные, однако, очень важные для теории газов, значения теплоемкостей.
Рисунок 3 . 10 . 2 . Модель теплоемкости идеального газа.
Термодинамические процессы, в которых теплоемкость газа не подвергается изменениям, носят название политропических.
Каждый изопроцесс являются политропическим. В изотермическом процессе Δ T = 0 , из-за чего C T = ∞ . В адиабатическом процессе Δ Q = 0 , выходит, что C а д = 0 .
Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества. Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла.
Молекулярно-кинетическая теория
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией E → поступательного движения молекул и абсолютной температурой T :
Внутренняя энергия 1 м о л я идеального газа эквивалентна произведению E → на число Авогадро N А :
U = 3 2 k N A T = 3 2 R T .
При условии изменения температуры на величину Δ T внутренняя энергия изменяется на величину:
U = 3 2 R ∆ T = C V ∆ T .
Коэффициент пропорциональности между Δ U и Δ T эквивалентен теплоемкости C V в условиях постоянного давления:
C V = 3 2 R = 12 , 47 Д Ж / м о л ь · К.
Данное выражение подтверждается экспериментами с газами, которые состоят из одноатомных молекул вроде гелия, неона или аргона. При этом для двухатомных (водород, азот) и многоатомных (углекислый газ) газов такое соотношение не согласуется с полученными в результате опытов данными. Причина этого расхождения заключается в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию как поступательного, так и вращательного их движения.

Рисунок 3 . 10 . 3 . Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы.
Рисунок 3 . 10 . 3 иллюстрирует модель двухатомной молекулы. Молекула имеет возможность производить пять независимых типов движений: три поступательных движения вдоль осей X , Y , Z и два вращения относительно осей X и Y .
Опытным путем выяснено, что вращение относительно оси Z , на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких значениях температуры. В условиях обычных температур вращение вокруг оси Z не происходит.
Каждое независимое движение в молекуле носит название степени свободы.
В классической статистической физике доказывается теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T , то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 1 2 k T .
Из данной теоремы следует, что для молярных теплоемкостей газа C p и C V и их отношения
γ справедлива запись в следующем виде:
C V = i 2 R , C p = C v + R = i + 2 2 R , γ = C p C V = i + 2 i ,
где i представляет собой количество степеней свободы газа.
Для газа, состоящего из одноатомных молекул ( i = 3 )
C V = 3 2 R , C p = C v + R = 5 2 R , γ = C p C V = 5 3 = 1 , 66 .
Для газа, состоящего из двухатомных молекул ( i = 5 )
C V = 5 2 R , C p = C v + R = 7 2 R , γ = C p C V = 7 5 = 1 , 4 .
Для газа, состоящего из многоатомных молекул ( i = 6 )
C V = 3 R , C p = C v + R = 4 R , γ = C p C V = 4 3 = 1 , 33 .
В обычных условиях экспериментально измеренные теплоемкости многих газов неплохо согласуются с приведенными выражениями, но в целом классическая теория теплоемкости газов вполне удовлетворительной не является. Существует колоссальное число примеров со значительной разницей между результатами эксперимента и теорией. Данный факт объясняется тем, что классическая теория не может полностью учесть, связанную с внутренними движениями в молекуле энергию.
Внутренняя энергия 1 м о л я твердого вещества равна следующему выражению:
U = 3 R N A k t = 3 R t .
Следовательно, молярная теплоемкость вещества в твердом состоянии равняется:
С = 3 R = 25 , 12 Д ж / м о л ь · К .
Данное выражение носит название закона Дюлонга–Пти. Для твердых тел почти нет различия между C p и C V по причине пренебрежительно малой работы при сжатии или расширении.
Опыт показывает, что молярная теплоемкость у многих твердых тел (химических элементов) при обычных температурах на самом деле близка к 3 R . При этом, в условиях низких температур заметны довольно сильные расхождения между теорией и экспериментом. Таким образом, гипотеза о равномерном распределении энергии по степеням свободы может считаться лишь приближением. Заметная в опыте зависимость теплоемкости от температуры объясняется только при условии использования квантовых представлений.
Расчетные приближенные формулы для определения средних теплоемкостей при постоянном давлении для различных газов в интервале температур от 0 до 1000 °C приведены в специальных таблицах. Использование (1.31) и (1.32) позволяет обойтись при расчетах без справочных таблиц. Рис. 1.1. Зависимость теплоемкости от температуры Графически коэффициент, а выражает теплоемкость газа при 0 °C, а коэффициент Ь… Читать ещё >
Теплоемкость газов и их смесей ( реферат , курсовая , диплом , контрольная )
Теплоемкостью © называют отношение количества теплоты, необходимой для изменения температуры в веществе на бесконечно малую величину:

Такую теплоемкость называют истинной.
При решении практических задач используют среднюю теплоемкость — условную постоянную величину в определенном интервале температур:

В зависимости от единиц количества вещества различают:
- • массовую теплоемкость с, кДж/(кг • К);
- • молярную теплоемкость рс или См, кДжДкмоль-К);
• объемную теплоемкость С или с', отнесенную к 1 м 3 газа при нормальных физических условиях (j) = 760 мм рт. ст., t = 0°С), кДж/(м 3 • К) .
Массовая, молярная и объемная теплоемкости связаны между собой следующими зависимостями:

где |i — молекулярная масса вещества, кг/кмоль; vH, рн — удельный объем и плотность вещества при нормальных условиях; 22,4 м 3 /кмоль — объем одного киломоля любого идеального газа при нормальных физических условиях [1] .
Теплоемкость рабочего тела зависит от характера процесса, поэтому тоже является функцией процесса. В различных процессах теплоемкость может принимать значения в пределах -(c)о т. е.

Для идеального газа работа в изобарном процессе может быть определена из уравнения состояния после дифференцирования последнего:

После подстановки значений (к]р и с1дг, и сокращения на с1Т получаем.

Формула (1.27), устанавливающая связь между изобарной и изохорной теплоемкостями, называется уравнением Майера. Из нее вытекает также физический смысл газовой постоянной: газовая постоянная Я равна работе 1 кг газа в изобарном процессе при изменении его температуры на один кельвин (1 К). Разные газы в изобарном процессе производят неодинаковую работу.
Умножая обе части равенства (1.27) на молекулярную массу, получаем.

Величина хЯ (или /?м) называется универсальной газовой постоянной. Из (1.28) следует, что разность молярных изобарной и изохорной теплоемкостей для идеальных газов является величиной постоянной.
При решении теплотехнических задач необходимо знать значения теплоемкостей различных газов. При невысоких температурах можно пользоваться значениями теплоемкостей, полученными на основе классической молекулярно-кинетической теории газов, согласно которой теплоемкость идеального газа зависит только от количества атомов в молекуле газа, характера процесса и не зависит от температуры.
Мольные теплоемкости идеальных газов в процессе, протекающем при постоянном объеме, имеют следующие значения: рсГ = 12,6 кДжДкмоль • К) — одноатомные газы; рс?1= 20,9 кДжДкмоль • К) — двухатомные газы; цс1)= 29 кДжДкмоль • К) — трехи многоатомные газы.
Мольная изобарная теплоемкость может быть рассчитана, но формуле (1.28). Массовые и объемные теплоемкости идеальных газов определяют по (1.21) и (1.22).
Сравнивая приведенные значения теплоемкости с опытными данными, можно прийти к следующим выводам. Если для одноатомных газов приведенные значения теплоемкостей хорошо совпадают с опытными результатами, то для двухатомных газов такое совпадение наблюдается только при температурах 0—20°С. При более высоких температурах имеют место значительные расхождения в величинах теплоемкостей.

В тепловых двигателях происходит значительное изменение температуры газа, поэтому необходимо учитывать зависимость теплоемкости от температуры:

Эту зависимость находят экспериментальным путем, она имеет вид алгебраического многочлена:
где а, /?, сI — коэффициенты, определяемые опытным путем.
Как следует из (1.29) и рис. 1.1, в общем случае теплоемкость имеет криволинейную зависимость от температуры. Величины истинных и средних изохорных и изобарных теплоемкостей в зависимости от температуры приводятся в справочных таблицах. В них средние значения теплоемкостей дают для интервала температур от 0 до ?°С. Средние теплоемкости в интервале температур и ?2 с использованием таблиц вычисляют по формуле.

где с0_Г1, с0_Г2 — средние табличные теплоемкости газа в интервале температур (0—и (0—?2), °С.
В (1.30) числитель представляет собой количество теплоты, подводимой к газу с целью повышения его температуры от до ?2> °С.
Часто в теплотехнических расчетах криволинейную зависимость теплоемкости от температуры заменяют близкой к ней прямолинейной зависимостью (рис. 1.1). В этом случае истинную теплоемкость определяют, но следующей приближенной формуле:


Рис. 1.1. Зависимость теплоемкости от температуры Графически коэффициент а выражает теплоемкость газа при 0 °C, а коэффициент Ь является тангенсом угла, а наклона прямой. В таком случае среднюю теплоемкость газа в интервале температур от Ьх до ?2 находят по формуле.

Расчетные приближенные формулы для определения средних теплоемкостей при постоянном давлении для различных газов в интервале температур от 0 до 1000 °C приведены в специальных таблицах. Использование (1.31) и (1.32) позволяет обойтись при расчетах без справочных таблиц.
На теплоемкость реальных газов влияет не только температура, но и давление.
Для определения теплоемкости смеси газов необходимо знать ее состав и значения теплоемкостей компонентов.

При нагреве смеси на 1 °C каждый компонент также нагревается на 1 °C. Следовательно, если смесь задана массовыми долями, то теплоемкость смеси, кДж/К,
где Мш — масса смеси, кг; ссм — массовая теплоемкость смеси, кДж/(кг • К); М1? М2,Мп — массы компонентов, кг; сх, с2, сп — массовые теплоемкости компонентов, кДж/(кг • К).
Разделив обе части последнего уравнения на Мсм, получим.

Если смесь задана объемными долями, то объемную теплоемкость 1 м 3 смеси газов при нормальных физических условиях находят по формуле.
Вы можете изучить и скачать доклад-презентацию на тему Теплоемкости газов. Адиабатный процесс. Презентация на заданную тему содержит 13 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!

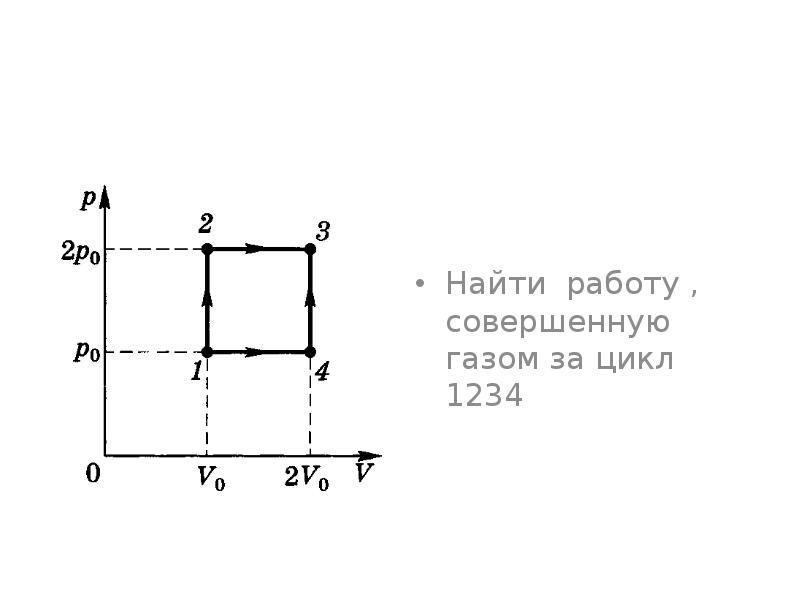

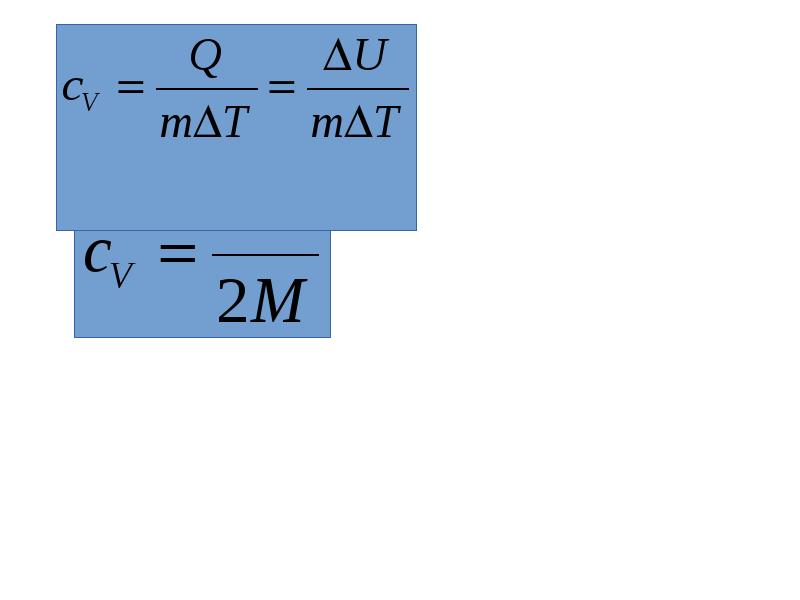





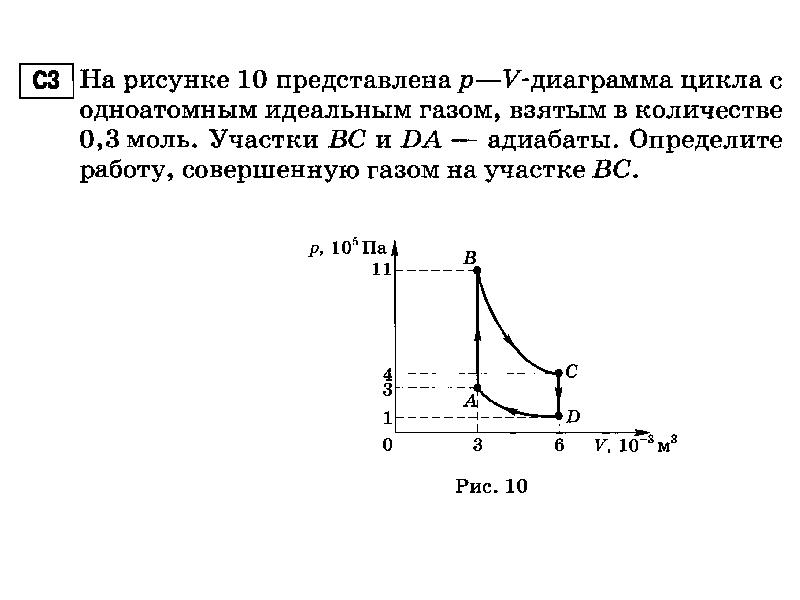



Количество теплоты пропорционально массе тела и изменению температуры. Но для газов коэффициент пропорциональности зависит от способа изменения состояния газа: Количество теплоты пропорционально массе тела и изменению температуры. Но для газов коэффициент пропорциональности зависит от способа изменения состояния газа: для изохорного процесса для изобарного процесса
Степень свободы -любое независимое движение, которое может совершать тело. Для одноатомной молекулы i=3 Для двухатомной молекулы i=5 Для многоатомной молекулы i=6
Адиабатный процесс – это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. Адиабатный процесс – это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. Линия на термодинамической диаграмме состояний системы, изображающая равновесный (обратимый) адиабатический процесс, называется адиабатой Для этого процесса , Q = 0, А=-ΔU В случае одноатомного идеального газа
Читайте также:

