Доклад на тему азот
Обновлено: 05.07.2024
Происходит от греческого слова azoos - безжизненный, по-латыни Nitrogenium. Химический знак элемента - N. Азот - химический элемент V группы периодической системы Менделеева, порядковый номер 7, относительная атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса.
1.Историческая справка. Соединения азота - селитра, азотная кислота, аммиак - были известны задолго до получения азота в свободном состоянии. В 1772 г. Д. Резерфорд, сжигая фосфор и другие вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им “удушливым воздухом”, не поддерживает дыхания и горения. В 1787 году А. Лавуазье установил, что “жизненный” и “удушливый” газы, входящие в состав воздуха, это простые вещества, и предложил название “азот”. В 1784 г. Г. Кавендиш показал, что азот входит в состав селитры; отсюда и происходит латинское название азота (от позднелатинского nitrum - селитра и греческого gennao - рождаю, произвожу), предложенное в 1790 году Ж. А. Шапталем .К началу ХIX в. были выяснены химическая инертность азота в свободном состоянии и исключительная роль его в соединениях с другими элементами в качестве связанного азота.
2. Распространяемость в природе. Азот - один из самых распространенных элементов на Земле, причем основная его масса (около 4*10 15 т.)сосредоточена в свободном состоянии в атмосфере. В воздухе свободный азот (в виде молекул N 2 ) составляет 78,09% по объему ( или 75,6% по массе ), не считая незначительных примесей его в виде аммиака и окислов. Среднее содержание азота в литосфере 1,9*10 -3 % по массе. Природные соединения азота - хлористый аммоний NH 4 CI и различные нитраты. Крупные скопления селитры характерны для сухого пустынного климата ( Чили, Средняя Азия ). Долгое время селитры были главным поставщиком азота для промышленности ( сейчас основное значение для связывания азота имеет промышленный синтез аммиака из азота воздуха и водорода ). Небольшие количества связанного азота находятся в каменном угле ( 1 - 2,5% ) и нефти ( 0,02 - 1,5% ), а также в водах рек, морей и океанов. Азот накапливается в почвах ( 0,1% ) и в живых организмах ( 0,3% ).
Хотя название “азот” означает “не поддерживающий жизни”, на самом деле это - необходимый для жизнедеятельности элемент. В белке животных и человека содержится 16 - 17% азота. В организмах плотоядных животных белок образуется за счет потребляемых белковых веществ, имеющихся в организмах травоядных животных и в растениях. Растения синтезируют белок, усваивая содержащиеся в почве азотистые вещества, главным образом неорганические. Значительные количества азота поступают в почву благодаря азотфиксирующим микроорганизмам, способным переводить свободный азот воздуха в соединения азота.
В природе осуществляется круговорот азота, главную роль в котором играют микроорганизмы - нитрофицирующие, денитрофицирующие, азотфиксирующие и др. Однако в результате извлечения из почвы растениями огромного количества связанного азота ( особенно при интенсивном земледелии ) почвы оказываются обедненными. Дефицит азота характерен для земледелия почти всех стран, наблюдается дефицит азота и в животноводстве ( “белковое голодание” ). На почвах, бедных доступным азотом, растения плохо развиваются. Хозяйственная деятельность человека нарушает круговорот азота. Так, сжигание топлива обогащает атмосферу азотом, а заводы, производящие удобрения, связывают азот из воздуха. Транспортировка удобрений и продуктов сельского хозяйства
перераспределяет азот на поверхности земли.
Азот - четвертый по распространенности элемент Солнечной системы ( после водорода, гелия и кислорода).
3.Атом и молекула. Внешняя электронная оболочка атома азота состоит из 5 электронов ( одной неподеленной пары и трех неспаренных - конфигурация 2s 2 2p 3 ). Чаще всего азот в соединениях 3-ковалентен за счет неспаренных электронов ( как в аммиаке NH 3 ). Наличие неподеленной пары электронов может приводить к образованию еще одной ковалентной связи, и азот становится 4-ковалентным ( как в ионе аммония NH 4 + ). Степени окисления азота меняются от +5 ( в N 2 O 5 ) до -3 ( в NH 3 ). В обычных условиях в свободном состоянии азот образует молекулу N 2 , где атомы азота связаны тремя ковалентными связями. Молекула азота очень устойчива: энергия диссоциации ее на атомы составляет 942,9 кдж/моль, поэтому даже при температуре 3300 0 С степень диссоциации азота составляет лишь около 0,1%.
4.Физические и химические свойства. Азот немного легче воздуха; плотность 1,2506 кг/м 3 ( при 0 0 С и 101325 н/м 2 или 760 мм. рт. ст. ), t пл -209,86 0 С, t кип -195,8 0 С. Азот сжижается с трудом: его критическая температура довольно низка (-147,1 0 С), а критическое давление высоко 3,39 Мн/м 2 (34,6 кгс/см 2 );плотность жидкого азота 808 кг/м 3 . В воде азот менее растворим, чем кислород: при 0 0 С в 1 м 3 H 2 O растворяется 23,3 г азота. Лучше, чем в воде, азот растворим в некоторых углеводородах.
Только с такими активными металлами, как литий, кальций, магний, азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом N 2 O, NO, N 2 O 3 , NO 2 и N 2 O 5 . Из них при непосредственном взаимодействии элементов ( 4000 0 С ) образуется окись NO, которая при охлаждении легко окисляется далее до двуокиси NO 2 . В воздухе окислы азота образуются при атмосферных разрядах. Их можно получить также действием на смесь азота с кислородом ионизирующих излучений. При растворении в воде азотистого N 2 O 3 и азотного N 2 O 5 ангидридов соответственно получаются азотистая кислота НNO 2 и азотная кислота НNO 3 , образующие соли - нитриты и нитраты. С водородом азот соединяется только при высокой температуре и в присутствии катализаторов, при этом образуется аммиак NH 3 . Кроме аммиака, известны и другие многочисленные соединения азота с водородом, например гидразин H 2 N-NH 2 , диимид HN-NH, азотистоводородная кислота HN 3 (H-N=N=N), октазон N 8 H 14 и др.; большинство соединений азота с водородом выделено только в виде органических производных. С галогенами азот непосредственно не взаимодействует, поэтому все галогениды азота получают косвенным путем, например фтористый азот NF 3 - при взаимодействии фтора с аммиаком. Как правило, галогениды азота - малостойкие соединения ( за исключением NF 3 ); более устойчивы оксигалогениды азота - NOF, NOCI, NOBr, NO 2 F и NO 2 CI. С серой также не происходит непосредственного соединения азота; азотистая сера N 4 S 4 получается в результате реакции жидкой серы с аммиаком. При взаимодействии раскаленного кокса с азотом образуется циан (СN) 2 . Нагреванием азота с ацетиленом С 2 Н 2 до 1500 0 С может быть получен цианистый водород HCN. Взаимодействие азота с металлами при высоких температурах приводит к образованию нитридов (например, Mg 3 N 2 ).
При действии на обычный азот электрических разрядов или при разложении нитридов бора, титана, магния и кальция, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. В отличие от молекулярного, активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
Азот входит в состав очень многих важнейших органических соединений ( амины, аминокислоты, нитросоединения и др. ).
5.Получение и применение. В лаборатории азот легко может быть получен при нагревании концентрированного нитрита аммония: NH 4 NO 2 N 2 + 2H 2 O. Технический способ получения азота основан на разделении предварительно сжиженного воздуха, который затем подвергается разгонке.
Основная часть добываемого свободного азота используется для промышленного производства аммиака, который затем в значительных количествах перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т. д. Помимо прямого синтеза аммиака из элементов, промышленное значение для связывания азота воздуха имеет разработанный в 1905 цианамидный метод, основанный на том, что при 1000 0 С карбид кальция (получаемый накаливанием смеси известии угля в электрической печи) реагирует со свободным азотом: CaC 2 + N 2 CaCN 2 + C. Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выделением аммиака: CaCN 2 + 3H 2 O CaCO 3 + 2NH 3 .
Cвободный азот применяют во многих отраслях промышленности: как инертную среду при разнообразных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т. д. Жидкий азот находит применение в различных холодильных установках. Его хранят и транспортируют в стальных сосудах Дьюара, газообразный азот в сжатом виде - в баллонах. Широко применяют многие соединения азота. Производство связанного азота стало усиленно развиваться после 1-й мировой войны и сейчас достигло огромных масштабов.
Азотная кислота не отличается прочностью, Уже под влиянием света она постепенно разлагается:
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н и- NO.
7. Окислительные свойства азотной кислоты. Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота—один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO, ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы—в оксиды.
Концентрированная HNO пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO. Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние.
Степень окисленности азота в азотной кислоте равна 4-5. Выступая в качестве окислителя, НNО может восстанавливаться до различных продуктов:
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется . При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется NO . В случае более активных металлов — железа, цинка, — образуется. Сильно разбавленная азотная кислота взаимодействует с активными металлами—--цинком, магнием, алюминием—с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой;
При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до , например
Более разбавленная кислота обычно восстанавливается до NO, например:
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием , протекают сложно.
Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям.
С избытком соляной кислоты хлорид золота(III) и хлорид платины (IV) образуют комплексные соединения
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами . Этот процесс называется нитрованием и имеет большое значение в органической химии.
Азотная кислота — одно из важнейших соединений азота: в больших количествах она расходуется в производстве, азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
7. Нитраты. Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия или натриевая селитра, иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия , или калийная селитра, в небольших количествах также встречается в природе, но главным образом получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
Нитрат кальция или кальциевая селитра, получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
8. Промышленное получение азотной кислоты. Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При« описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение
Образовавшийся легко переходит в, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
9. Круговорот азота в природе. При гниении органических веществ значительная часть содержащегося в них азота превращается в аммиак, который под влиянием живущих в почве нитрифицирующих бактерий окисляется затем в азотную кислоту. Последняя, вступая в реакцию с находящимися в почве карбонатами, например с карбонатом кальция, образует нитраты:
Некоторая же часть азота всегда выделяется при гниении в свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, каменного угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих денитрифицирующих бактерий приводит к тому, что часть азота из доступной для зеленых растений формы (нитраты) переходит в недоступную (свободный азот). Таким образом, далеко не весь азот, входивший в состав погибших растений, возвращается обратно в почву; часть его постепенно выделяется в свободном виде.
Таким образом, в природе совершается непрерывный круговорот азота. Однако ежегодно с урожаем с полей убираются наиболее богатые белками части растений, например зерно. Поэтому в почву необходимо вносить удобрения, возмещающие убыль в ней важнейших элементов питания растений.
Изучение вопросов питания растений и повышения урожайности последних путем применения удобрений является предметом специальной отрасли химия, получившей название агрохимии.
Жизнь и творчество Азота.
Жил-был никому не известный химический элемент. Никто даже не знал, как его зовут. Однажды Д. Резерфорд, сжигая фосфор и другие вещества, увидел, что в колбе остаётся какой-то “удушливый воздух” не поддерживающий дыхания и горения. В 1790 году добрый дядя Шапталь придумал имя этому веществу – Азот.
Получив название, Азот, стал самым распространенным на Земле. Он вылез в литосферу, атмосферу. Получив огромную известность, Азот стал понтоваться у себя в V группе. И став самым крутым, он решил завоевать все Менделеевку, но ничего у него не вышло. Первые пять групп он завоевал, а остальные не получилось. Разочаровавших в своих силах Азот решил пожить спокойно и завести себе подругу. Долго он выбирал спутницу жизни, потому что выбирал по многим критериям: чтоб была так же сильно распространена, как и он; чтоб имела такое же важное значение для жизни людей; чтоб была такой же сильной, а можно даже сильнее. И остановил он свой выбор на Кислороде, которую в народе кликали Кислая. Выбрать то выбрал, но у Кислой тож имелся друг, посильнее Азота – Ваван-водород. И решил тогда Азот с помощью своего кореша Михи-Молнии встретиться с Кислой. Договорившись на первый дождливый день, Азот стал ждать встречу с Кислой. И наконец этот день наступил. И вот летят два корефана Миха-молния и Азот. Увидел их Вован и понял, что летят к его возлюбленной. Рассердился он и полетел к Кислой. Подоспел он как раз вовремя. Но это его и погубило: сначала он ничего не понял. В голове его понеслось сразу же много мыслей: ”Где это я? Что со мной? Почему я такой тяжелый и жидкий? Где Кислая?” Но со временем его голова прояснилась и он подумал: “Наверно со мной произошло то, о чём рассказывала Любовь Николаевна на уроках. Скорее всего я вступил в химическую реукцию или как то так.” Но так как Вован плохо учил химию он некогда и не узнал, что стал водой.
В это время Азот и Кислая стали какими то неразрывными, рыжими и воздушными. “Лисий хвост,”- подумал Азот. “Борода,”- подумала Кислая. Но прийти к более существенным выводам они не успели, лисий хвост соединился с водой. И получилась Азотная кислота.
С тех пор Вован, Азот и Кислая живут дружной семьёй. Вован с Азотом померились, а Кислая стала уделять одинаковое количество внимания, что Азоту, что Вовану.
После нескольких дней спокойной жизни, уговорил Азот Вована пойти поваевать. Ну пошли он, стали одними из сильнейших мира сего, но был у них один недостаток: боялись света и при виде его начанали трястись от страха и разлагаться.
Азот — это химическое соединение. В природе и окружающем нас мире оно достаточно распространено. Например, очень много его содержится в земной коре. Но еще больше в воздухе: он является главной составляющей того, чем мы дышим. Воздух — это смесь азота, кислорода и водорода. Также вещество встречается в воде, в которой мы купаемся, приезжая отдохнуть на речку, озеро или море.
Свойства азота
Ни увидеть, ни почувствовать его нельзя. Он не имеет вкуса, цвета и запаха. Тем более, никак нельзя его увидеть в космосе, где он также присутствует в виде облачных следов, остающихся после проносящихся с большой скоростью комет. Много его и вокруг Солнца.
Этот элемент может соединяться с другими химическими элементами. Соединения азота постоянно окружают нас в повседневной жизни, но они не опасны для здоровья человека. Люди ценят его, потому что он содержится в топливе, которое обогревает наши дома, заставляет работать заводы и машины. Нефть очень ценится в любой стране, а в ее состав, между прочим, этот элемент тоже входит.
Да что там говорить, он содержится даже в нас с вами, и в наших домашних животных, и в растениях, которые мама выращивает на подоконнике. Он содержится в организме любого живого существа, поддерживает его жизнь.
Пища, которую мы употребляем, содержит белки, жиры и углеводы. Белки необходимы растущему организму, а в их состав тоже входит азот!
Азот в круговороте веществ
В природе происходит постоянный круговорот веществ. Например, дождь, который выпал на землю и впитался в почву или попал в водоем, впитал в себя многие вещества, встретившиеся на его пути, в том числе и азот в разных соединениях, а потом вдруг выглянуло солнце. Началось испарение воды и с поверхности земли, и из водоемов: в виде газов соединения поднялись в атмосферу, и стали формироваться тучи. Тучи сгущались, гремел гром, и вновь пошел дождь. Разные химические вещества вместе с водой снова вернулись на Землю.
В удобрениях, которые люди используют в садах и огородах, азот содержится обязательно. Именно благодаря ему вырастают такие красивые цветы и такие вкусные ягоды, которыми лакомятся дети, а в магазинах не кончается хлеб, приготовленный из зерновых растений, выращенных на полях.
Данное химическое соединение присутствует в природе в большом количестве, но люди могут производить его самостоятельно в специальных лабораториях, причем как в виде газа, так и в виде жидкости. Хранят его в специальных баллонах черного цвета под давлением.

Категория: Ископаемые

Азот – это химический элемент с атомным номером 7. Является газом без запаха, вкуса и цвета.
Таким образом, человек не ощущает присутствия азота в земной атмосфере, между тем как она состоит из этого вещества на 78 процентов. Азот относится к самым распространенным веществам на нашей планете. Часто можно слышать, что без азота не было бы жизни на Земле, и это правда. Ведь белковые соединения, из которых состоит все живое, обязательно содержат в себе азот.
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии, круговорот азота
На Земле азот претерпевает ряд трансформаций, в которых участвуют и биотические (связанные с жизнью) и абиотические факторы. Из атмосферы и почвы азот поступает в растения, причем не напрямую, а через микроорганизмы. Азотфиксирующие бактерии удерживают и перерабатывают азот, превращая его в форму, легко усваиваемую растениями. В организме растений азот переходит в состав сложных соединений, в частности – белков.
По пищевой цепи эти вещества попадают в организмы травоядных, а затем – хищников. После гибели всего живого азот вновь попадает в почву, где подвергается разложению (аммонификации и денитрификации). Азот фиксируется в грунте, минералах, воде, попадает в атмосферу, и круг повторяется.
Применение азота
– в медицине. Жидкий азот является хладагентом при процедурах криотерапии, то есть лечения холодом. Мгновенная заморозка применяется для удаления различных новообразований. В жидком азоте хранят образцы тканей и живые клетки (в частности – сперматозоиды и яйцеклетки). Низкая температура позволяет сохранить биоматериал в течение длительного времени, а затем разморозить и использовать.
Возможность хранить в жидком азоте целые живые организмы, а при необходимости размораживать их без всякого вреда высказана писателями-фантастами. Однако в реальности освоить эту технологию пока не удалось;
– в пищевой промышленности жидкий азот используется при розливе жидкостей для создания инертной среды в таре.
Вообще азот применяется в тех областях, где необходима газообразная среда без кислорода, например,
– в пожаротушении. Азот вытесняет кислород, без которого процессы горения не поддерживаются и огонь затухает.
Газообразный азот нашел применение в таких отраслях:
– производство продуктов питания. Азот используется как инертная газовая среда для сохранения свежести продуктов в упаковке;
– в нефтедобывающей промышленности и горном деле. Азотом продувают трубопроводы и резервуары, его нагнетают в шахты для формирования взрывобезопасной газовой среды;
– в самолетостроении азотом накачивают шины шасси.
Все вышесказанное относится к применению чистого азота, но не стоит забывать, что этот элемент является исходным сырьем для производства массы всевозможных соединений:
– аммиак. Чрезвычайно востребованное вещество с содержанием азота. Аммиак идет на производство удобрений, полимеров, соды, азотной кислоты. Сам по себе применяется в медицине, изготовлении холодильной техники;

– красители и т.д.
Азот – не только один из наиболее распространенных химических элементов, но и очень нужный компонент, применяемый во многих отраслях человеческой деятельности.

Средняя оценка: 4.4
Всего получено оценок: 533.
Средняя оценка: 4.4
Всего получено оценок: 533.
Азот экспериментальным путем был обнаружен шотландским химиком Д. Резерфордом в 1772 году. В природе азот находится в основном в свободном состоянии и является одной из главных составляющих воздуха. Каковы же физические и химические свойства азота?
Общая характеристика
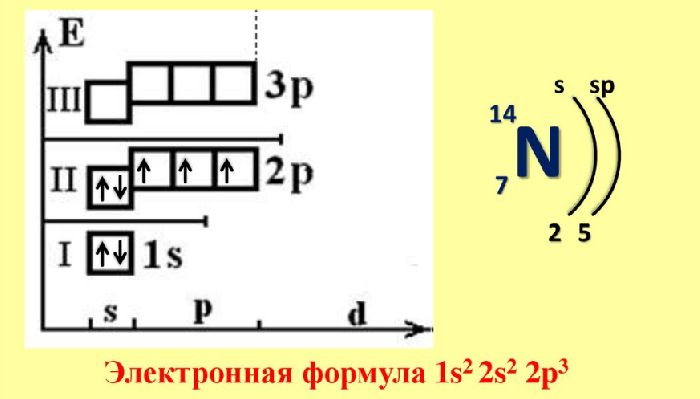
Рис. 1. Электронная конфигурация азота.
Азот – элемент второго периода, не имеет возбужденных состояний, так как атом не имеет свободных орбиталей. Но этот химический элемент может проявлять в основном состоянии валентность не только III, но и IV за счет образования ковалентной связи по донорно-акцепторному механизму с участием неподеленной электронной пары азота. Степень окисления, которую может проявлять азот, изменяется в широких пределах от -3 до +5.
при изучении строения молекулы азота необходимо помнить, что химическая связь осуществляется за счет трех общих пар p-электронов, орбитали которых направлены по осям x, y, z.
Химические свойства азота
В природе азот встречается в виде простого вещества – газа N2 (объемная доля в воздухе 78%) и в связанном состоянии. В молекуле азота атомы связаны прочной тройной связью. Энергия этой связи составляет 940 кДж/моль. При обычной температуре азот может взаимодействовать только с литием (Li3 N). После предварительной активизации молекул путем нагревания, облучения или действием катализаторов азот вступает в реакции с металлами и неметаллами. Азот может вступать в реакции с магнием, кальцием или, например, алюминием:
Особенно важен синтез аммиака из простых веществ – азота и водорода в присутствии катализатора (губчатое железо):N2+3H2=2NH3+Q. Аммиак – бесцветный газ с резким запахом. Он хорошо растворим в воде, что в значительной степени обусловлено образованием водородных связей между молекулами аммиака и воды, а также реакцией присоединения к воде по донорно-акцепторному механизму. Слабощелочная реакция раствора обусловлена наличием в растворе ионов OH- (в небольшой концентрации, так как степень диссоциации гидроксида аммония очень мала – это слабое растворимое основание).
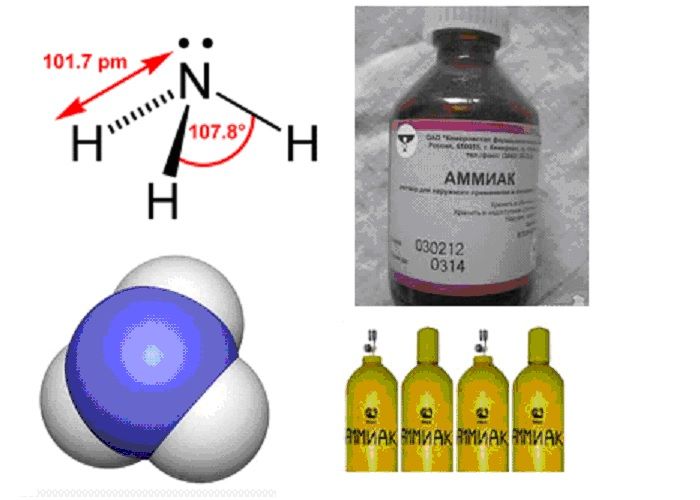
Рис. 2. Аммиак.
Из шести оксидов азота – N2O, NO, N2O3, NO2, N2O4, N2O5, где азот проявляет степень окисления от +1 до +5, два первых – N2O и NO – несолеобразующие, остальные вступают в реакцию с образованием солей.
Азотную кислоту, самое важное соединение азота, в промышленности получают из аммиака в 3 стадии:
- окисление аммиака на платиновом катализаторе:
Азот также может реагировать при высоких температурах и давлении (в присутствии катализатора) с водородом:

Рис. 3. Азотная кислота.
Применение азота
Основное применение азот находит в качестве исходного продукта для синтеза аммиака, а также для производства азотной кислоты, минеральных удобрений, красителей, взрывчатых веществ и других азотосодержащих соединений. Жидкий азот используют в охладительных системах. Для придания стали большей твердости, увеличения износостойкости, коррозионной стойкости и теплостойкости ее поверхность насыщают азотом при высоких температурах. Такая сталь выдерживает нагревание до 500 градусов без потери своей твердости.
Что мы узнали?
Азот – бесцветный газ без запаха, цвета и вкуса. В школьном курсе химии изучаются его основные свойства, а также способность вступать в реакцию с металлами и неметаллами при нормальных условиях, а также под действием катализаторов.
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.


Около двухсот лет назад ученые открыли, что в атмосфере содержится газ, непригодный для дыхания и не поддерживающий горение. Атмосфера почти на 4/5 состоит из этого газа. Вновь открытый газ стали называть "", что в переводе с греческого значит "нежизненный".
В обычных лабораторных условиях азот "не желал" соединяться с другими элементами. Однако вскоре стало известно, что в природе азот часто встречается в соединении с другими элементами, образуя, например, селитру — природную соду, щелочь. Ее люди знали давно и использовали как удобрение для полей. Отсюда латинское название азота — "нитрогениум", по-русски — "селитрообразователь". Как же атмосферный азот соединяется с другими веществами? Во-первых, во время гроз. Молния на мгновение так повышает температуру воздуха, что молекулы азота в этом месте сразу начинают бурно соединяться с молекулами кислорода, водорода и других элементов. Дождь растворяет эти соединения и уносит их в почву. Во-вторых — и у природы этот путь самый главный, — за азотом "охотятся" некоторые виды бактерий, обитающие в почве. В отличие от растений и животных они поглощают азот прямо из воздуха, в их организме азот соединяется с другими веществами. Так создаются запасы его в почве.
Азот входит в состав веществ, из которых состоит белок. А белки — основа всего живого: и бактерий, и растений, и животных, и человека. Значит, без азота на Земле не было бы жизни! Растения получают из почвы питательные вещества, богатые азотистыми соединениями, и строят из этих веществ с помощью солнечного света новые клетки. Травоядные животные поедают траву и листья и получают необходимый для жизни азот. Хищники охотятся за травоядными, питаются их мясом — это их способ получения азота. Всякий раз, когда животное или растение погибает, азот снова оказывается в почве — и все начинается сначала. А топливо, которое люди сжигают в двигателях и топках, возвращает содержащийся в нем азот уже не в почву, а прямо в атмосферу. Так в природе происходит постоянный круговорот азота. Но соединения азота нужны не только как удобрения для полей. Вещества, включающие в себя азот, человек использует для производства искусственных волокон, лекарств, взрывчатых веществ, красок, лаков и многого другого. Все это получают на химических заводах, которые перерабатывают азот, добывая его из воздуха.
Читайте также:

