Доклад на тему аллотропные модификации олова
Обновлено: 18.05.2024

Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.Элемент состоит из 10 изотопов с массовыми числами 112, 114-120, 122, 124; последний слабо радиоактивен; изотоп 120 Sn наиболее распространен (около 33%).
СТРУКТУРА
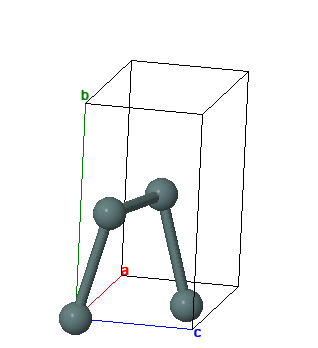
Олово имеет две аллотропные модификации: a-Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b-Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (-30° С) и в присутствии зародышей кристаллов серого олова; известны случаи, когда оловянные изделия на морозе рассыпались в серый порошок (“оловянная чума”), но это превращение даже при очень низких температурах резко тормозится наличием мельчайших примесей и поэтому редко встречается, представляя скорее научный, чем практический интерес.
СВОЙСТВА

Плотность b-Sn 7,29 г/см 3 , плотность a-Sn 5.85 г/см 3 ,. Температура плавления 231,9°C, температура кипения 2270°C.
Температурный коэффициент линейного расширения 23·10 -6 (0-100 °С); удельная теплоемкость (0°С) 0,225 кдж/(кг·К), то есть 0,0536 кал/(г·°С); теплопроводность (0°С) 65,8 вт/(м·К.), то есть 0,157 кал/(см·сек·°С); удельное электрическое сопротивление (20 °С) 0,115·10 -6 ом·м, то есть 11,5·10 -6 ом·см. Серое олово является диамагнетиком, а белое – парамагнетиком.
Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2 ); относительное удлинение 80-90%; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2 ). При изгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется.
ЗАПАСЫ И ДОБЫЧА

Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10 −4 до 8·10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем ~ 10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
ПРОИСХОЖДЕНИЕ

Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
В общем можно выделить следующие формы нахождения олова в природе:
- Рассеянная форма: конкретная форма нахождения олова в этом виде неизвестна. Здесь можно говорить об изоморфно рассеянной форме нахождения олова вследствие наличия изоморфизма с рядом элементов (Ta, Nb, W — с образованием типично кислородных соединений; V, Cr, Ti, Mn, Sc — с образованием кислородных и сульфидных соединений). Если концентрации олова не превышают некоторых критических значений, то оно изоморфно может замещать названные элементы. Механизмы изоморфизма различны.
- Минеральная форма: олово установлено в минералах-концентраторах. Как правило, это минералы, в которых присутствует железо Fe +2 : биотиты, гранаты, пироксены, магнетиты, турмалины и т. д. Эта связь обусловлена изоморфизмом, например, по схеме Sn +4 + Fe +2 → 2Fe +3 . В оловоносных скарнах высокие концентрации олова установлены в гранатах (до 5,8 вес.%) (особенно в андрадитах), эпидотах (до 2,84 вес.%) и т. д.
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
ПРИМЕНЕНИЕ
Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Вещество представляет собой пластичный ковкий металл, который легко плавится и поддается пайке. Химический элемент олово — нетоксичное покрытие, трудно поддающееся коррозии. Металл серебристо-белого цвета используется в чистом виде или с примесью других веществ. В основном олово применяется при изготовлении пищевой тары, домашних трубопроводов, припоев в электронике, подшипников и других деталей.

Общее описание
Люди начали добывать руду металла еще в IV веке до нашей эры. Древние греческие и римские предметы изготавливались из оловянистой бронзы, которая была в обиходе в те времена. Сплавы содержали также примесь свинца и меди, а чистый металл научились получать только в VII веке.

Редкий элемент занимает 46-е место по распространенности в коре земли. Он залегает в виде касситерита, в массе которого содержится до 78% олова. Реже встречается оловянный колчедан с примесью меди и железа. Олово относится к группе амфотерных веществ. Элемент способен к проявлению основных и кислотных характеристик.
Металл образует отдельные кварц-касситеритовые жилы благодаря тесной связи кислородных соединений олова с ангидритами гранита. Щелочные свойства проявляются в образовании различных соединений сульфидов, вплоть до возникновения интерметаллических слияний и самородного сплава олова в основных породах.
Белое и серое олово
Различают несколько аллотропных модификаций олова. В обычных условиях существует белое олово, которое является устойчивым при температуре свыше +13,3˚С. Это мягкий металл, образующий кристаллы с элементарными ячейками, где два одинаковых вектора и третий отличный от них располагаются строго перпендикулярно друг другу. Характерный хруст слышится при сгибании прутка. Звук возникает при трении кристаллов.
Охлаждение вещества ведет к образованию серого олова. При этом возникают кубические кристаллы, отличающиеся алмазной структурой. Ионизирующее излучение также способствует переходу из одной модификации в другую и кристаллизации по карбонатному типу.

Трансформация структуры ведет к следующим изменениям:
- удельный объем увеличивается;
- плотность олова уменьшается;
- металл становится порошкообразным.
Электрофизические свойства двух вариаций разнятся из-за отличия структурных решеток и валентности. Белое олово относится к группе металлов, а серое получает характеристики ковалентного кристалла алмазной структуры. Соприкосновение двух модификаций ведет к ускорению электронного фазового перехода, так как зарождаются новые формы кристаллов. Такое явление получило наименование оловянной чумы. Используется стабилизатор (например, висмут) для предотвращения этого процесса. Катализатор гексахлорстаннат аммония, наоборот, ускоряет переход.
Изотопы элемента
Олово в природе содержит 10 неизменных нуклидов с определенным суммарным числом нейтронов, протонов и электронов в молекуле. Атомный заряд также является постоянным и соответствует порядковому номеру элемента в таблице Менделеева в химии.
Массовые числа нуклидов с изменением содержания в массе:

- 112 — 0,96% в смеси.
- 114 — 0,66%.
- 115 — 0,35%.
- 116 — 14,3%.
- 117 — 7,61%.
- 118 — 24,03%.
- 119 — 8,58%.
- 120 — 32,85%.
- 122 — 4,72%.
- 124 — 5,94%.
Некоторые элементы могут подвергаться энергетическому двойному распаду, но такое явление до сегодняшнего дня не наблюдалось из-за величины теоретического времени распада, равного 10 20 лет. У олова выделяется самое большее количество стабильных изотопов. Они заполняют протонную капсулу и увеличивают устойчивость ядра.
Свойства металла

Олово относится к безопасным для человека веществам. В организм человека оно ежедневно попадает с пищей в минимальных пропорциях (0,25−3,4 мг). В теле содержится около (1−2) . 10 -4 % металла. Самая высокая концентрация выявляется в кишечнике. Регулярное вдыхание паров или воздушных частиц может нанести вред и привести к легочным заболеваниям. Людям, работающим с органическими сплавами олова, рекомендуется надевать защитные костюмы.
Причиной отравления может стать употребление старых консервов, в которых органические продукты реагируют с внутренним покрытием из олова, происходит окисление, при этом выделяется оловянистый водород. Роль вещества в организме человека практически не изучена. Металлическое олово считается нетоксичным для человека, поэтому применяется для покрытия жестяных тар для продуктов.
Физические характеристики
Плотность металла в твердой фракции при обычной температуре (+ 20−22˚С) составляет 7,3 г/см 3 , повышение показателей до температуры плавления олова (+231,8˚С) снижает плотность жидкого металла до 6,97 г/см 3 . Процесс кипения начинается в условиях температуры +2615˚С.
Другие факты:

- Показатель линейного расширения составляет 1,99 . 10 -5 К -1 (при 0˚С), а при температуре +100˚С равняется 2,38 . 10 -5 К -1 .
- Удельная теплоемкость твердого вещества в обычном состоянии — 225 Дж/кг . К, а в жидком —в пределах 269 Дж/кг . К.
- Молярная теплоемкость белого олова — 27,1Дж/моль . К, серой модификации — 25,8 Дж/моль . К.
- Показатель плавления составляет 7,2 кДж/моль.
- Для испарения требуется 296 кДж/моль.
- Удельное сопротивление электричеству — 0,115−0,128 мкОм . м в условиях температуры +25˚С.
Упругость материала снижается при повышении температуры, при 0˚С модуль равен 55 Гпа, а при +100˚С — 48 Гпа. Временное сопротивление на разрыв равняется 20 Мпа, относительное удлинение при этом составляет 40%. Модуль сдвига находится в пределах 16,9−8,2 Гпа.
Химические показатели
Металл проявляет устойчивость к действию окружающего воздуха или влаги в условиях комнатной температуры. Инертность материала объясняется появлением оксидной пленки на поверхности. Олово начинает окисляться на воздухе при увеличении температуры свыше +150˚С. Металл обладает двумя окислительными степенями, +2 и +4. Первая имеет меньшую устойчивость.
Формулы характерных химических реакций:
- Холодная азотистая кислота реагирует с оловом, формула следующая: 4 Sn + 10 HNO 3 = NH 4 NO 3 + 4 Sn (NO 3) 2 + 3 H 2 O).
- В случае нагревания с концентрированной формой HN О 3 используется свойство окисления олова, при этом выделяется осадок с переменной гидратацией — 3 Sn + n H 2 O + 4 HNO 3 = 4 NO + 3 H 2 S n O 3 . n H 2 O.
- Нагревание олова в насыщенном щелочном растворе имеет обозначение по формуле 2 KOH + Sn + 4 H 2 O = 2 H 2 + K 2 (Sn (OH) 6).
Галогенные металлы дают сплавы с содержанием SnX 2 и SnX 4. Первые представляют собой солеобразные растворы с ионами, вторые подлежат водной гидролизации, но могут растворяться в органических жидкостях неполярного типа. При соединении с сухим хлором продуцируется тетрахлорид, который представляет собой жидкость без цвета, растворяющую йод, серу.
Этапы производства
При получении олова рудная порода касситерит дробится в мельницах до появления частиц размером около 1 см. Следующий этап — отделение вещества от пустой породы путем вибрации на гравитационных столах. Затем используется метод очистки и обогащения руды для повышения олова в составе до 45−72%.
Последующий обжиг удаляет мышьяк и серу, а полученный концентрат поступает на обжиг в печи. В жерле древесный уголь укладывается вперемежку с образцами руды и алюминием. Чистый металл полупроводниковой чистоты получают способом расплавления твердых веществ или методом очистки под действием электролиза.
Основные месторождения находятся на юго-востоке Азии и Китае, крупные добычи находятся в Австралии и Америке. Россия славится залежами олова в Хабаровском и Приморском крае, Чукотском АО, Якутии и других регионах.

Нахождение в природе
Чаще всего олово содержится в горных породах в виде рассеянных форм. Но в кислых образованиях руда встречается в виде минеральных вкраплений и залежей касситерита, который является интересным для производства в промышленных масштабах.
Формы содержания вещества в природе:
- минеральные вкрапления;
- окисные соединения;
- коллоидные формы;
- жидкие фазы.

Рассеянные залежи не отличаются конкретной формой содержания. Наблюдается изоморфно разбросанные сульфидные и кислородные сращения. На месторождениях первого вида олово представлено сфалеритами, халькопиритами, пиритами. В результате распада возникают элементы тилита и других минеральных веществ. В России изоморфные рассеивания обнаруживаются в Приморье, например, в Дубровском и Смирновском месторождении.
Минеральные формы
В группу входят самородки и сплавы интерметаллических образований. Концентрации в почве являются низкими, но такие залежи сконцентрированы на широких площадях. Вместе с оловом обнаруживается руда меди, алюминия, железа, не считая характерных самородков серебра, золота и платиноидов.
Эти же элементы участвуют в образовании сплавов олова:
- атакит;
- стистаит;
- звягинцевит;
- штурмылит.
Приведенные образования встречаются в интрузивных породах магния, например, пикритах и траппах в области Сибирской платформы. Габброиды и гипербазиты располагаются в грунтах Камчатки. Гидротермальные и метасоматические породы находятся в составе никелевых и медных руд в бассейнах Урала, Узбекистана, Кавказа. Пелагические осадочные соединения являются результатом Большого Толбачинского извержения.
Окисные соединения
Наиболее распространены в природе в форме касситеритов (Sn O 2), являющихся оксидами олова. Гамма-резонансное исследование показывает присутствие Sn +4 . Соединения включают до 78% олова в форме сплошных вкраплений с отдельными зернами минерала величиной 3−5 мм.
Встречаются формы касситеритов:

- Гидроокисные сплавы представлены в природе осадками полиоловянной кислоты. К ним относят сукулаиты, варламовиты, гидромартиты, гидростаннаты.
- Силикаты находятся в форме малаяитов, стоказитов, пабститов. Первый вид минералов встречается в больших масштабах.
- Сульфидные образования металла представлены серой в сочетании с оловом и являются второй по значению группой для промышленных разработок. Более сложные соединения имеют в составе медь, свинец. В породах чаще других встречаются халькопириты.
- Станнины имеют второе название оловянного колчедана. Минералы широко добываются в Якутии и Приморье. Во многих случаях представляет основу для образования халькопирита.
Касситериты являются отличным материалом для получения чистого олова. В России добываются в Забайкалье, разрабатываются в районах Средней Азии. Мировые бассейны располагаются в Таиланде, Боливии, Малайзии, Китае, Индонезии, Нигерии.
Коллоидные формирования
Кремниево-коллоидные виды играют большую роль в геохимических процессах, хотя их детальное изучение не проводилось. Соединения относятся к вязкой форме выражения коломорфных касситеритов, которые подвергаются кристаллическим преобразованиям. Обнаружена сильная растворимость олова в кремниево-хлористых составах.
Анализ характеристик соединений и их похожесть на Si (OH) 4 показывает способность к получению высокомолекулярного материала (полимера) методом присоединения олигомеров и мономеров к активным молекулам. В результате возникает соединение с замещением анионами хлора и фтора группы ОН. Полимеризация вызывает образование дисперсного геля. Такая форма относится к промежуточным этапам при выделении осадка из гидротермальных веществ.
Жидкая фаза
В газовых и жидких образованиях горных пород выявляются касситериты в категории заключенных минералов. Природные растворы с включением олова почти не анализировались, информация получена после экспериментальных методов исследования.
Виды содержания олова в природных жидкостях делятся на категории:
- Ионные соединения. Их строение изучалось с точки зрения валентных сцеплений и стереохимических сочетаний. Выделяются подкатегории ионов, галогенидов, гидроксильных и сульфидных образований.
- Комплексные формирования. Получаются в результате травления касситеритов в среде с высокой концентрацией фтора или хлора.
Редко встречаются олово — кремниевые и дисперсные гелевые вкрапления в жидкой природной среде. Фундаментом этих форм являются минеральные материалы. Соединения проявляют свойства слабых оснований в кислых породах.
Олово — металл, служивший человеку с незапамятных времен. Физические свойства олова обеспечили его основополагающую роль в истории человечества. Без него невозможно существование бронзы, остававшейся на протяжении многих веков единственным сплавом, из которого человек изготовлял практически все — от орудий труда до ювелирных украшений.

Физические свойства олова
При нормальном давлении и температуре 20°C олово идентифицируется как металл с блеском бело-серебристого цвета. Медленно тускнеет на воздухе вследствие образования оксидной пленки.
Для олова, как и для всех металлов, характерна непрозрачность. Свободные электроны металлической кристаллической решетки заполняют межатомное пространство и отражают световые лучи, не пропуская их. Поэтому находясь в кристаллическом состоянии, металл имеет характерный блеск, а в порошкообразном виде этот блеск утрачивает.
Обладает отличной ковкостью, т. е. легко подвергается обработке с помощью давления. Ковкость олову придает его высокая пластичность в сочетании с низким сопротивлением деформации. Пластичность металла позволяет раскатать его в тонкую фольгу, называемую станиолем или оловянной бумагой. Ее толщина колеблется от 0,008 до 0,12 мм. Ранее станиоль находил применение в качестве подложки при изготовлении зеркал и в электротехнике при производстве конденсаторов, пока не был полностью вытеснен алюминиевой фольгой.
У олова свойства достаточно мягкого металла. Его твердость по шкале Бринелля составляет 3,9–4,2 кгс/мм².
Относится к легкоплавким металлам. Температура плавления олова – 231,9°C – способствует быстрому извлечению его из руды. Олово просто сплавляется с другими металлами, что обеспечивает его обширное применение в промышленности.
Плотность при температуре 20°C составляет 7,29 г/см³. По этому показателю олово в 2,7 раза тяжелее алюминия, но легче серебра, золота, платины и приближено к плотности железа (7,87 г/см³).
Металл закипает при высокой температуре, равной 2620°C, долго оставаясь жидким в расплаве.
Химически чистое олово при обычной температуре обладает незначительной прочностью. При растяжении предел механической прочности составляет всего 1,7 кгс/мм², а относительное удлинение – 80–90%. Эти характеристики говорят о том, что деформировать оловянный прут можно без особых усилий в разных направлениях. При этом смещение слоев кристаллической решетки металла относительно друг друга сопровождается специфичным треском.
Полиморфизм олова
Полиморфизм (аллотропия) — физическое явление, основанное на перестроении атомов или молекул веществ в твердом состоянии, что влечет за собой изменение их свойств. Каждая полиморфная модификация устойчиво существует только в строго определенном интервале значений температур и давлений.
Любой металл обладает специфической кристаллической решеткой. При изменении внешних физических условий кристаллическая решетка может меняться. Полиморфизм металлов используют при их термической обработке в промышленности.

Химические свойства олова определяются его положением в периодической системе элементов Д. И. Менделеева и предусматривают амфотерность, т. е. способность проявлять как основные, так и кислотные свойства. Напрямую зависят от полиморфизма олова физические свойства.
Для металла известны три аллотропные модификации: альфа, бета и гамма. Полиморфная перестройка кристаллических решеток возможна вследствие изменения симметрии электронных оболочек атомов под воздействием разных температур.
- Для серого олова (α-Sn) характерна гранецентрированная кубическая кристаллическая решетка. Размер элементарной ячейки решетки здесь большой. Это напрямую отражается на плотности. Она меньше, чем у белого олова: 5,85 и 7,29 г/см³ соответственно. По электропроводности альфа-модификация относится к полупроводникам. По магнетизму — к диамагнетикам, т. к. под внешним магнитным воздействием намагничивается против направления внутреннего магнитного поля. Альфа-олово существует до температуры 13,2°C в виде мелкодисперсного порошка и практического значения не несет.
- Белое олово (β-Sn) является самой устойчивой аллотропной модификацией с объемноцентрированной тетрагональной кристаллической решеткой. Существует в диапазоне температурных значений от 13,2 до 161°С. Очень пластично, мягче золота, но тверже свинца. Среди остальных металлов обладает средним значением теплопроводности. Металл относят к проводникам, хотя электропроводность у бета-модификации относительно низкая. Этим свойством пользуются, чтобы уменьшить электропроводность какого-либо сплава путем добавления олова. Является парамагнетиком, т. е. во внешнем магнитном поле намагничивается в направлении внутреннего магнитного поля.
- Гамма-модификация (γ-Sn) обладает ромбической кристаллической решеткой, устойчива в диапазоне температур от 161 до 232°С. С увеличением температуры пластичность возрастает, но, достигнув температуры фазового перехода в 161°С, металл полностью утрачивает это свойство. Гамма-модификация имеет большую плотность при высокой степени хрупкости, т. е. сразу рассыпается в порошок, поэтому практического применения не имеет.
Особенности полиморфного перехода β→α
Процесс перехода из одной полиморфной модификации в другую происходит при изменении температуры. При этом наблюдают скачкообразные изменения физико-химических свойств металла.
Фазовый переход β→α значительно ускоряется при минусовых температурах окружающей среды и сопровождается увеличением удельного объема металла примерно на 25%, что приводит к его рассыпанию в порошок.

Заключение
Олово обладает всеми типичными физическими свойствами металлов, а его полиморфизм по-своему удивителен. Без уникальной тягучести и пластичности этого металла невозможно представить себе современную промышленность. Почти половина от мировой добычи олова используется для производства пищевой жести. Оставшаяся половина расходуется для изготовления сплавов и различных соединений, применяемых во всех хозяйственных отраслях.
Металл олово был открыт раньше железа, а его сплав с медью — самый первый, созданный людьми.
Люди отметили значимость бронзы, назвав эпоху своего развития Бронзовым веком.
Неизвестная история
История открытия олова и сплавов из него покрыта пылью времен. Никто не назовет имени первооткрывателя металла, никто не знает — кто догадался первым сплавить олово с медью. Зато известно, что еще 6000 лет назад люди пользовались изделиями из металла.

Происхождение латинского названия ученые выводят из санскритского sta — прочный.
Русское наименование относят к греческим корням. Alophoys по-гечески белый, что указывает на цвет металла.
Свойства Sn

Stannum (Sn) — латинское наименование этого гибкого, пластичного, легкоплавкого металла. Имеет № 50 в периодической таблице Менделеева.
В реакциях проявляет степени окисления +2, +4.
С водой или воздухом не реагирует. Причина этому — пленка оксида на поверхности металла.
Растворяется в разбавленных кислотах; с неметаллами реагирует при нагреве.
Физические свойства олова:
- плотность β-Sn 7,3 г/см3;
- плотность жидкого олова 6,98 г/см³;
- удельная электропроводность 8,69 МСм/м.
Металл обладает редким свойством: плавится при низкой температуре (232°С), а кипит при высокой (2620°С).
| Свойства атома | |
|---|---|
| Название, символ, номер | О́лово / Stannum (Sn), 50 |
| Атомная масса (молярная масса) | 118,710(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p2 |
| Радиус атома | 162 пм |
| Химические свойства | |
| Ковалентный радиус | 141 пм |
| Радиус иона | (+4e) 71 (+2) 93 пм |
| Электроотрицательность | 1,96 (шкала Полинга) |
| Электродный потенциал | −0,136 |
| Степени окисления | +4, +2 |
| Энергия ионизации (первый электрон) | 708,2 (7,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,31 г/см³ |
| Температура плавления | 231,91 °C[2] |
| Температура кипения | 2893 K, 2620 °C[3] |
| Уд. теплота плавления | 7,19[2]; кДж/моль |
| Уд. теплота испарения | 296[4] кДж/моль |
| Молярная теплоёмкость | 27,11[4] Дж/(K·моль) |
| Молярный объём | 16,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | тетрагональная |
| Параметры решётки | a=5,831; c=3,181 Å |
| Отношение c/a | 0,546 |
| Температура Дебая | 170,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 66,8 Вт/(м·К) |
| Номер CAS | 7440-31-5 |
Аллотропные свойства олова
Аллотропия — свойство элемента менять свою кристаллическую решетку при изменении температуры. Модификация альфа (серое олово) устойчиво при низких температурах (ниже 13 °С). Имеет кубическую решетку, по типу алмаза. Практического применения не имеет.
Бета-модификация (белое, металлическое олово), из которого делают солдатиков, им же покрывают консервные банки. Кристаллическая структура тетрагональная.

В гамма-модификацию металл переходит при температуре 161-232°С.
Печально: в музее А.В. Суворова случилось несчастье. В запаснике, где хранилась ценная коллекция оловянных солдатиков, зимой лопнули трубы отопления, и коллекция просто рассыпалась в пыль.
Маркировка металла
Промышленность выпускает металл в проволоке, чушках, прутках.
Месторождения оловянных руд
Д.И. Менделеев писал:
Олово относится к редким рассеянным металлам. В природе среди элементов занимает 47-е место по распространенности.
Мировые запасы оловянных руд расположены в:
- Китае;
- Малайзии;
- Индонезии;
- Бразилии;
- Перу;
- Австралии.
Значимые месторождения российских оловянных руд сосредоточены на Дальнем Востоке (в Приморском крае, в Якутии, в Хабаровском крае). Добыча металла большей частью происходит в подземных шахтах.
Основные руды:
-
оловянный камень, касситерит — содержит до 78% металла;

Печально: по подсчетам ученых, оловосодержащих минералов на Земле осталось лет на 30. Потом придется добывать его из лома, или искать замену…
Сплавы
По своей классификации оловянные сплавы делятся на припои, подшипниковые и легкоплавкие.
- Баббиты. В них добавляют свинец, медь, сурьма. Баббиты могут иметь легирующие присадки. Маркировки баббитов: Б88, Б83, Б83С.
- Бронза — сплав меди с оловом. Любая бронза содержит небольшие добавки фосфора, цинка, свинца, никеля и других элементов. Марки бронзы: Бр ОФ 6,5-0,15; Бр.ОЦ 4-3; Бр.ОЦ10-2; Бр.ОФ 10-1; Бр.ОНС 11-4-3.
- Пьютер. Сплав с висмутом, сурьмой, медью, изредка со свинцом.
- Припои. Бывают твердые и легкоплавкие. В сплав добавляют свинец и другие элементы. Марки припоев: ПОС-30, ПОС-40, ПОС-90.
Плюсы и минусы олова
К достоинствам относим:
Производство изделий из олова и его сплавов
Продукция из олова была востребована с давних времен. Дети играют в оловянных солдатиков уже 4000 лет.
- Электроника с ее платами сейчас повсюду, и любые контакты соединяются припоем из олова и его сплавов. Оловянное напыление для медных проводов полезно, это защита от воздействия серы (она входит в состав резиновой изоляции).
- Оловянные сплавы баббиты обладают прекрасными антифрикционными свойствами. Ни один из механизмов (от велосипеда до могучего КРАЗа) не обходится без подшипников.
- Используют металл в типографском сплаве гарте. Полиграфическое производство невозможно без оловянных сплавов.

Воздействие на организм оловянных изделий минимально. Поэтому применение металла в пищевой промышленности вполне оправдано.
Простая консервная банка и гибель полярной экспедиции
Французский повар Франсуа Аппер придумал, как долго хранить пищу. Он предложил герметично закрывать продукты в банки из белой жести (это тонкий лист из железа, покрытый оловянным напылением). Теперь мы не можем представить жизни без баночки вкусных консервов.
Стоимость олова
Главная мировая площадка инвесторов в металлы находится в Лондоне. Это LME (Лондонская биржа металлов).
Цена тонны олова на LME составляла 15590,0 US$ за тонну (данные на 28.05.2020).

Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Читайте также:

