Цис транс изомерия доклад
Обновлено: 30.06.2024
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Изомерия — явление, суть которого заключается в существовании химических соединений, которые одинаковы по качественному и количественному составу, но различаются по строению или расположению атомов в пространстве. Вследствие этого они обладают разными физическими и химическими свойствами.
Из данного определения следует определение веществ-изомеров.
Изомеры — это химические соединения с одинаковым составом, но разные по строению или пространственному расположению атомов и свойствам.
Важно не путать изомеры с гомологическими веществами. Гомологи также имеют сходное строение и свойства, но различаются по составу (и, соответственно, формуле) на целое число групп C H 2 .
Как правило, большое количество изомеров характерно для представителей широко известного класса аминокислот. За счет различных заместителей при α-углеродном атоме им также свойственна и оптическая изомерия, которая будет рассмотрена далее.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
Структурная изомерия
Структурные изомеры — вещества, которые одинаковы по качественному и количественному составу, но различающиеся строением, т. е. порядком расположения атомов. Структурные изомеры имеют одинаковые молекулярные, но разные структурные формулы.
Выделяют несколько видов изомерии по структуре молекулы.
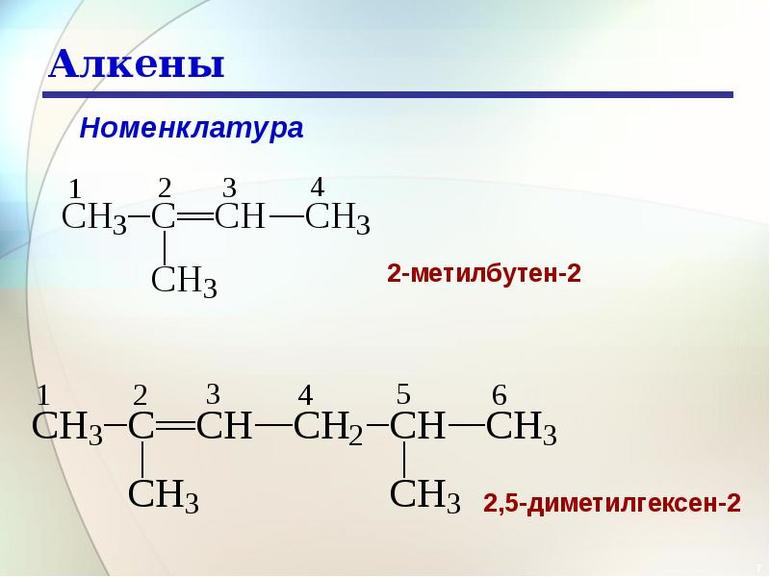
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
Так, пентану C 5 H 12 , относящемуся к ряду алканов, свойственны три структурные формулы изомеров.
C 6 H 6 ), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
У одного и того же вещества могут быть разные типы изомеров. Так, многим представителем класса алкенов свойственны межклассовая, геометрическая и изомерия углеродного скелета. Среди альдегидов встречается структурная изомерия — углеродного скелета и межклассовая. Для циклоалканов характерна межклассовая изомерия, цис-, транс-изомерия и др.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию) .
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы . Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например , в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.

2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.

Геометрическая или цис-транс-изомерия – один из видов пространственной или стереоизомерии. Изомеры отличаются положением радикалов относительно плоскости, условно делящей молекулу пополам. Характерна для веществ, содержащих двойные связи или циклические молекулы.
Изомерия веществ
Изомерия – явление, характеризующее изомеры. Это одинаковые по составу (количеству атомов), но разные по структурному строению или пространственному расположению атомов в молекуле. В связи с этим выделяют структурную и пространственную изомерию.
Также изомеры могут образовываться изменением положения в основной молекуле:
При пространственной изомерии образуются изомеры (стереоизомеры) двух типов:
- энантиомеры – молекулы, имеющие зеркальное строение;
- диастереомеры – молекулы, не имеющие зеркального строения.
Энантиомеры являются результатом оптической или зеркальной изомерии. Диастереомеры возникают при геометрической изомерии и характерны для веществ с двойной связью. При этом важным условием является нахождение одинаковых радикалов у атомов углерода, объединённых двойной связью или сцепленных в кольцо. Другими словами, геометрическая изомерия возможна в соединении типа RCH=CHR, но не возможна в CH2=CHR, CR2=CHR’.
Изомерия – явление, свойственное в первую очередь органическим соединениям, в частности углеводородам. Однако примеры цис-транс-изомерии встречаются и в неорганической химии. Например, цис-[Pt(NH3)2Cl2] (цисплатин) и транс-[Pt(NH3)2]Cl2 (трансплатин), цис-[Co(NH3)4Cl2] + и транс-[Co(NH3)4Cl2] + .
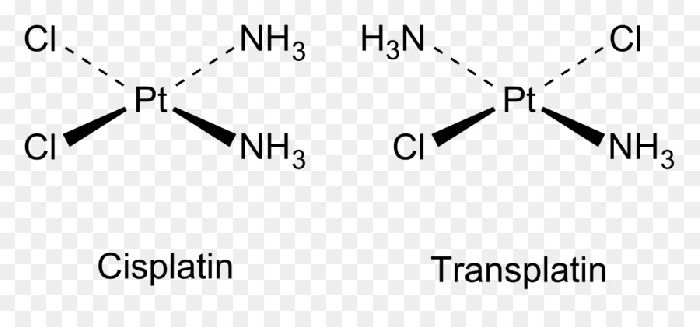
Рис. 2. Цисплатин и трансплатин.
Цис-транс-изомерия
Условная плоскость, разделяющая молекулу пополам, проходит либо в месте двойной связи, либо по кольцу. Атомы углерода, образующие связь С=С или цикл, лежат в одной плоскости. При этом другие атомы могут прикрепляться условно сверху и снизу.
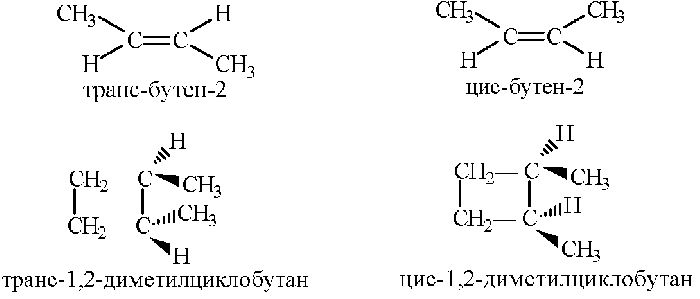
Рис. 3. Цис- и транс-изомерия.
В соответствии с принадлежностью к цис- или транс-изомерии к названиям веществ прибавляют приставки. Например, цис-бутен-2, транс-бутен-2.
Что мы узнали?
Для веществ, содержащих в молекуле двойные связи или циклические молекулы, характерна геометрическая изомерия, которая также называется цис-транс-изомерией. Изомеры отличаются расположением радикалов относительно плоскости молекулы. При цис-изомерии радикалы лежат по одну сторону плоскости. В транс-изомерах радикалы расположены противоположно друг другу по разные стороны плоскости.
Стериоизомеры — соединения, одинаковые по своей химической структуре, но отличные по пространственному расположению молекул. Одним из видов стериоизомерии является геометрическая. Второе ее название цис-транс-изомерия. У изомерных молекул этого типа разное расположение радикалов в пространстве. Цис-транс-изомерия характерна для соединений с ненасыщенной (двойной) связью и для молекул, имеющих циклическую структуру.
Условия для пространственной изомерии
Не все химические соединения обладают способностью образовывать геометрические изомеры. Пространственная цис-транс-изомерия возможна для следующих веществ:
- алкенов;
- циклоалканов;
- алкадиенов;
- ненасыщенных жирных кислот.
Чтобы молекула могла принимать различные формы в пространстве, должно выполняться 2 условия.
Ненасыщенная или циклическая молекула
Важным условием для получения структурной изомерии молекул является наличие двойной связи или неароматического кольца. У гексана, как представителя алканов, не будет существовать пространственных изомеров. Так же они не встречаются у алкинов. Например, у атомов углерода в веществе бутин-2 будет только одна метильная группа радикалов, поэтому пространственная изомерия не наблюдается.
При пространственном изображении молекул такого типа плоскость проводят через 2 атома углерода, соединенных двойной связью, или через ароматическое кольцо. Остальные радикалы располагаются в пространстве относительно этой плоскости. Цис-изомер — молекула, у которой одинаковые радикалы лежат на одной стороне от плоскости симметрии. У трансизомера радикалы расположены крест накрест относительно двойной связи.
Например, вещество бутен-2. Это алкен с длиной цепочки в 4 атома углерода. Формула записывается СН3 — СН = СН — СН3. При условном изображении цис-формы, атомы водорода будут расположены вверху от кратной связи, а метильные группы внизу. У транс-бутена расположение заместителей будет симметричным.
Алкадиены — ненасыщенные углеводороды, имеющие 2 двойные связи и не цикличные по своей структуре. Цис- транс-изомеры имеются у веществ из гомологического ряда бутадиена R-CH=CH-CH=CH2. Плоскость симметрии у алкадиенов проходит через одну двойную связь, а заместителями являются группы R- и -CH=CH2. Для ненасыщенных жирных кислот определение цис-транс-изомеров будет аналогичным.
Для циклических соединений пространственная изомерия зависит от расположения заместителей относительно ароматического кольца. В молекуле диметилциклобутана атомы водорода замещают 2 метильных радикала.
У цис — диметилциклобутана замещающие группы расположены по одну сторону от кольца, а атомы водорода по другую. В транс-изомере расположение радикалов будет перекрестным.
Разные заместители
Второе важное условие для существования геометрических форм — наличие разных заместителей при атоме углерода. Например, для бутадиена пространственные формы невозможны, так как при одном из атомов находятся только 2 водорода. Так же 2 — метилбутен — 2 не образует пространственных изомеров, из-за двух радикалов метила при одном атоме углерода. Чтобы существование их стало возможно, необходимо увеличить длину цепочки. Например, октен — 2 образует структурные изомеры, так как при каждом атоме углерода находится водород и алкильный радикал.
Отличие в свойствах
Разная пространственная форма молекул влияет на физические свойства веществ. У различных геометрических форм будут отличаться:
- точка кипения;
- точка плавления;
- растворимость .
Влияние на различие свойств пространственных изомеров оказывает природа функциональных групп и то, какое расстояние между ними. Если заместители представлены слабыми донорами, их влияние на свойства вещества будет несильным. Например, цис — и транс пентен — 2 почти не отличаются по физическим свойствам, потому что водород замещают метильная и этильная группы.
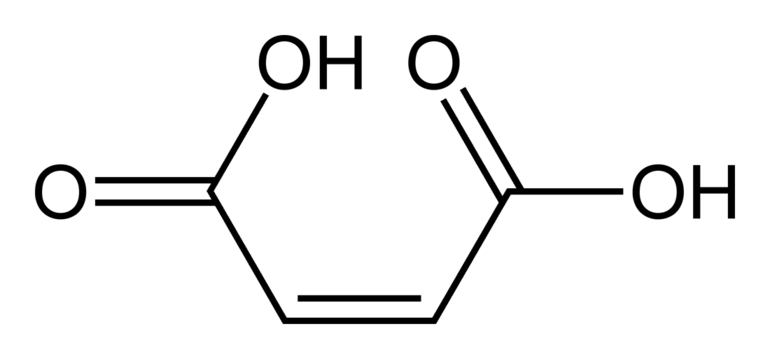
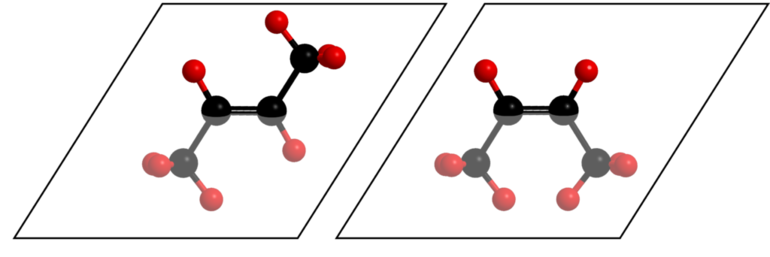
Но если есть полярная группа, влияющая на двойную связь, свойства пространственных форм существенно отличаются. Например, малеиновая кислота по физическим свойствам и химической активности сильно отличается от фумаровой. Но обе они являются изомерными формами бутендиовой кислоты. Это связано с тем, что у цис — изомера расстояние между функциональной группой и радикалом меньше, чем у транс — изомера.
На свойства молекул влияние так же оказывает симметричность. Трансизомеры симметричны, поэтому молекулы расположены очень плотно. Температура плавления из-за этого существенно выше, чем у не симметричных цис — изомеров.
Соотношение изомеров
У молекул простых алкенов высокая энергия вращения относительно кратной связи. Это позволяет отдельно существовать цис— транс— изомерам. Примером алкена служит гексен — 3 СН3 — СН2 — СН= СН — СН2 — СН3.
Однако энергию вращения можно понизить. Для этого в молекулу нужно внести сильный донор по одну сторону от кратной связи, и сильный акцептор — по другую. К таким соединениям относятся амидные производные эфиров и кетонов. Соотношение пространственных изомеров для таких веществ зависит от природы растворителя.

Разница между цис и транс изомерами - Разница Между
Содержание:
Главное отличие - цис против транс изомеров
Стереоизомерия - это различие в пространственном расположении молекул, имеющих одинаковую связность атомов. Эти молекулы имеют одинаковую химическую формулу и молекулярную формулу, но разные геометрии. Эти стереоизомеры можно разделить на несколько категорий с учетом сходства между этими молекулами. Цис-транс-изомеры являются одним из таких типов изомеров, которые можно найти в алканах и, более конкретно, в алкенах. Цис-транс-изомерия может быть обнаружена, когда положение боковой группы изменяется, в то время как остальные молекулы идентичны друг другу. Основное различие между цис- и транс-изомерами заключается в том, что цис-изомеры являются по существу полярными, тогда как транс-изомеры сравнительно неполярны.
Ключевые области покрыты
1. Что такое цис-изомеры
- Определение, свойства по отношению к структуре
2. Что такое транс-изомеры
- Определение, свойства по отношению к структуре
3. В чем разница между цис и транс изомерами
- Сравнение основных различий
Ключевые слова: алканы, алкены, цис-транс-изомеры, геометрия, изомеры, неполярные, полярные, стереоизомерия.

Что такое цис-изомеры
Цис-изомеры представляют собой молекулы, имеющие одинаковую связность атомов и состоят из идентичных боковых групп, которые можно найти на одной стороне. Например, в алкенах присутствует, по меньшей мере, одна углерод-углеродная двойная связь. Если существуют идентичные группы, которые присоединены к двум атомам углерода, но расположены на одной стороне молекулы, то они называются цис-изомерами. Чтобы иметь цис-изомерию, молекула должна иметь две идентичные боковые группы и две разные боковые группы. Две идентичные боковые группы должны быть присоединены к двум винильным атомам углерода (атомам углерода, которые находятся в двойной связи).

Рисунок 1: цис-изомер молекулы 2-бутена
Как показано на изображении выше, 2-бутен обладает цис-транс-изомерией. Здесь цис-изомер состоит из двух метильных групп, связанных с каждым винильным атомом углерода. Эти две метильные группы находятся на одной стороне молекулы.
Находящиеся на одной стороне одинаковые группы влияют на полярность этой молекулы. Если на одной стороне было больше электроотрицательных боковых групп, в этой молекуле наблюдается очень высокая полярность. Следовательно, эта молекула становится высокополярной молекулой. Из-за этой повышенной полярности между этими молекулами возникают сильные силы притяжения. Это приводит к более высокой точке кипения, поскольку сильные силы притяжения уменьшают способность молекул покидать друг друга. Но температура плавления сравнительно ниже, поскольку цис-изомер не плотно упакован из-за сил отталкивания между молекулами.
Что такое транс изомеры
Транс-изомеры представляют собой молекулы, имеющие одинаковую связность атомов и состоят из идентичных боковых групп, которые можно найти на противоположных сторонах. Здесь идентичные боковые группы расположены в перекрестном порядке. Молекула должна иметь две идентичные боковые группы и две разные боковые группы, чтобы иметь транс-изомерию. Две идентичные боковые группы присоединены к двум винильным атомам углерода, но эти группы расположены в противоположных направлениях.

Рисунок 2: Транс-изомер 2-бутена
Как показано на изображении выше, транс-изомер имеет две метильные группы на противоположных сторонах. Две метильные группы не связаны с одним и тем же атомом углерода. Таким образом, это хороший пример транс-изомерии.
Транс-изомеры часто являются неполярными молекулами. Но может быть некоторая степень полярности в зависимости от типа присутствующих боковых групп. Однако нет сильных сил притяжения между транс-молекулами из-за меньшей / нулевой полярности. Следовательно, температура кипения транс-изомера является сравнительно низкой.
Разница между цис и транс изомерами
Определение
Цис изомеры: Цис-изомеры представляют собой молекулы, имеющие одинаковую связность атомов и состоят из идентичных боковых групп, которые можно найти на одной стороне.
Транс Изомеры: Транс-изомеры представляют собой молекулы, имеющие одинаковую связность атомов и состоят из идентичных боковых групп, которые можно найти на противоположных сторонах.
полярность
Цис изомеры: Цис-изомер всегда является полярной молекулой.
Транс Изомеры: Транс-изомер является менее полярным или неполярным.
Температура плавления
Цис изомеры: Температура плавления цис-изомера сравнительно низкая из-за неплотной упаковки молекул.
Транс Изомеры: Температура плавления транс-изомера сравнительно высока из-за плотной упаковки молекул.
Точка кипения
Цис изомеры: Температура кипения цис-изомера является сравнительно высокой из-за наличия сильных сил притяжения.
Транс Изомеры: Температура кипения транс-изомера сравнительно низкая из-за отсутствия сильных сил притяжения.
Заключение
Цис-транс изомерия описывает разницу между молекулами, имеющими одинаковую связность атомов, но разные свойства. Эти различные свойства обусловлены различием в пространственном расположении двух молекул. Основное различие между цис- и транс-изомерами заключается в том, что цис-изомеры являются по существу полярными, тогда как транс-изомеры сравнительно неполярны.
Читайте также:

