Амины доклад по химии
Обновлено: 01.06.2024
Окружающая нас природа удивительно многоцветна. Никто никогда не сосчитает точное число всех оттенков, передающих многообразие природной гаммы цвета.
Окраска природных объектов обусловлена присутствием веществ, способных выборочно поглощать или отражать электромагнитные волны определённой длины.
Природа научилась синтезировать окрашенные вещества гораздо успешнее, чем это делает человек. С незапамятных времён люди применяли природные красители. Например, синий краситель индиго извлекали из сока индигоносных растений. Этот краситель, только получаемый промышленным способом, до сих пор используют для окраски джинсовой ткани.
Красящие вещества содержатся и в организмах насекомых. В Мексике за 1000 лет до нашей эры открыли красный краситель кармин. Его извлекали из насекомых кошенили, обитавших на кактусах. Краситель содержится только в особях женского пола, их собирали вручную, и для приготовления 1 г красителя требовалось собрать 150 000 тлей!
Вплоть до середины XIX в. краски для тканей стоили невероятно дорого и были доступны лишь обеспеченным людям. Вполне понятно желание химиков разгадать тайну цвета и научиться синтезировать качественные и доступные красители.
Совместно с братом и отцом Перкин построил фабрику по производству мовеина. Успех был ошеломительным! Королевские особы носили одежду, окрашенную новым красителем. В течение последующих нескольких лет на основе анилина химики синтезировали десятки красителей красного, розового, зелёного и синего цветов.
Какое отношение рассказ о синтетических красителях имеет к материалу конспекта? Самое непосредственное — поскольку анилин относят к классу органических соединений, называемых аминами.
Классификация аминов
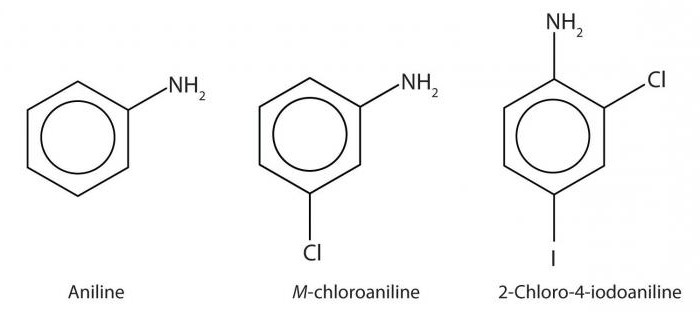
Общая формула аминов R—NH2, где R — углеводородный радикал. В зависимости от природы радикала различают предельные амины (R — остаток предельного углеводорода, т. е. алкил) и ароматические амины (R — остаток ароматического углеводорода).

Гомологический ряд предельных аминов начинает простейший представитель класса — метиламин. Структурные формулы метиламина и его ближайших гомологов приведены ниже:
Общая формула членов данного гомологического ряда CnH2n+1NH2, или CnH2n+3N.


Представителем ароматических аминов является уже упомянутый нами анилин. В молекуле этого вещества аминогруппа —NH2 связана с остатком ароматического углеводорода бензола — фенильным радикалом С6Н5—. Следовательно, химическая формула анилина С6Н5—NH2:
Физические свойства и получение важнейших аминов
Метиламин — бесцветное газообразное вещество с резким аммиачным запахом, хорошо растворимое в воде. Анилин представляет собой бесцветную жидкость, которая на воздухе приобретает красно-бурую окраску вследствие окисления; он также обладает резким запахом и плохо растворим в воде.
Химические свойства аминов
Химические свойства аминов определяются в первую очередь наличием в их молекулах аминогруппы.
Амины рассматривают как продукты замещения в молекуле аммиака атомов водорода аминогруппами. Логично предположить, что химические свойства, характерные для аммиака, будут характерны и для его органических производных. Так оно и есть.
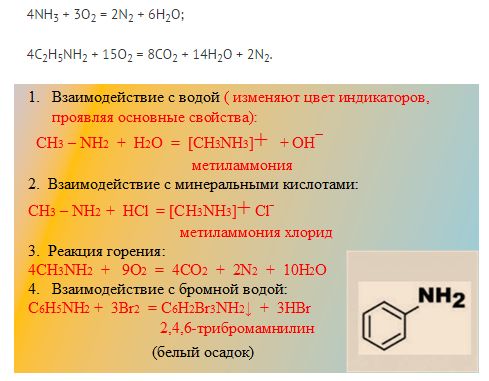
Аммиак характеризуется основными свойствами за счёт неподелённой электронной пары атома азота. Его водный раствор имеет щелочную реакцию, аммиак легко реагирует с кислотами с образованием солей аммония:

Как и аммиак, амины легко образуют соли с сильными неорганическими кислотами:
Третье положение теории строения органических соединений о взаимном влиянии атомов в молекулах подтверждается сравнением свойств рассматриваемых аминов и аммиака.

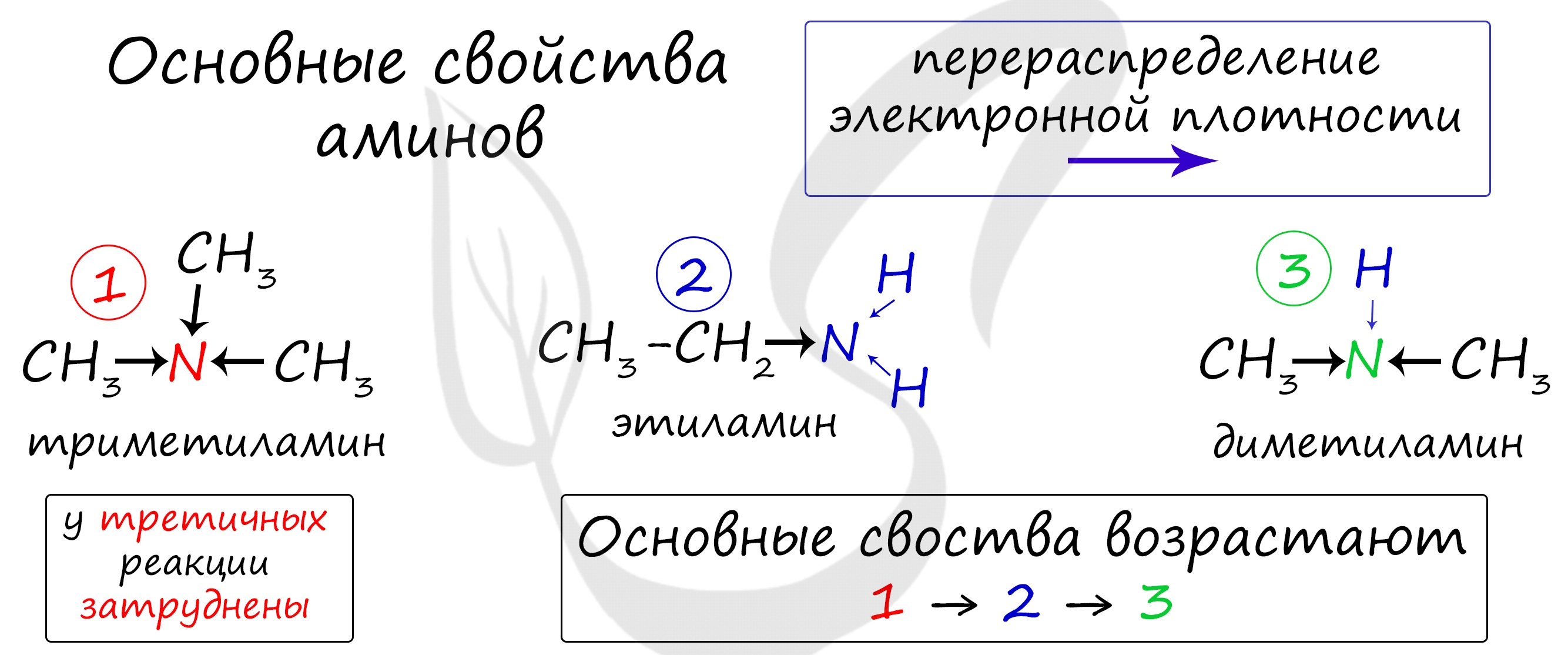
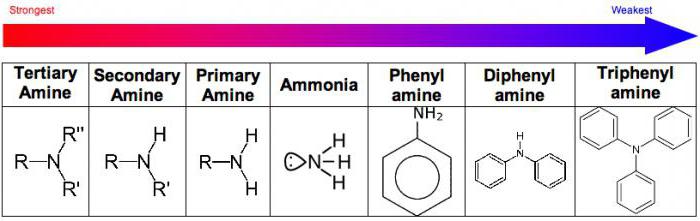
Основные свойства аминов, по сравнению с аммиаком, отражают влияние углеводородного радикала на поведение аминогруппы. Усиление основных свойств наблюдается в ряду

Аминогруппа оказывает ответное влияние на свойства углеводородного радикала. Действительно, анилин, в отличие от бензола, легко вступает в реакцию бромирования при добавлении бромной воды, при этом никакого катализатора не требуется, а бромирование протекает не по одному, а по трём атомам углерода цикла:
Продукт реакции — 2,4,6-триброманилин — это нерастворимое в воде вещество белого цвета, поэтому реакцию с бромной водой можно использовать для обнаружения анилина, т. е. как качественную реакцию на анилин.
Области применения аминов
Предельные амины широко используют в органическом синтезе для производства лекарственных веществ, синтетических волокон, пластмасс, стимуляторов роста растений. Встречаются предельные амины и в природе. Они являются результатом разложения природных азотсодержащих органических веществ и часто имеют неприятный запах, напоминающий запах протухшей рыбы.
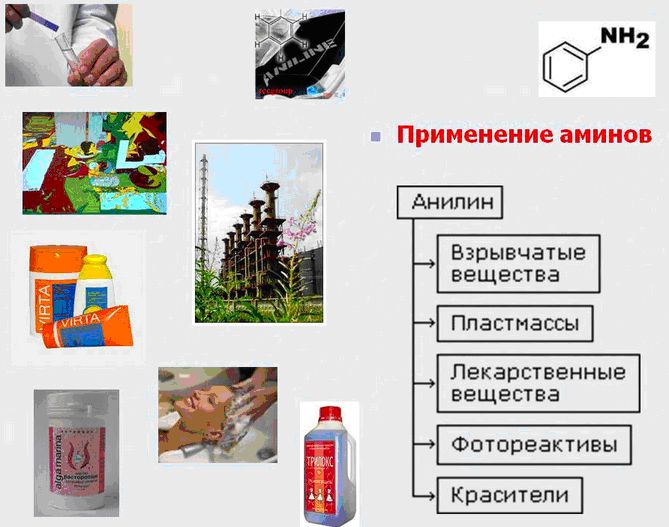
Основное количество получаемого в промышленности анилина используют для производства полимерных материалов (полиуретана), лекарств, взрывчатых веществ, гербицидов, красителей.
Аминогруппа входит в состав не только аминов, но и более сложных органических соединений. О них пойдёт речь в следующем конспекте.

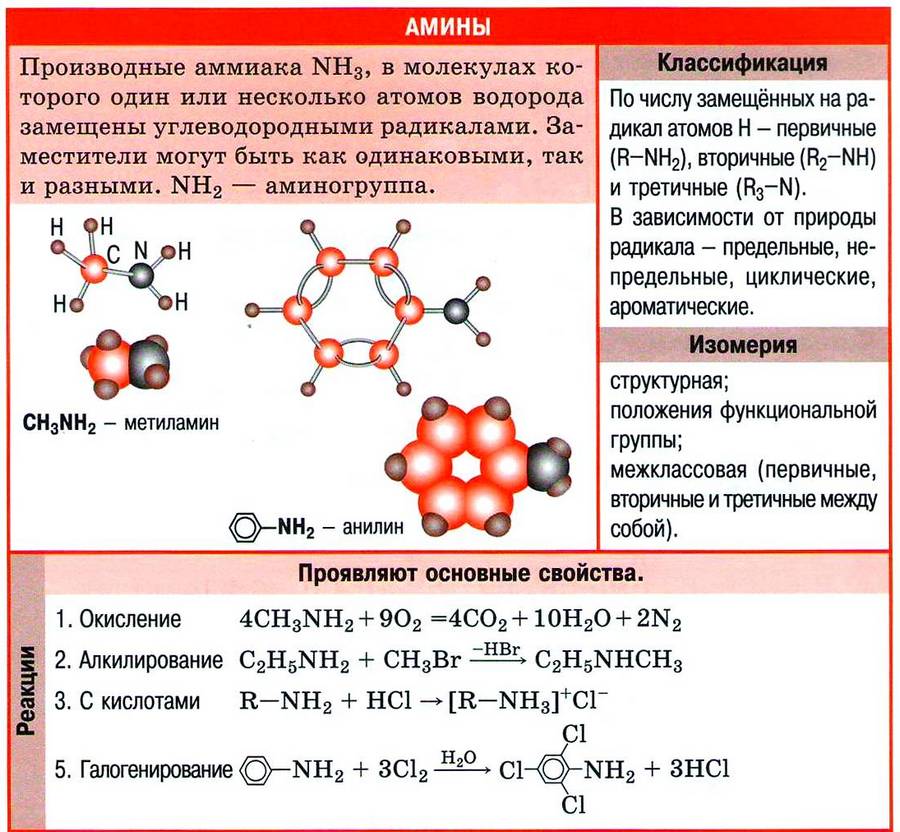
Амины - органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа - NH2.

Классификация аминов
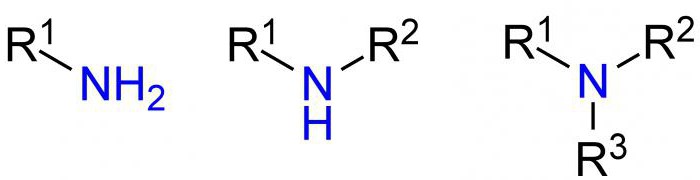
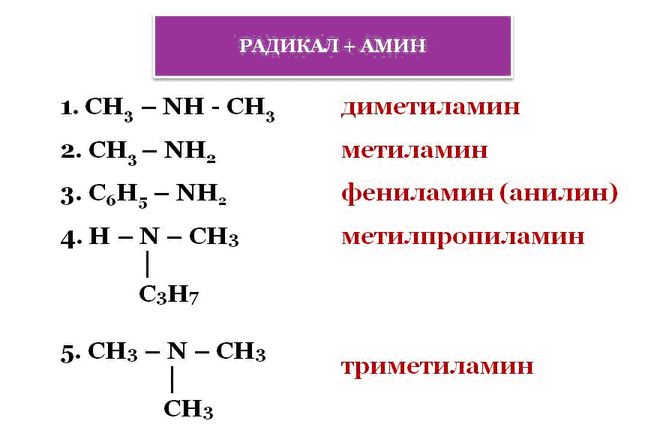
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
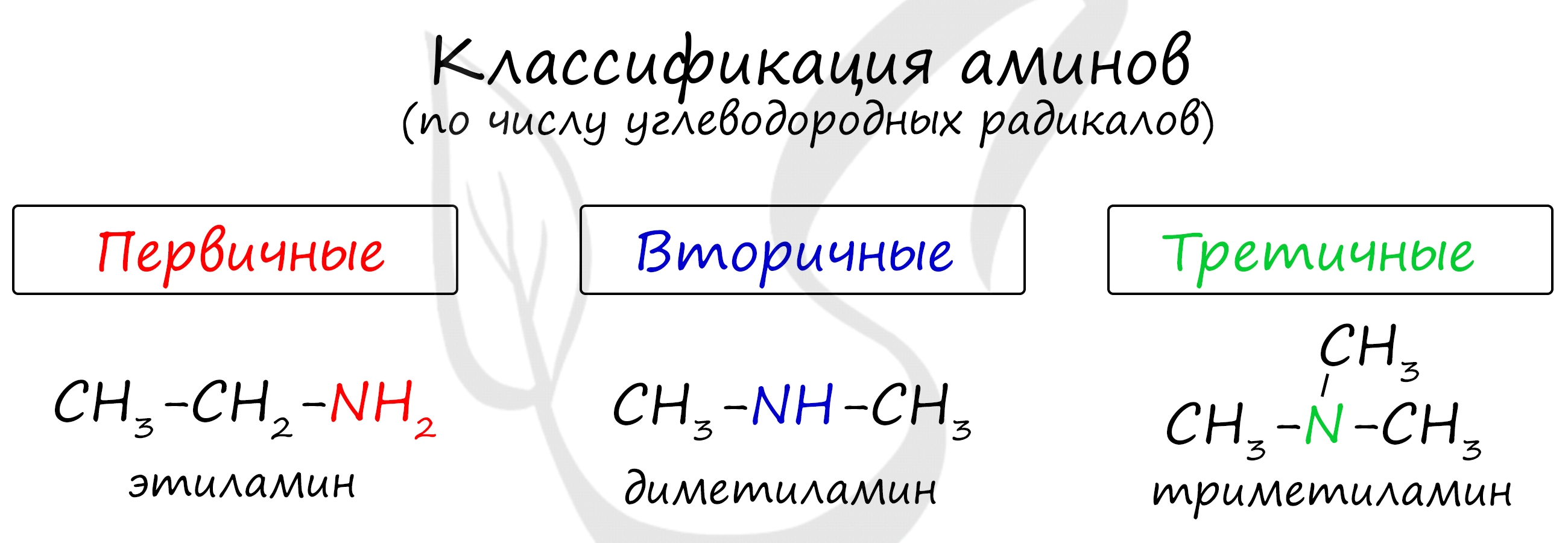
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
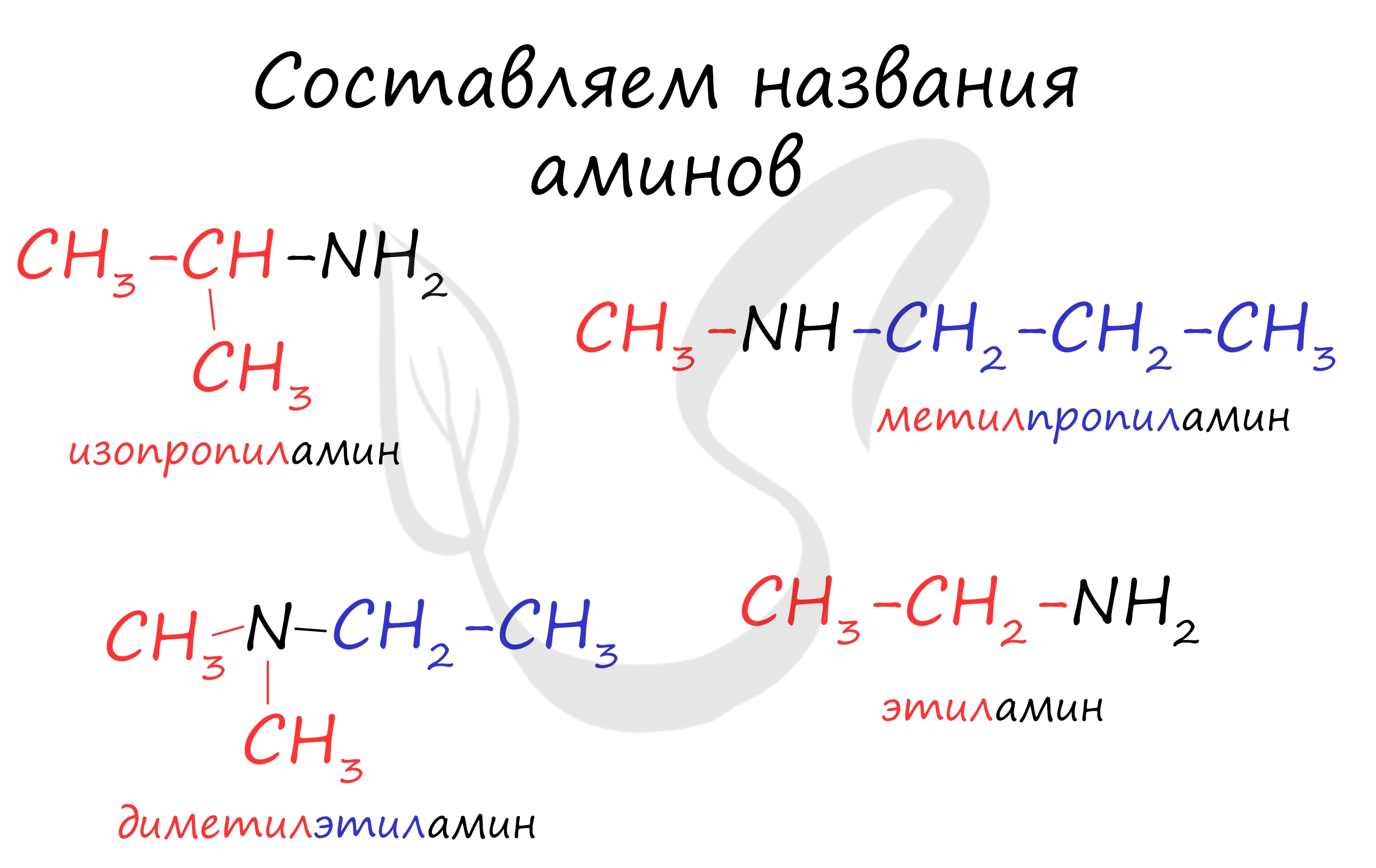
Названия аминов формируются путем добавления суффикса "амин" к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
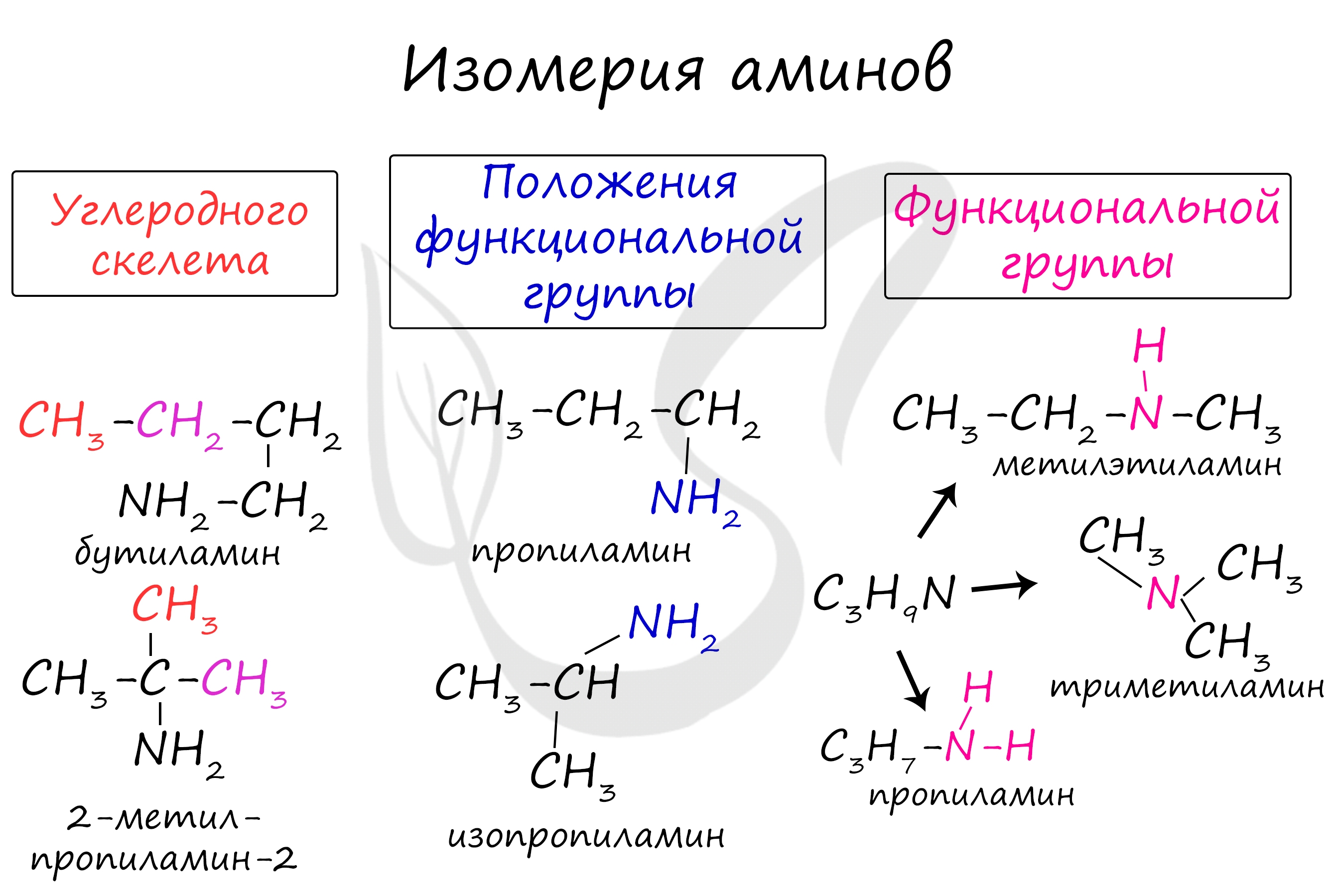
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
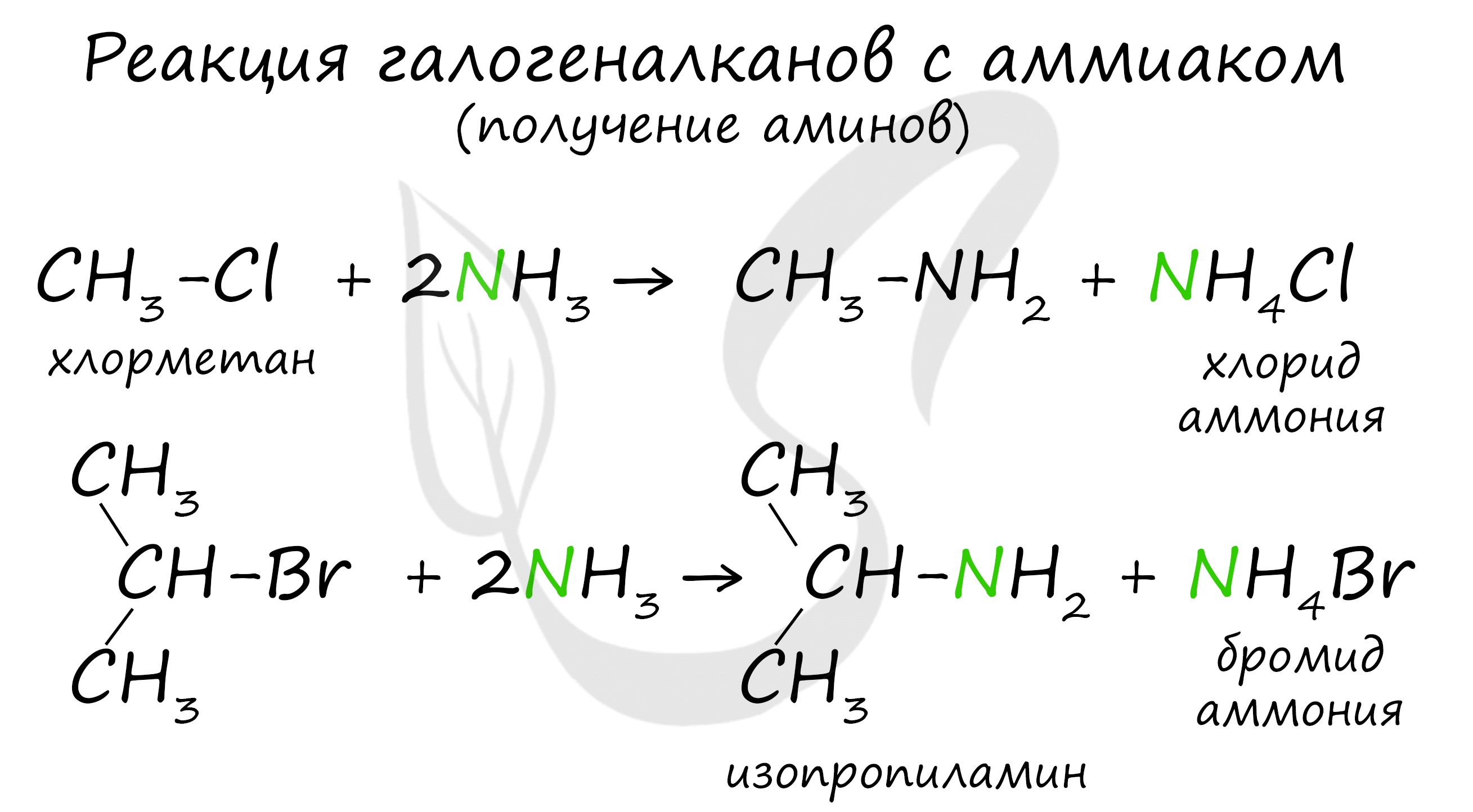
Получение
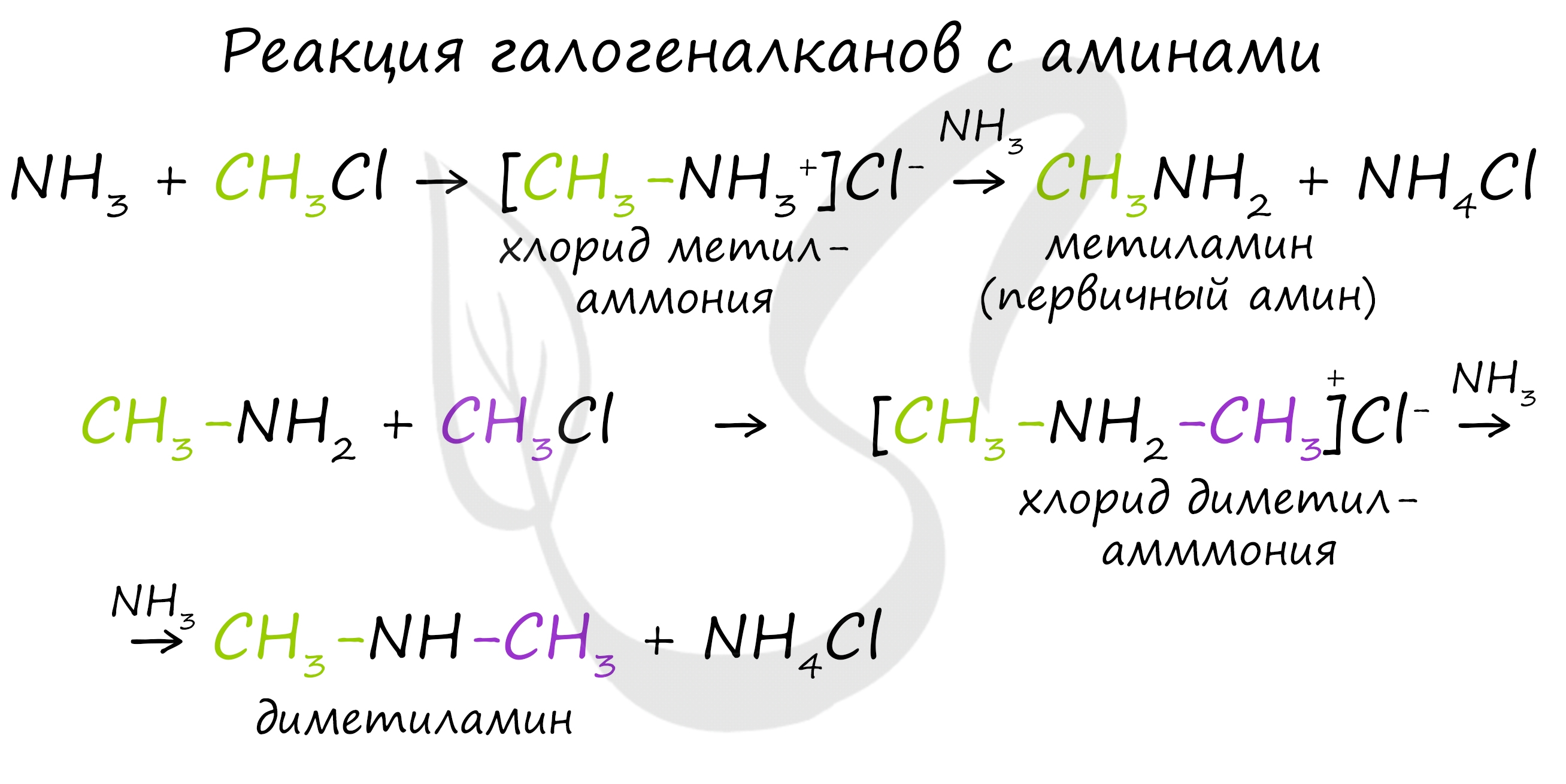
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
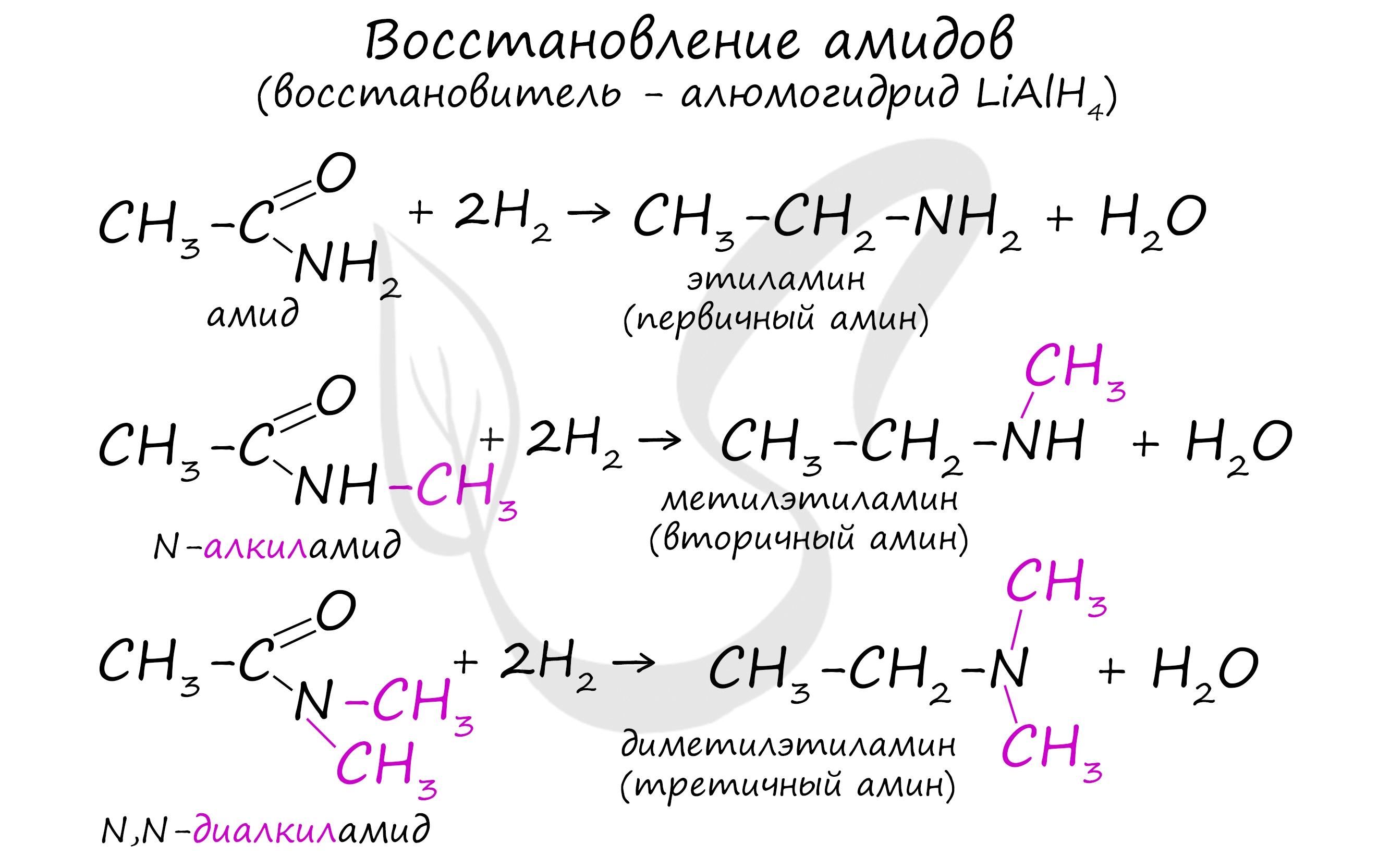
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна - нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
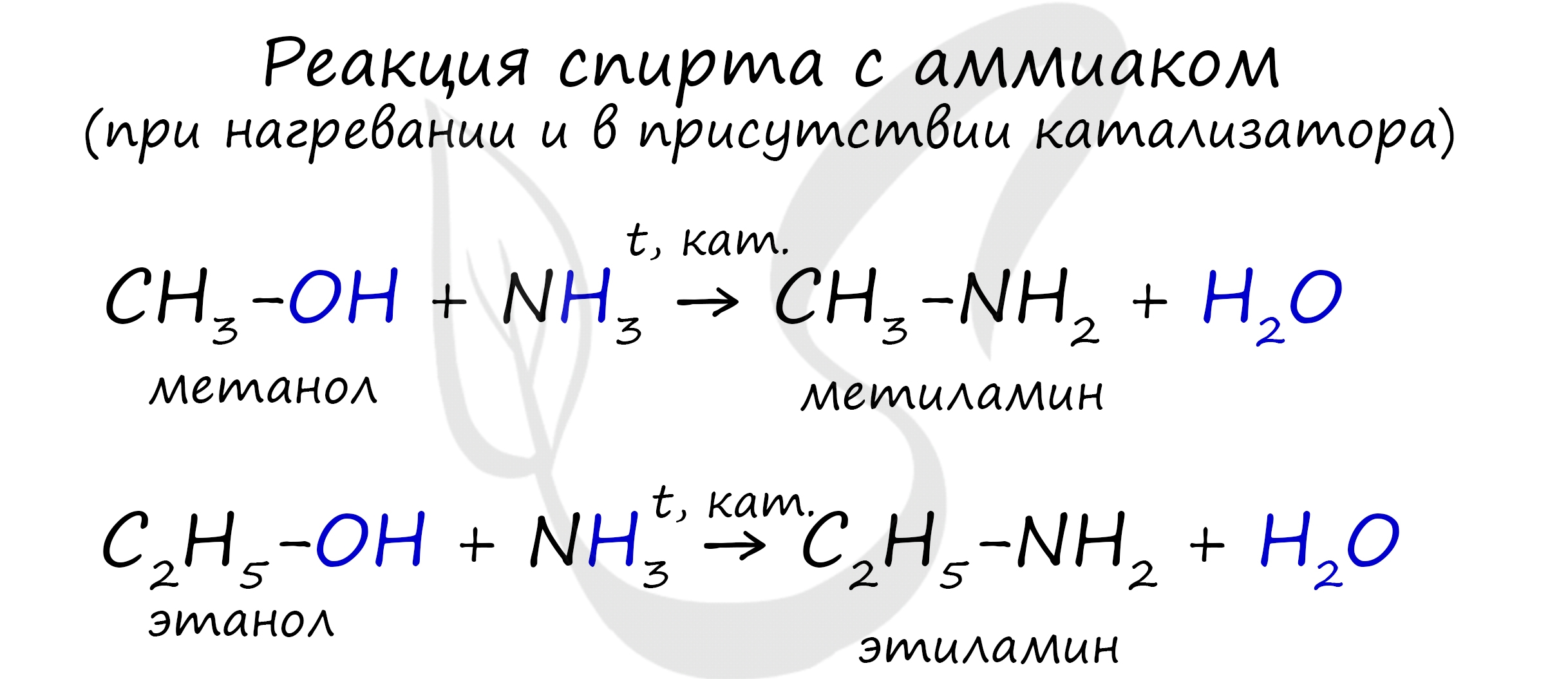
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
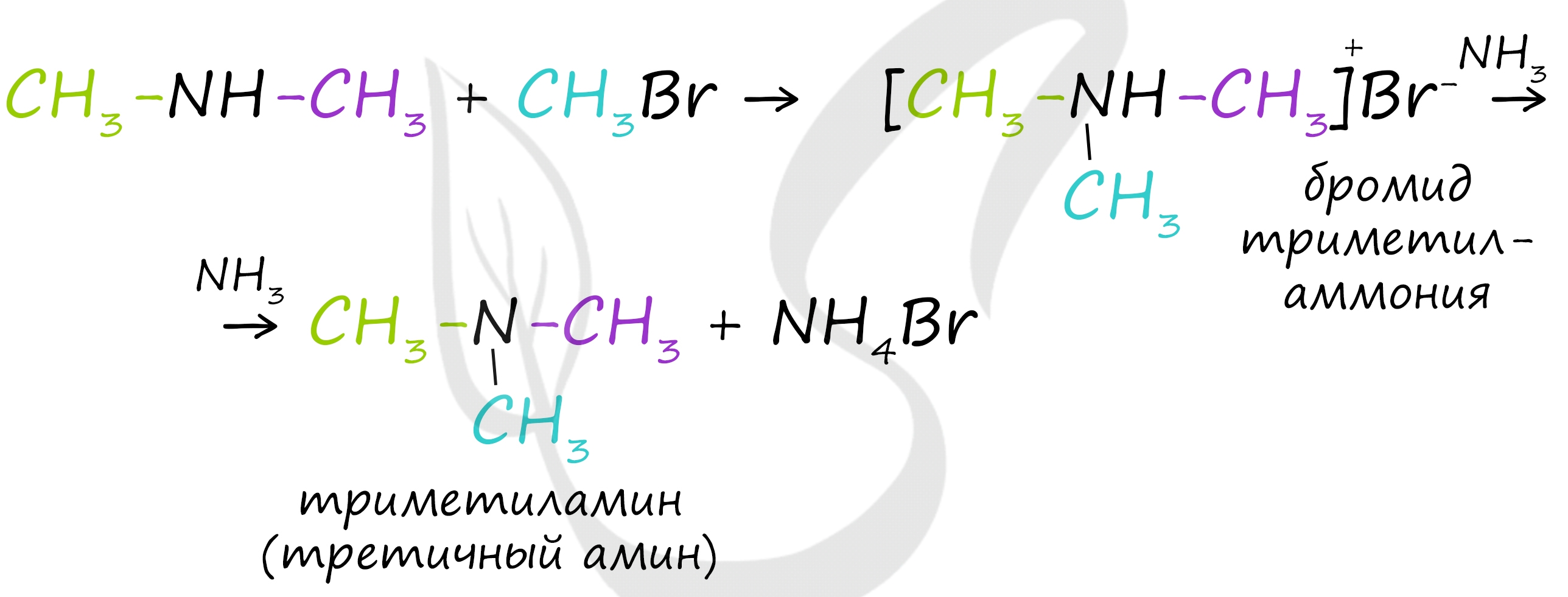
Химические свойства аминов
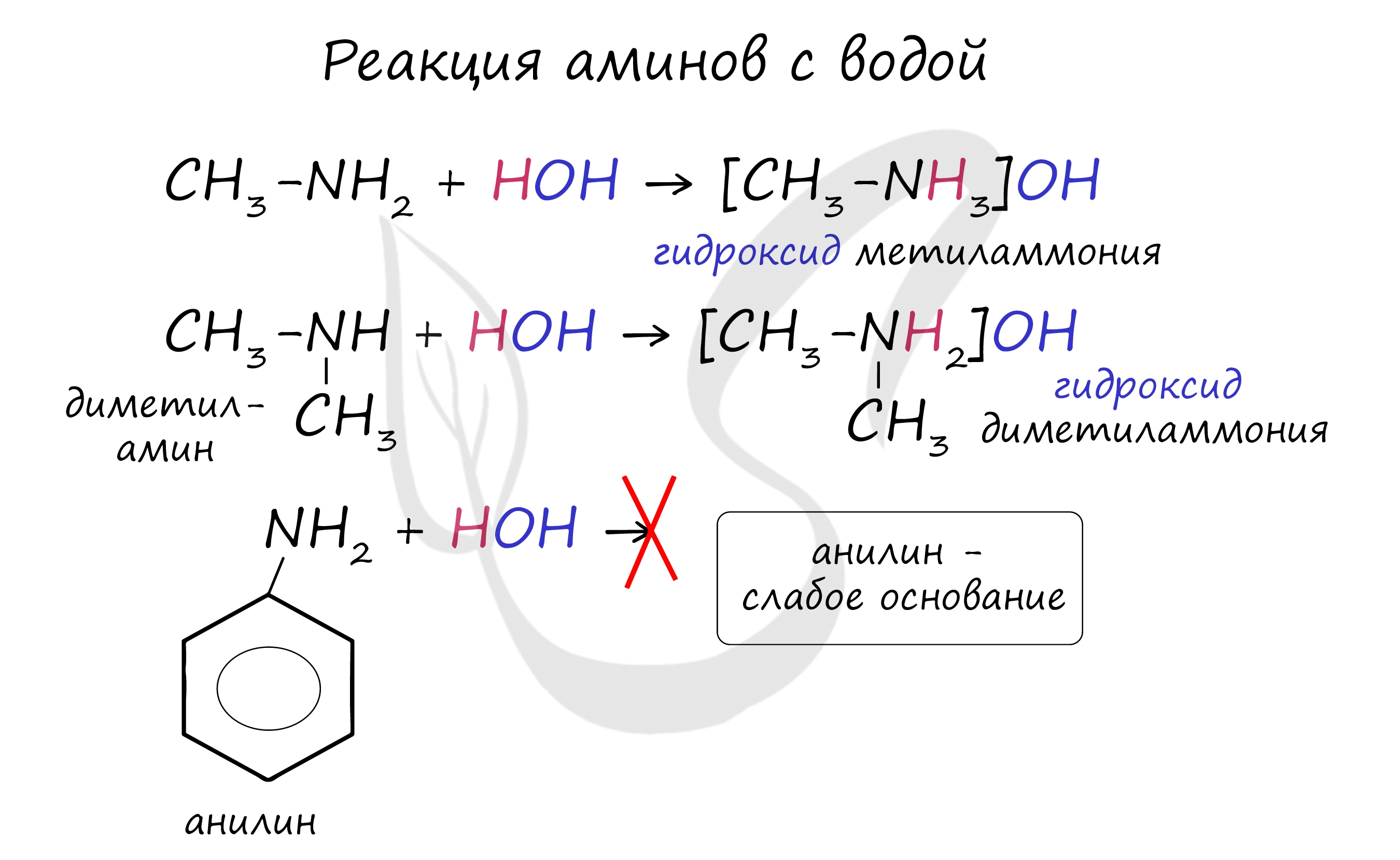
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент "N=C".

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
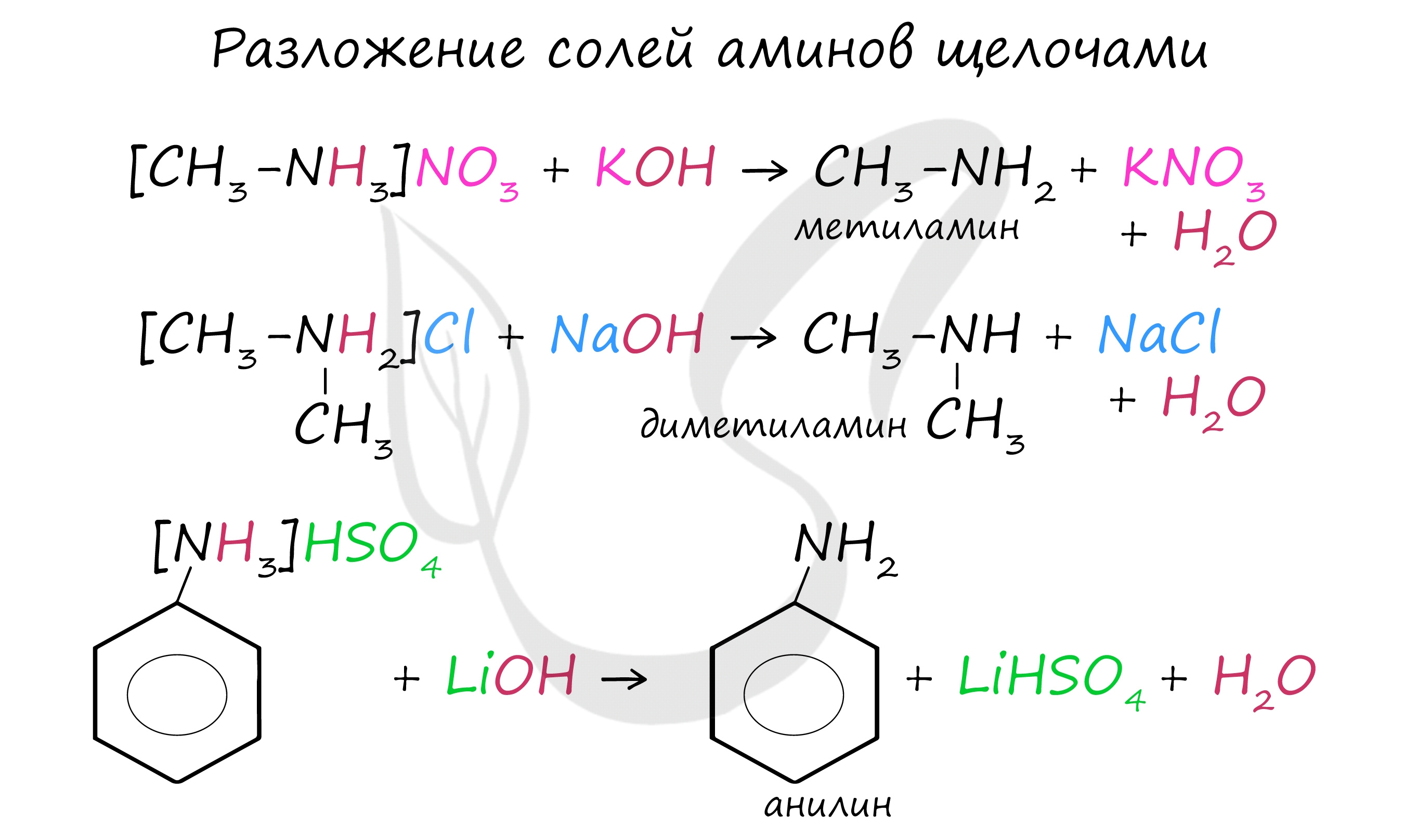
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:

Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Ф ормуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
 |  |
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например. Ф ормуле С4Н11N соответствуют амины положения аминогруппы. |
Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Аммиак :NH3
| Поэтому амины и аммиак обладают свойствами оснований. |
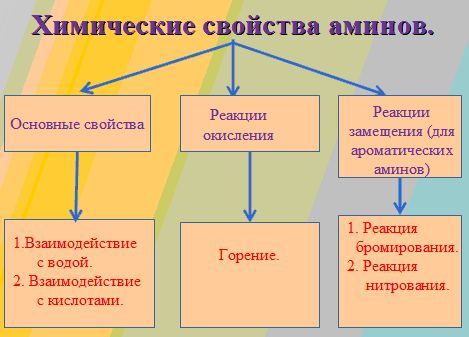
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |

1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:

1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):

При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:

1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |

2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:

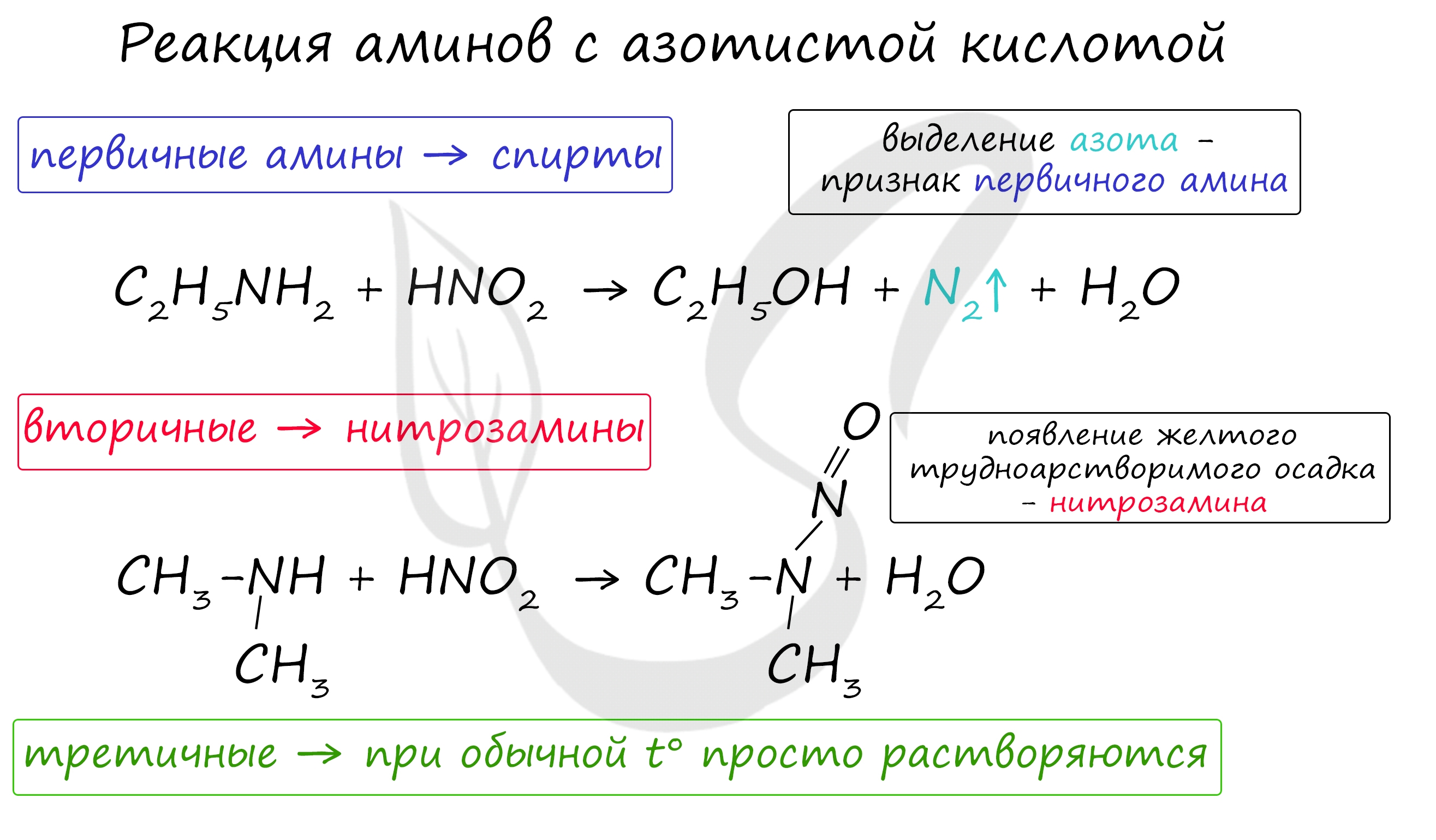
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:

| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:

Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.

| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:

- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |

Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.


Алюминий реагирует с щелочами с образованием гидроксокомплексов.

В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:

Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.


Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:

Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:

.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:

- Соли аминов вступают в обменные реакции в растворе:

Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
15 комментариев
Добавить ваш
Где получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом?
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
R3N + RCl = R4N(+)Cl(-)
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Амины вошли в нашу жизнь совершенно неожиданно. Еще недавно это были ядовитые вещества, столкновение с которыми могло привести к смерти. И вот, спустя полтора столетия, мы активно пользуемся синтетическими волокнами, тканями, строительными материалами, красителями, в основе которых лежат амины. Нет, они не стали безопаснее, просто люди смогли их "приручить" и подчинить, извлекая для себя определенную пользу. О том, какую именно, и поговорим далее.
Определение
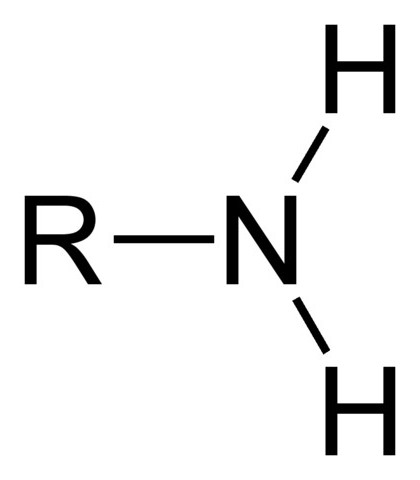
Амины – это органические соединения, являющиеся производными аммиака, в молекулах которого водород замещен углеводородными радикалами. Их может быть до четырех одновременно. Конфигурация молекул и количество радикалов определяют физические и химические свойства аминов. Кроме углеводородов, такие соединения могут содержать ароматические или алифатические радикалы, либо их комбинацию. Отличительным признаком данного класса является наличие R-N-фрагмента, в котором R – это органическая группа.
Классификация

Все амины можно разделить на три большие группы:
- По природе углеводородного радикала.
- По числу радикалов, связанных с атомом азота.
- По количеству аминогрупп (моно-, ди-, три - и т. д.).
В первую группу входят алифатические, или предельные амины, представителями которых являются метиламин и метилэтиламин. А также ароматические - например, анилин или фениламин. Названия представителей второй группы напрямую связаны с количеством углеводородных радикалов. Так, выделяют первичные амины (содержащие одну группу азота), вторичные (имеющие две группы азота в комбинации с различными органическими группами) и третичные (соответственно, имеющие три группы азота). Названия третичной группы говорят сами за себя.
Номенклатура (образование названия)
Некоторые соединения до сих пор сохраняют тривиальные, общеизвестные упрощенные названия, такие как анилин, например. Кроме того, среди них могут встречаться такие, что имеют неправильно составленные названия, использующиеся наравне с систематическими, потому что ученым и людям, далеким от науки, так проще и удобнее общаться и понимать друг друга
Физические свойства
Вторичный амин, как и первичный, способен образовывать водородные связи между молекулами, хоть и чуть более слабые, чем обычно. Этот факт объясняет более высокую температуру кипения (выше ста градусов), присущую аминам, по сравнению с другими соединениями, имеющими аналогичную молекулярную массу. Третичный амин, из-за отсутствия N-H-группы, не способен образовывать водородные связи, поэтому начинает закипать уже при восьмидесяти девяти градусах по Цельсию.
При комнатной температуре (восемнадцать – двадцать градусов Цельсия) только низшие алифатические амины находятся в виде пара. Средние же пребывают в жидком состоянии, а высшие – в твердом. Все классы аминов имеют специфический запах. Чем меньше в молекуле органических радикалов, тем он отчетливей: от практически лишенных запаха высших соединений к пахнущим рыбой средним и воняющим аммиаком нижним.
Амины могут образовывать прочные водородные связи с водой, то есть являются хорошо растворимыми в ней. Чем больше в молекуле присутствует углеводородных радикалов, тем менее она растворима.
Химические свойства
Как логично предположить, амины – это производные аммиака, а значит, и свойства у них сходные. Условно можно выделить три вида химического взаимодействия, которые возможны у данных соединений.
- Сначала рассмотрим свойства аминов как оснований. Низшие (алифатические), соединяясь с молекулами воды, дают щелочную реакцию. Связь образуется по донорно-акцепторному механизму, за счет того, то атом азота имеет непарный электрон. При взаимодействии с кислотами все амины образуют соли. Это твердые, хорошо растворимые в воде вещества. Ароматические амины проявляют более слабые свойства оснований, так как их неподеленная электронная пара смещается к бензольному кольцу и взаимодействует с его электронами.
- Окисление. Третичный амин легко окисляется, соединяясь с кислородом в атмосферном воздухе. Кроме того, все амины способны воспламеняться от открытого пламени (в отличие от аммиака).
- Взаимодействие с азотистой кислотой используется в химии для того, чтобы различать амины между собой, так как продукты данной реакции зависят от количества органических групп, присутствующих в молекуле:
- низшие первичные амины образуют в результате реакции спирты;
- ароматические первичные в аналогичных условиях дают фенолы;
- вторичные превращаются в нитрозосоединения (о чем свидетельствует характерный запах);
- третичные образуют соли, которые быстро разрушаются, поэтому ценности такая реакция не представляет.
Особые свойства анилина
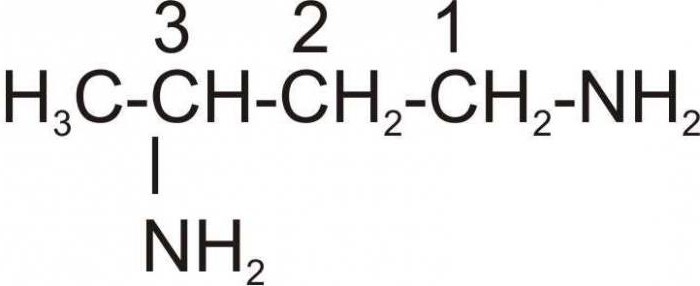
Анилин представляет собой соединение, имеющее свойства, присущие как аминогруппе, так и группе бензолов. Объясняется это взаимным влиянием атомов внутри молекулы. С одной стороны, бензольное кольцо ослабляет основные (т. е. щелочные) проявления в молекуле анилина. Они ниже, чем у алифатических аминов и аммиака. Но с другой, когда аминогруппа оказывает влияние на бензольное кольцо, оно становится, наоборот, более активным и вступает в реакции замещения.
Для качественного и количественного определение анилина в растворах или соединениях используется реакция с бромной водой, в конце которой на дно пробирки выпадает белый осадок в виде 2,4,6-триброманилина.
Амины в природе
Длительное время рассматриваемые нами вещества путали с аммиаком из-за похожего запаха. Но в середине девятнадцатого века французский химик Вюрц смог синтезировать метиламин и этиламин и доказать, что при сгорании они выделяют углеводород. Это было принципиальным отличием упомянутых соединений от аммиака.
Получение аминов в промышленных условиях
Так как атом азота в аминах находится в низшей степени окисления, то восстановление азотосодержащих соединений является наиболее простым и доступным способом их получения. Именно он широко распространен в промышленной практике из-за своей дешевизны.
Первый метод представляет собой восстановление нитросоединений. Реакция, во время которой образуется анилин, носит название ученого Зинина и была проведена в первый раз в середине девятнадцатого века. Второй способ заключается в восстановлении амидов при помощи алюмогидрида лития. Из нитрилов тоже можно восстановить первичные амины. Третий вариант – реакции алкилирования, то есть введение алкильных групп в молекулы аммиака.
Применение аминов

Сами по себе, в виде чистых веществ, амины используются мало. Один из редких примеров – полиэтиленполиамин (ПЭПА), который в бытовых условиях облегчает затвердение эпоксидной смолы. В основном первичный, третичный или вторичный амин – это промежуточный продукт в производстве различных органических веществ. Самым востребованным является анилин. Он – основа большой палитры анилиновых красителей. Цвет, который получится в конце, зависит непосредственно от выбранного сырья. Чистый анилин дает синий цвет, а смесь анилина, орто- и пара-толуидина будет красной.
Алифатические амины нужны для получения полиамидов, таких как нейлон и другие синтетические волокна. Они применяются в машиностроении, а также в производстве канатов, тканей и пленок. Кроме того, алифатические диизоцинаты используются в изготовлении полиуретанов. Из-за своих исключительных свойств (легкость, прочность, эластичность и способность прикрепляться к любым поверхностям) они востребованы в строительстве (монтажная пена, клей) и в обувной промышленности (противоскользящая подошва).
Медицина - еще одна сфера, где применяются амины. Химия помогает синтезировать из них антибиотики группы сульфаниламидов, которые успешно применяют в качестве препаратов второй линии, то есть резервной. На случай, если у бактерий разовьется устойчивость к основным лекарствам.
Вредное воздействие на организм человека
Известно, что амины – это весьма токсичные вещества. Вред здоровью может нанести любое взаимодействие с ними: вдыхание паров, контакт с открытой кожей или попадание соединений внутрь организма. Смерть наступает от нехватки кислорода, так как амины (в частности, анилин) связываются с гемоглобином крови и не дают ему захватывать молекулы кислорода. Тревожными симптомами являются одышка, посинение носогубного треугольника и кончиков пальцев, тахипноэ (учащенное дыхание), тахикардия, потеря сознания.
В случае попадания этих веществ на оголенные участки тела необходимо быстро убрать их ватой, предварительно смоченной в спирте. Делать это надо максимально аккуратно, чтобы не увеличить площадь загрязнения. Если появятся симптомы отравления – обязательно нужно обратиться к врачу.
Алифатические амины – это яд для нервной и сердечно-сосудистой систем. Они могут вызвать угнетение функций печени, ее дистрофию и даже онкологические заболевания мочевого пузыря.
На сегодняшнем уроке мы с вами будем знакомиться с такими соединениями, как амины. Давайте рассмотрим, какие это соединения и что они собой представляют.
Аминами называют такой класс соединений, который представляет собой органические производные аммиака, где атомы водорода замещены органическими группами. В этом классе соединений один или несколько водородных атомов могут быть замещены на углеводородные радикалы.
Отличительным признаком этих соединений является присутствие такого фрагмента, как R–N Номенклатура аминов
Также в составлении названия, правила допускают брать за основу углеводород, который можно рассматривать, как замену аминогруппы. Здесь положение аминов принято указывать благодаря числовому индексу.
Давайте рассмотрим, как это будет выглядеть в записи:
![]()
Это читается, как 3-аминопентан. В нем числовые индексы, которые расположены вверху указывают порядок нумерации атомов С. В некоторых случаях для определенных аминов сохранились упрощенные названия:
С6Н5NH2 – анилин, хотя, если следовать правилам номенклатуры, то он называется фениламином.
Также в химии часто используют устоявшиеся названия, которые искажают правильные наименования. Так, например:
Н2NСН2СН2ОН – моноэтаноламин, хотя правильно будет называть 2-аминоэтанол;
(ОНСН2СН2)2NH – диэтаноламин, а если использовать правильное название, то это будет звучать, как:
Физические свойства аминов
А теперь давайте рассмотрим физические свойства аминов. Первыми представителями ряда аминов являются метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2. Весь этот ряд аминов являются газами, которые имеют запах аммиака.
Средние члены этого ряда, при увеличении количества атомов в R, превращаются в жидкости. А высшие амины, при увеличении длины цепи R до 10 атомов С кристаллизируются и превращаются в твердые вещества.
А также следует знать, что в высших аминах запах практически отсутствует.
Как мы уже говорили, что простейшие амины имеют резкий запах аммиака и хорошо растворяются в воде. К более сложным аминам относится жидкость, которая имеет запах рыбы.
А вот высшие амины являются твердыми веществами, которые совсем не растворяются в воде и запаха они практически не имеют. Растворимость аминов идет на убыль при увеличении длины цепи и возрастании количества органических групп. То есть, чем выше их молекулярная масса, тем хуже их растворимость в воде.
Химические свойства аминов
А теперь приступим к рассмотрению химических свойств аминов:
Как правило, общими свойствами органических соединения является их способность к горению. Если сравнивать способность горения аммиака с аминами, то первый горит, но его сложно поджечь. А вот амины имеют свойство легко загораться, и при горении их пламя чаще всего бывает бесцветным.
Нахождение аминов в природе
Соединения аминов широко распространены как в растительном, так и в животном мире, а также являются такими биологически активными веществами, как витамины, гормоны, промежуточные продукты обмена веществ.
Из-за этого неприятного запаха низшие амины часто путали с аммиаком. Но французский химик Шарль Вюрц в 1849 году обратил внимание на различие между аминами и аммиаком. Оказывается, вся разница в том, что амины обладают способностью к горению на воздухе и при этом образуют углекислый газ.
Применение аминов
Ну а теперь давайте узнаем, где применяются амины? Оказывается, амины нашли широкое применение при изготовлении лекарственных веществ, производстве различных красителей, взрывчатых веществ, а также продуктов, применяемых в органическом синтезе.
Вредное воздействие
Но также, следует знать, что амины – это вещества, которые довольно таки токсичны. Они представляют опасность при вдыхании их паров, а также при контакте с кожным покровом. А такие амины, как, например, анилин, обладает способностью проникновения через кожу в кровь и может нарушить функции гемоглобина, и тем самым привести к летальному исходу.
При попадании аминов в кровь появляются такие симптомы, как одышка, посинение губ, носа и кончиков пальцев. Также при отравлении наблюдается учащенное дыхание и сердцебиение. А в некоторых случаях может дойти и до потери сознания.
В случае отравления или попадания амина на незащищенные участки кожи, необходимо как можно быстрее, очистить пораженный участок кожного покрова с помощью спирта и ваты. Но это следует делать очень аккуратно, стараясь не увеличивать пораженные участки кожи. В случае отравления парами аминов, следует сразу же пострадавшему обеспечить доступ к свежему воздуху и вызвать врача.
При отравлении алифатическими аминами может произойти нарушение функций печени, поражение нервной системы и проницаемости кровеносных сосудов.
Вдыхание ароматических аминов может привести к угнетению центральной нервной системы, а также вызвать рак мочевого пузыря.
Практическое задание
Давайте с вами проведем небольшой опыт. Для этого мы берем и наливаем в пробирку 0,5 мл анилина. Теперь возьмем и взболтаем содержимое.
Вопрос: Какую реакцию вы наблюдаете?
А сейчас давайте в эту же пробирку добавим соляную кислоту и понаблюдаем до полного растворения анилина в воде.
А теперь подумайте и ответьте на вопросы:
1. Как вы думаете, почему происходит растворение анилина, после того, как мы добавили соляную кислоту?
2. Запишите эту реакцию в виде уравнения.
3. Попробуйте рассчитать массу вещества, которое образовалось.
4. Решите данную задачу.
Ответьте на вопросы:
1. Назовите известные вам классы органических веществ.
2. Какие азотосодержащие соединения вам известны? Назовите их и запишите их формулы.
3. Как использование аминов на предприятиях влияет на окружающую среду?
4. В чем различие между аммиаком и аминами?
5. Назовите сходные свойства аммиака и аминов.
Читайте также:


