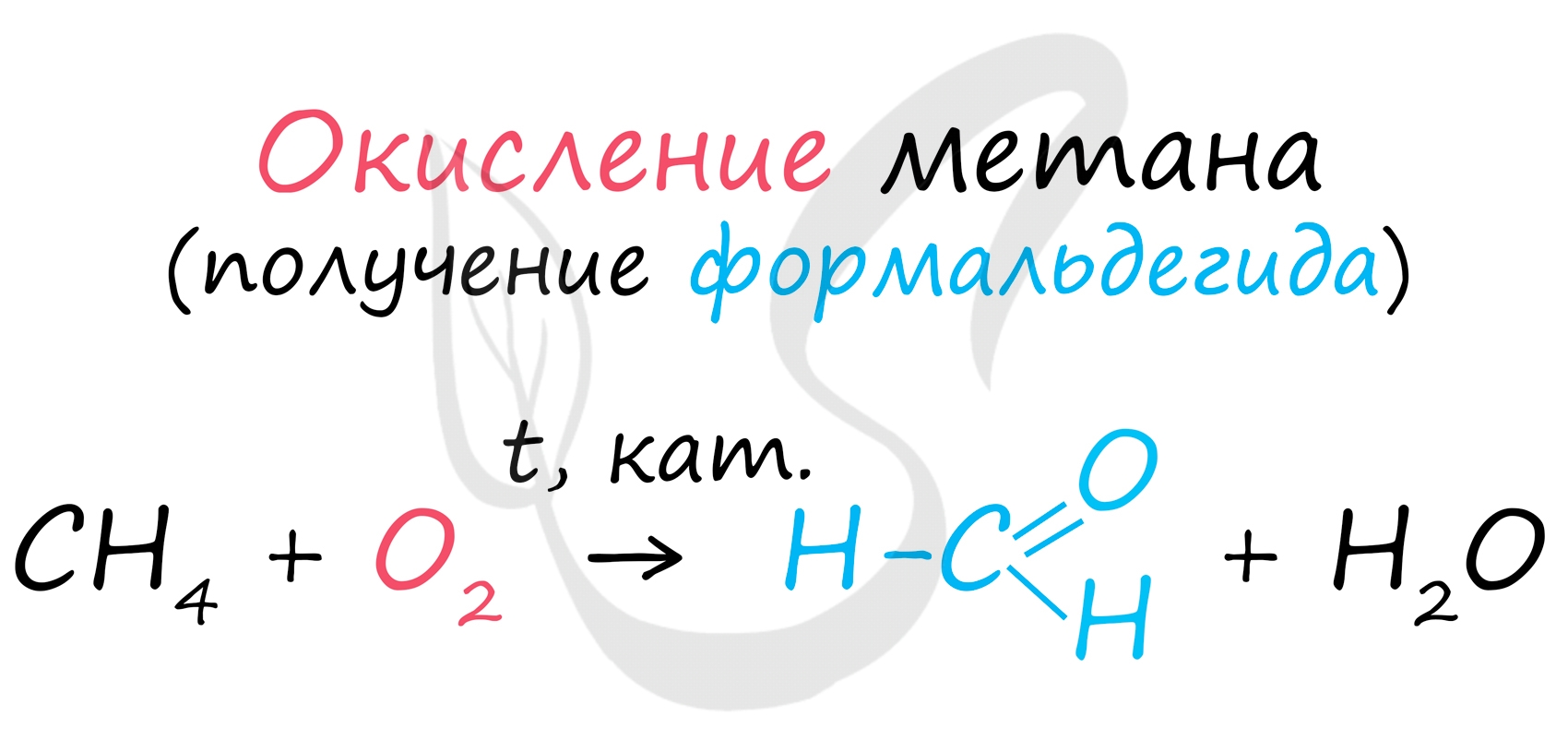Альдегиды интересные факты доклад
Обновлено: 04.07.2024
[С. Полье, Мск] Приготовьтесь, дорогие друзья! Мы с вами окунемся в одну из самых непростых и спорных парфюмерных тем – альдегидные ароматы. Сложные формулы, громоздкие формулировки, многотомные труды – все это про альдегиды можно найти в изобилии. Найти можно, а вот понять - не всегда. Любить духи и быть профессиональным химиком, это далеко не всегда одно и то же. Как же по-простому объяснить, что такое парфюмерные альдегиды? Давайте попробуем разобраться вместе.
- Что такое альдегиды? . 1
- Альдегидная парфюмерия: мифы и реальность . 1
- Случай 1. Альдегиды могут быть натуральными . 1
- Случай 2. Альдегиды напоминают запахи других веществ . 2
- Случай 3. Шанель № 5 – первый в мире альдегидный аромат . 2
- Попутный случай. Неальдегидные альдегиды .. 2
Что такое альдегиды?
В дебрях химии можно отыскать официальное определение альдегидов:
![]()
Несколько формул расхожих веществ
Все понятно? Ок, тогда расходимся :) Но если карбонильные, СНО-содержащие группы звучат для вас, как Шицзячжуанский диалект, давайте максимально упростим. Но сначала договоримся:
- Во-первых, альдегиды вообще и альдегиды, как парфюмерный термин – это не одно и то же. В парфюмерии группа альдегидов представляет собой более сжатое понятие. Если максимально упрощать, а именно это мы и договорились делать в данной статье, то парфюмерные альдегиды должны пахнуть.
- Во-вторых, пройдемся по основным понятиям, которые предлагают нам различные источники, и, определив, что из них является мифом, отставим только правду, что и будет упрощенной версией.
- В-третьих, с научной точки зрения, разные вещества в парфюмерии могут являться альдегидами, но нам, как пользователям ароматов, важно понимать, что подразумевается под этим понятием в описании композиций. Увидели в составе альдегиды, и не вспоминаете химию, а примерно представляете, о чем идут речь.
Завершающий пункт может быть пока не до конца понятным, но просто запомните его, далее все встанет на свои места.
Альдегидная парфюмерия: мифы и реальность
Сразу окунемся в предлагаемые различными источниками описания. Чисто химическую сторону мы уже вкратце задели, более к ней возвращаться не будем. Разговор пойдет исключительно в парфюмерном контексте.
Случай 1. Альдегиды могут быть натуральными
![стручки ванили]()
Соответственно, натуральные вещества скорее всего не будут указаны в пирамидке как альдегиды. Для этого будет применено более расхожее и узнаваемое название.
Случай 2. Альдегиды напоминают запахи других веществ
![клоп вонючка]()
Клоп, в выделяемом секрете которого содержится (E)-2-деценаль
Случай 3. Шанель № 5 – первый в мире альдегидный аромат
Chanel №5 – это шедевр. Уже тем, сколько лет он производится (с 1921 года), оставаясь на пике популярности, он заслужил памятник. И, разумеется, Шанель №5 – альдегидные духи, вероятно, самые известные альдегидные духи. Но этот парфюм, созданный коренным москвичом Эрнестом Бо, не является первым из альдегидных.
![шанель номер пять]()
![Букет Наполеона]()
"Букет Наполеона", 1912 год
Попутный случай. Неальдегидные альдегиды
Дело было в начале ХХ века. Во всем мире парфюмеры судорожно занимались синтезированием различных веществ. В первую очередь альдегидов, по причинам нахождения их в тренде. Где исследования и эксперименты пересекаются с коммерцией, там и шпионаж, кража идей и прочие ерундовины.
Нужны ли были такие сложности? По всей видимости, да. По крайней мере изобретение Жукова и Шесткова уже в 1919 году был использован не абы где, а в культовом Guerlain Mitsouko. Кстати, если посмотрите на его пирамидку, то никаких альдегидов не увидите – в составе указан персик. Это возвращает нас к двум первым случаям.
Альдегиды в парфюмерии – что это? Чем пахнут?
Итак, взяв массив заумных формулировок и мифов, сложившихся вокруг альдегидных духов, мы отсекли все лишнее, и можем теперь создать более понятную формулировку. Это понятие будет нарушать все возможные законы химии, она приведет в ужас людей, возомнивших себя специалистами, но поможет новичкам легко разобраться в том, что же такое альдегидная группа парфюмерии.
Альдегиды в парфюмерии – это вещества, которые и сами по себе, но чаще в совокупности, создают запахи, не существующие в природе. Либо оттенки известных запахов, но так же не свойственные природным. В результате, вещества позволяют создавать в альдегидном семействе парфюмерии наиболее уникальные и оригинальные композиции.
Конечно, создавать запахи, не имеющие аналогов в природе, могут далеко не только альдегиды. Но именно они чаще всего используются с этой целью в парфюмерном производстве.
Наиболее часто можно встретить такие вещества:
Альдегид Запахи, которые получают с его помощью Мирценаль Цветочные насыщенные Фенилацетальдегид Легкие, весенние цветочные Додеканаль Хвойные ноты Пропаналь Сладкая сочность Нональ Роза Гептаналь Зеленые ноты Октаналь Цитрусовые Деканаль Цитрусово-цветочные Лауриловый альдегид Сирень с фиалкой Бензальдегид Горький миндаль, но при дальнейшей обработке может превратиться в запах жасмина Лилиал Ландыш Примеры альдегидных композиций
Вспоминать еще раз Шанель №5 не будем. Обратим внимание на другие хиты из данной группы парфюмерии.
Конечно, это лишь капля в море альдегидной группы, но очевидно, что практически все старички выпускаются до сих пор, т.е. именно в этом семействе можно создать особых долгожителей. Желающие увидеть все ароматы данной группы могут просто нажать на кнопку:
При использовании материалов гиперссылка на сайт ОБЯЗАТЕЛЬНА!
Все экспертные оценки являются субъективными мнениями авторов. Все фото кликабельны.
![Альдегиды]()
Альдегиды представляют собой органические соединения, в которых углерод имеет двойную связь с кислородом и одинарную с водородом либо атомом, который имеет обозначение R в структурных схемах. Многие из альдегидов обладают приятным запахом, вследствие чего находят активное применение в разных промышленных целях. Получают альдегиды из спиртов путем их дегидрирования. Об их физических и химических свойствах, применении и получении наша сегодняшняя статья.
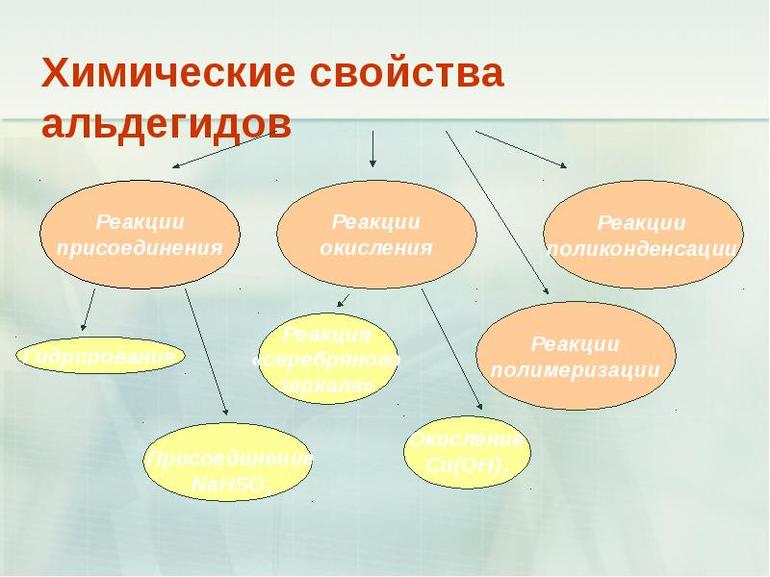
Химические свойства
Практически все альдегиды способны вступать в разнообразные химические реакции, включая полимеризацию. Сочетание их с другими видами молекул ведет к созданию так званных конденсационных полимеров, которые активно используются, например, при производстве пластмассы, в качестве растворителей и парфюмерных ингредиентов.
А некоторые альдегиды даже принимают активное участие в физиологических процессах, так они являются частью:
- витамина А, очень важного для зрения,
- пиридоксальфосфата – одной из форм витамина В6,
- глюкозы и прочих редуцированных сахаров,
- некоторых природных и синтетических гормонов.
Важным отличием альдегидов от тех же углеродов является наличие у них карбонильной группы. Карбонильная группа эта изначально полярна, то есть электроны образующие связь С=О притягиваются больше к кислороду, нежели к углероду. Благодаря этому первый из электронов получает отрицательный заряд, а второй положительный.
![Альдегиды]()
Также стоит заметить, что альдегиды имеют более высокий дипольный момент по сравнению с остальными углеводородными соединениями.
Физические свойства
Температура кипения альдегидов и их плавления гораздо выше у карбонилсодержащих соединений, нежели у просто состоящих из углерода и водорода. К примеру, бутан и ацетон имея одинаковую молекулярную массу, закипают очень по разному: бутан закипает уже при 0 С, в то время как ацетону для кипения необходимо уже +56 С.
В отличие от углеводородов альдегиды способны растворятся в воде, но не все, а только имеющие менее пяти атомов углерода в молекуле. Но если углеводородная часть их молекул выше этого числа, это делает их нерастворимыми в воде.
Структура
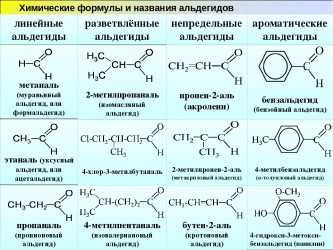
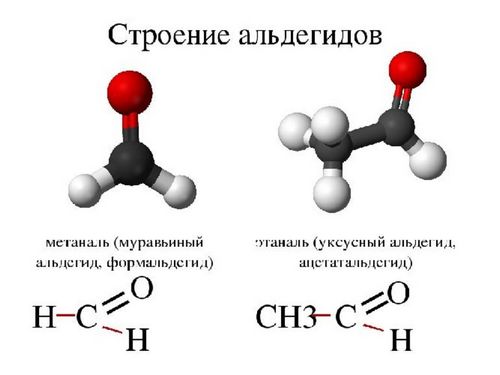
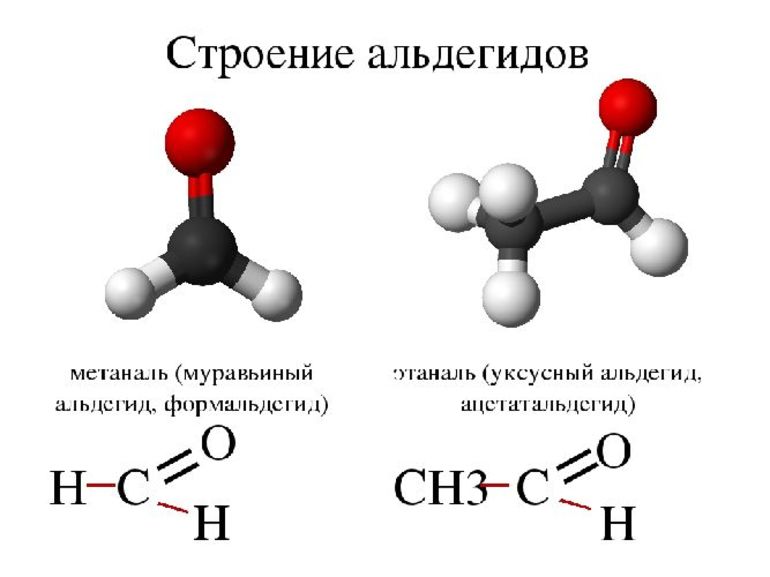
Формальгид – простейший альдегид, имеет молекулу, связанную с двумя атомами водорода. У всех других альдегидов молекулы связаны лишь с одним атомом водорода.
Углерод, связанный с карбонильной группой может быть частью алкильных либо неалкильных групп, они в свою очередь могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения, обладающие двумя альдегидными группами называются диальдегидами.
![Структура альдегидов]()
Номенклатура
Есть два способа наименования альдегидов. Один из них основан на системе, разработанной Международным союзом теоретической и прикладной химии, его еще называют систематической номенклатурой. Он предполагает использовать в качестве исходного алкана самую длинную цепь атомов углерода, содержащую карбонильную группу в качестве исходного алкана. Числовое определение исходной карбонильной группы при этом использовать не принято, так как она всегда находится в конце родительской цепи. Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
Другой метод представляет собой общую номенклатуру. Принцип общей номенклатуры заключается в том, чтобы называть соединения по общему наименованию соответствующей карбоновой кислоты. Иными словами структура та же, что и у альдегида, только вместо CHO появляется COOH, как у уксусной кислоты — CH3COOH или C2H4O2.
Производство
Так как альдегиды одни из ключевых строительных блоков органической химии, то не удивительно, что для их получения и производства существует множество разных методов:
- Окисление. Представляет собой один из основных методов для получения альдегидов. Обычно спирты могут быть окислены до состояния альдегидов. Для этого первичный спирт пропускается через горячий катализатор (гидроксид меди) или через аммиачный раствор оксида серебра (так званая реакция серебряного зеркала). Увы, но этот способ не подходит для маленьких лабораторий.
- Гидроформилирование – еще один способ для получения альдегидов, когда алкены обрабатываются монооксидом углерода, водородом и катализатором на основе переходного металла.
- Один из альдегидов (ацетальдегид) может быть получены путем взаимодействия ацетилена с водой.
Для коммерческого получения альдегидов чаще всего применяют гидроформилирование.
![применение альдегидов]()
Практическое применение
Альдегиды находят многообразное применение в разных сферах человеческой жизни. Сотни их соединений используются химиками для синтеза других веществ. Например, благодаря формальдегиду мы получаем формалин, который в свою очередь активно применяется для дубления, консервации и бальзамирования, а также в качестве фунгицидного и бактериального средства для обработки растений.
Альдегиды, имеющие высокую молекулярную массу (к примеру, бензальдегид и фенилацетальдегид) обладают приятным запахом и поэтому используются в парфюмерии при производстве духов.
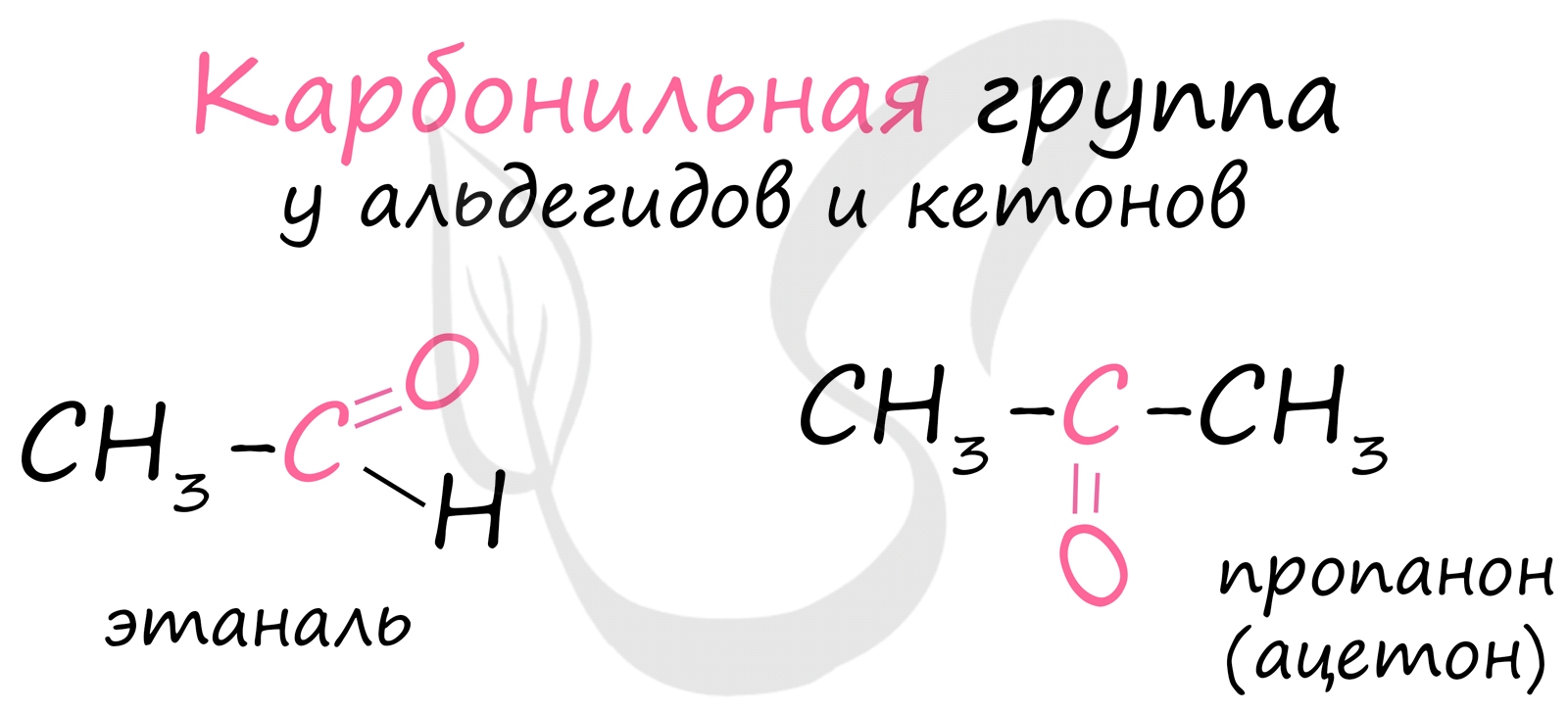
Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
![Карбонильная группа]()
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
![Запах альдегидов]()
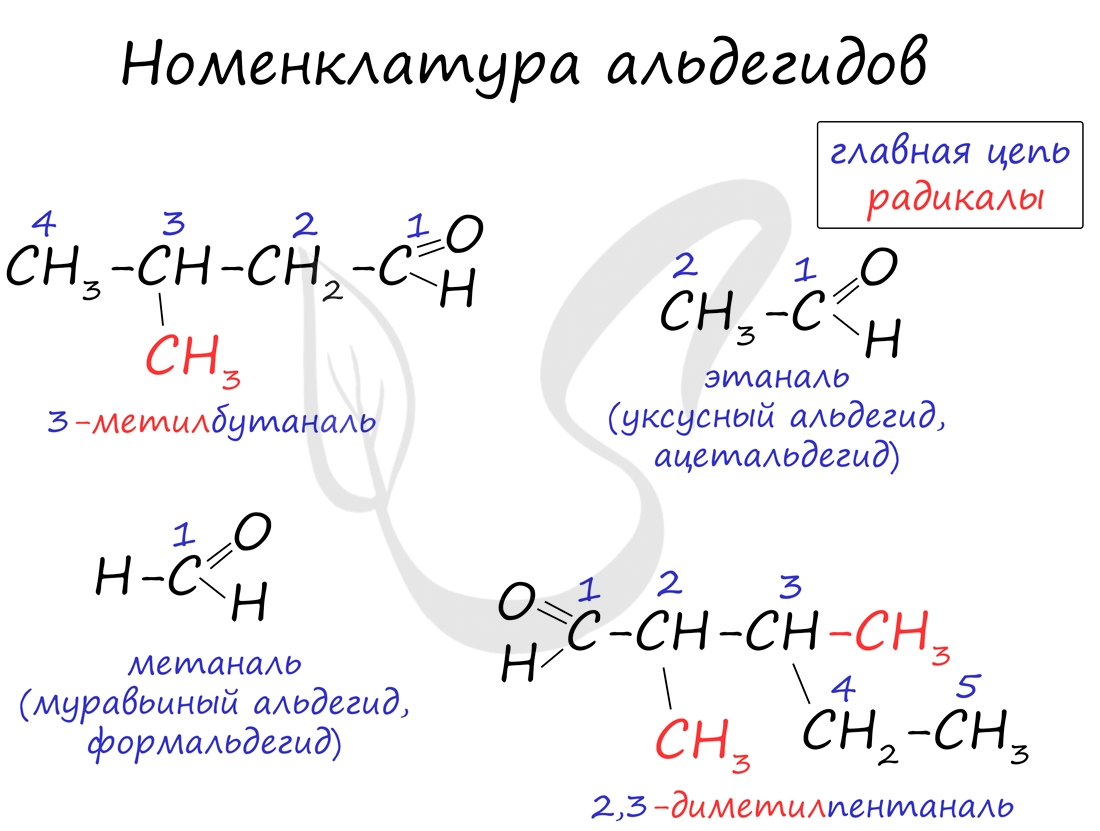
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH3CHO, пропаналь - C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид, этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
![Номенклатура альдегидов]()
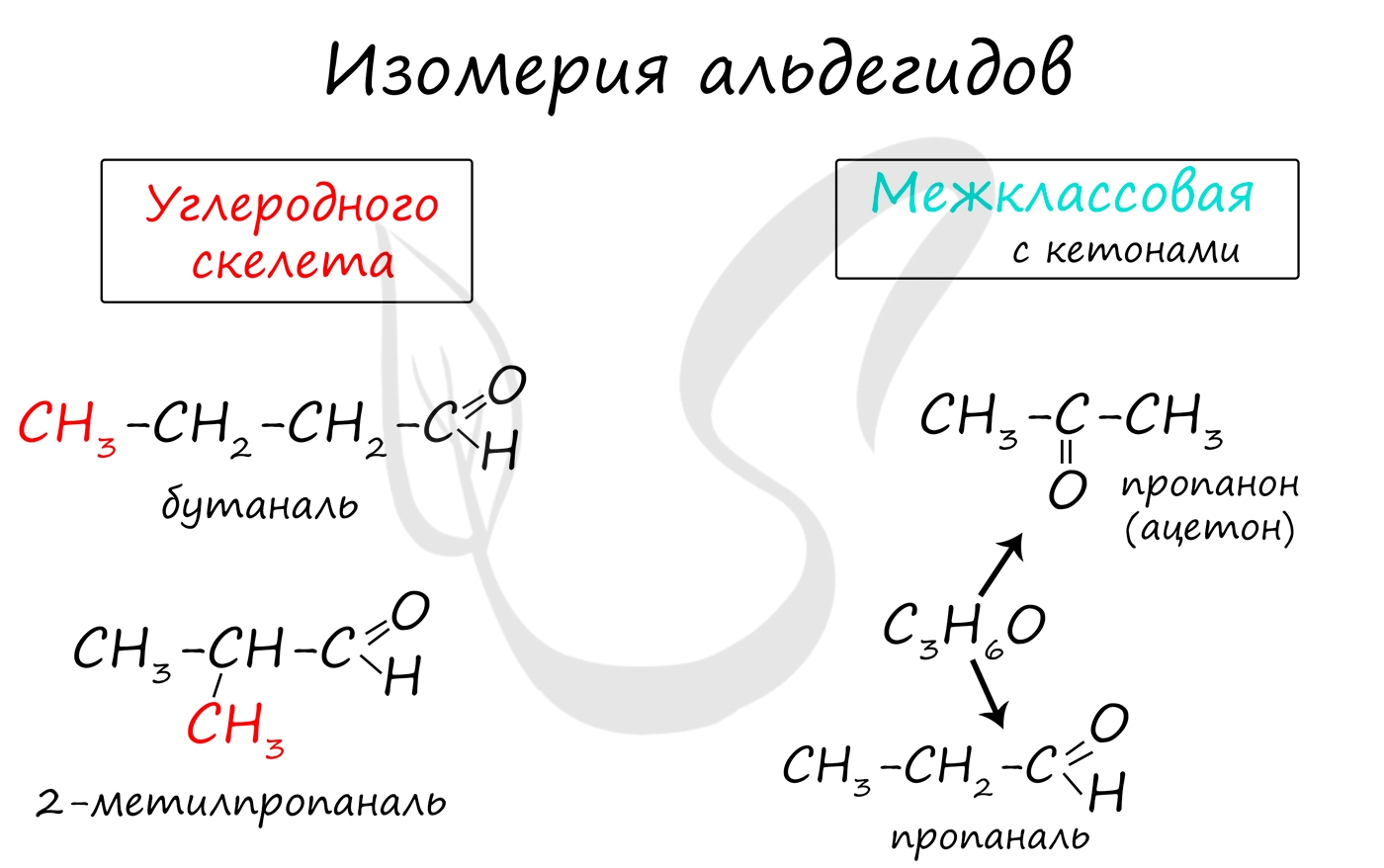
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
![Изомерия альдегидов]()
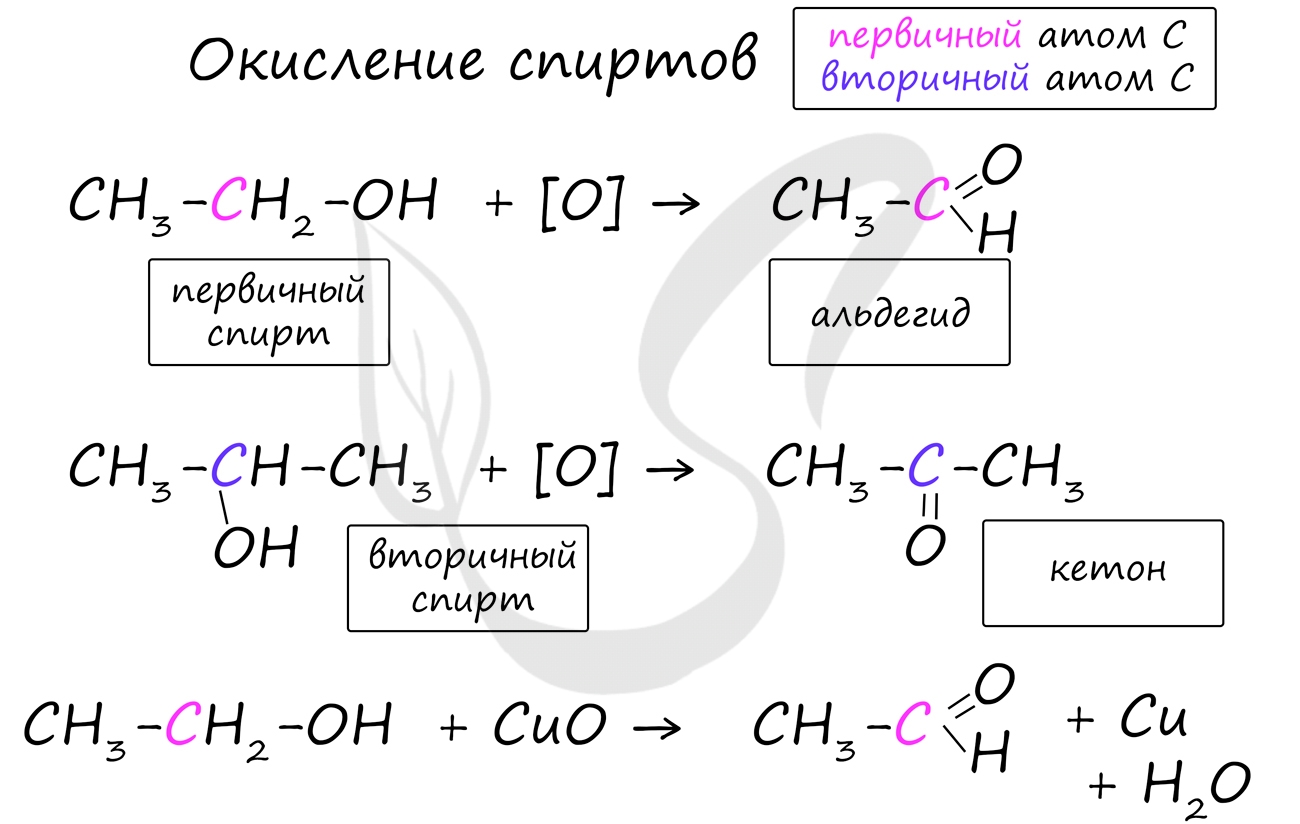
Получение альдегидов и кетонов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов - кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
![Окисление спиртов]()
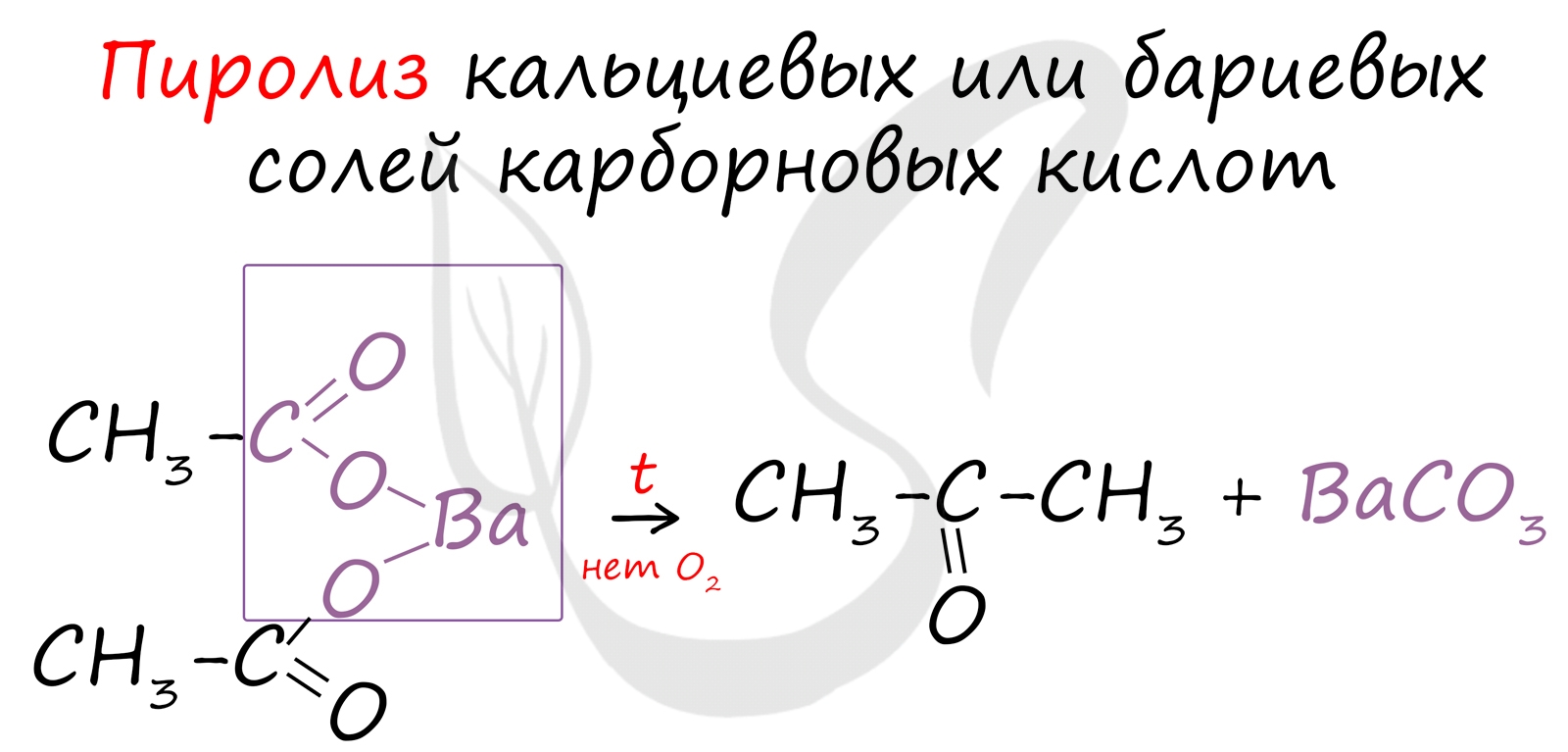
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
![Получение кетонов]()
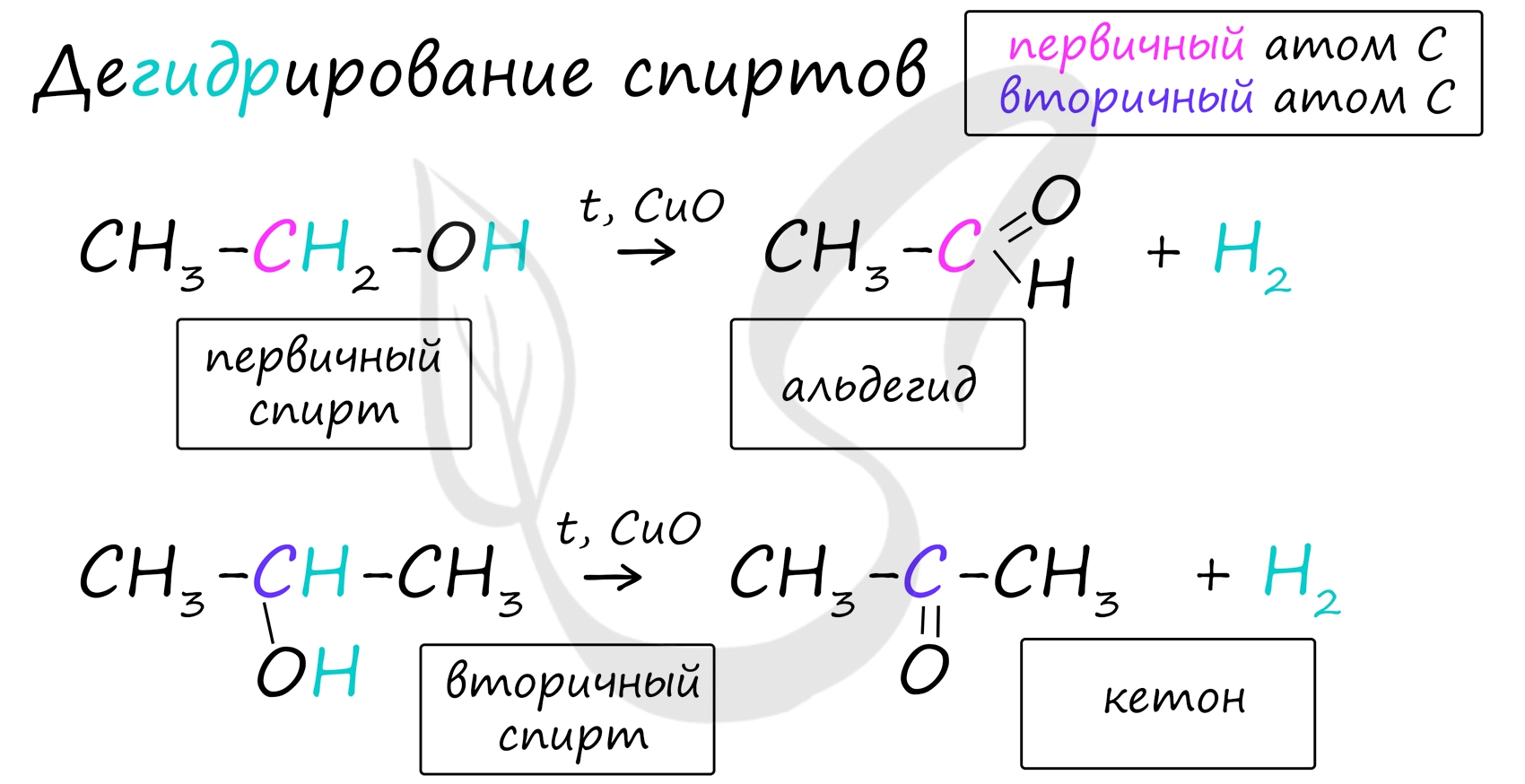
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
![Дегидрирование спиртов]()
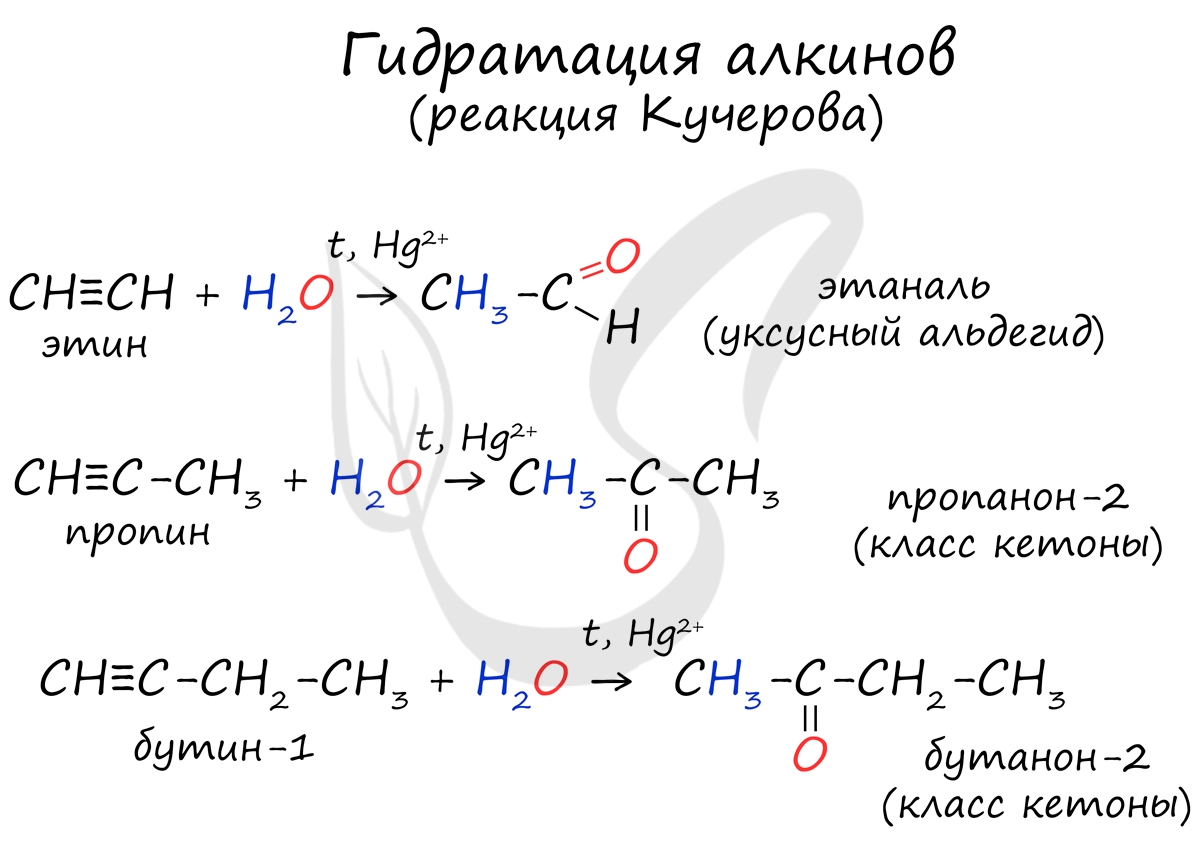
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
![Реакция Кучерова]()
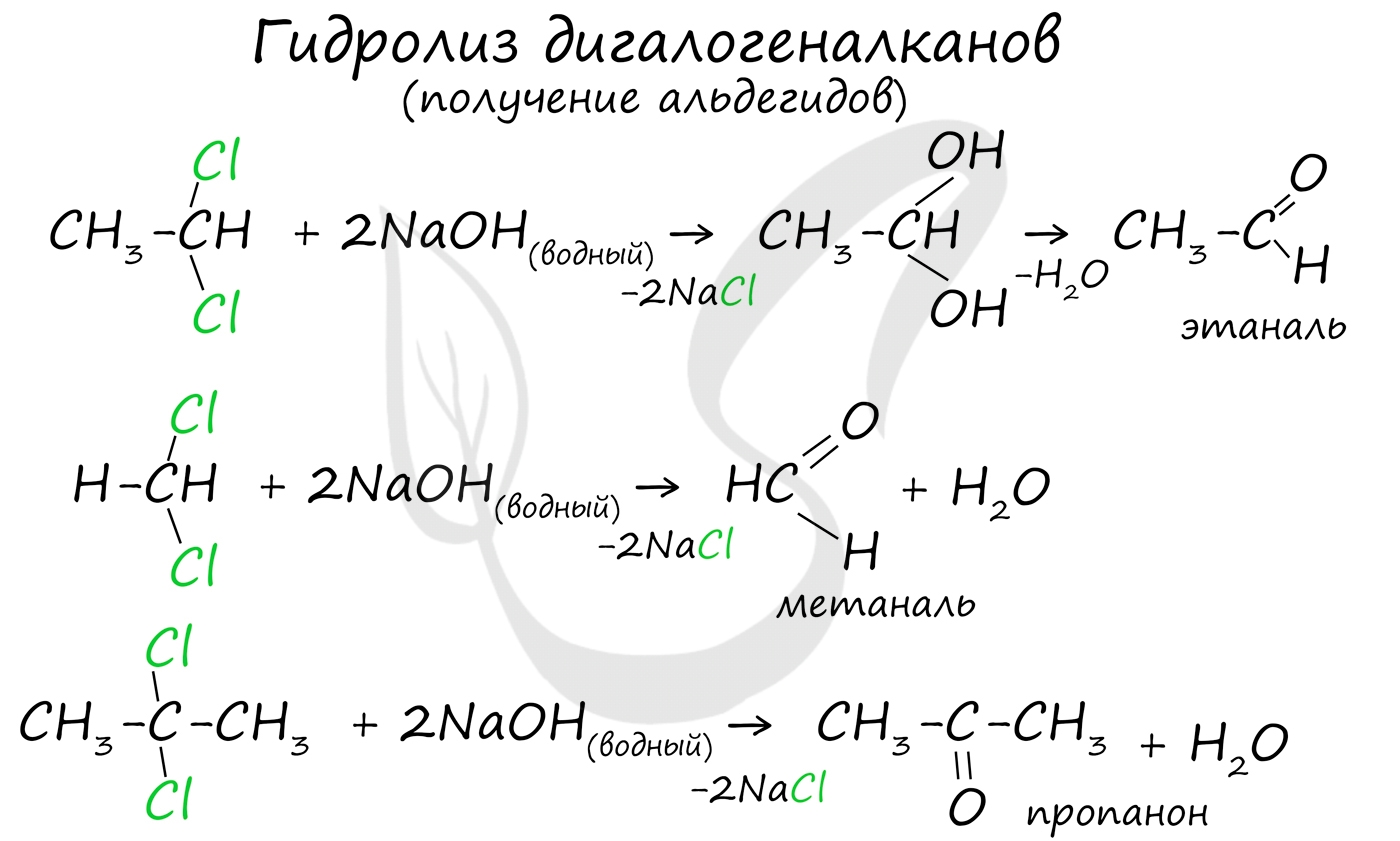
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
![Получение альдегидов гидролизом дигалогеналканов]()
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
![Окисление метана до формальдегида]()
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
![Кумольный способ получения фенола и ацетона]()
Химические свойства альдегидов и кетонов
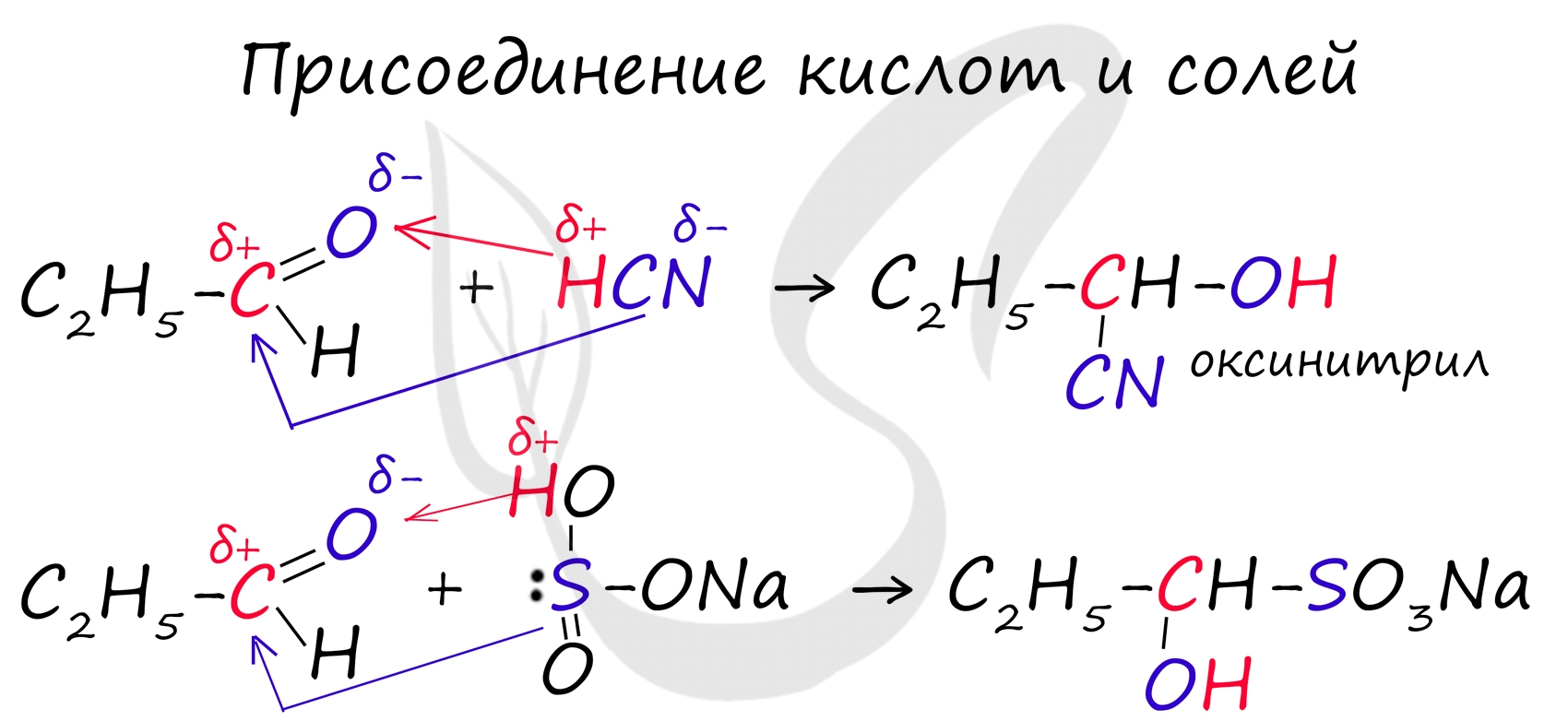
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
![Присоединения к альдегидам кислот и солей]()
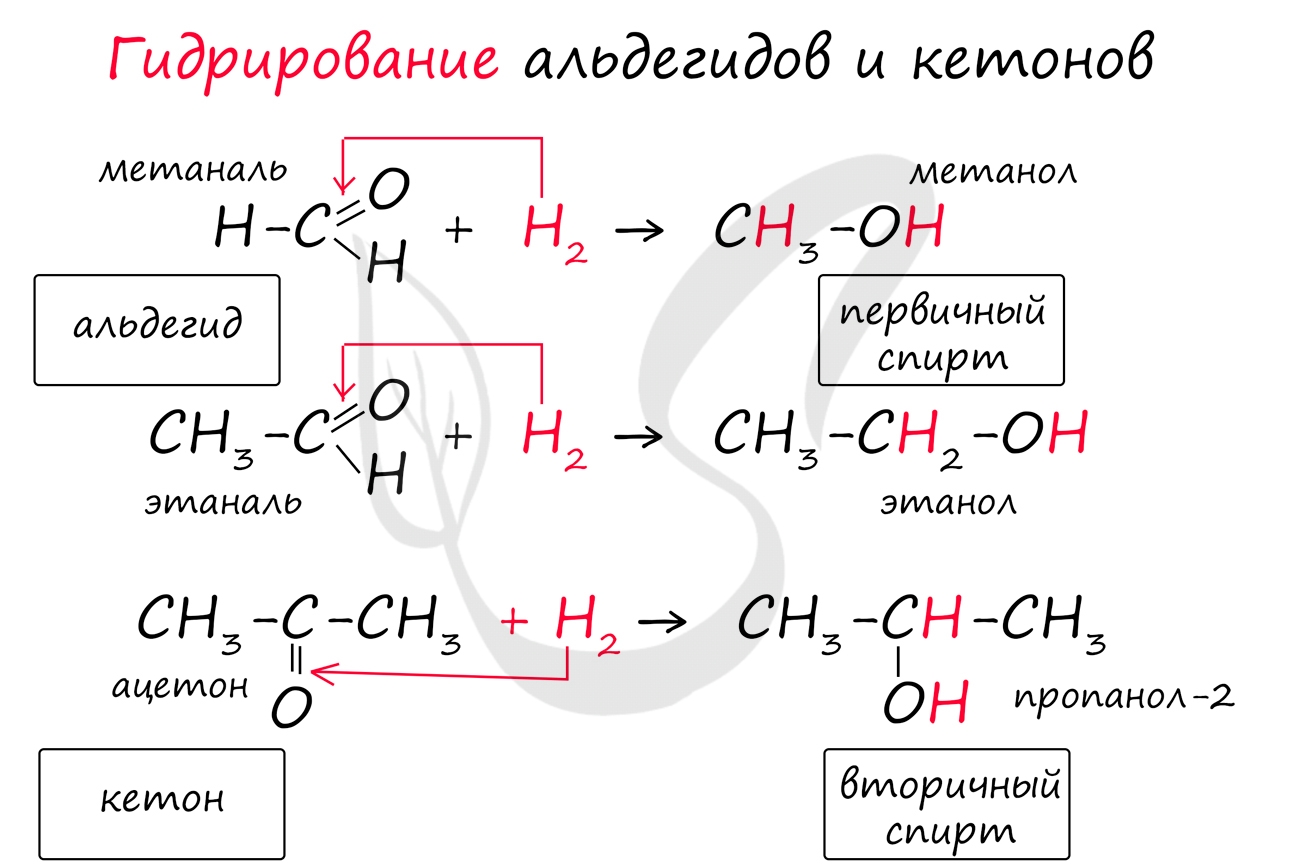
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов - вторичных спиртов.
![Гидрирование альдегидов]()
В результате полного окисления, горения, образуется углекислый газ и вода.
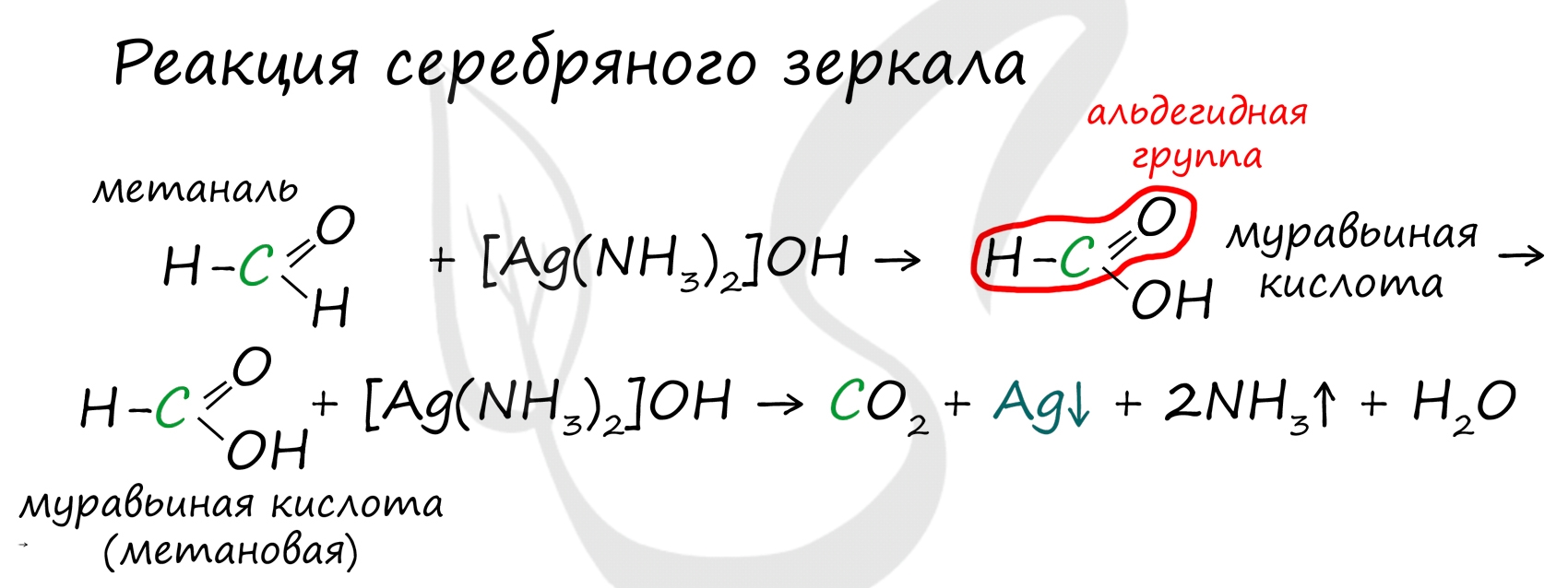
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
![Реакция серебряного зеркала]()
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
![Реакция серебряного зеркала]()
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.
![Реакция серебряного зеркала с метаналем]()
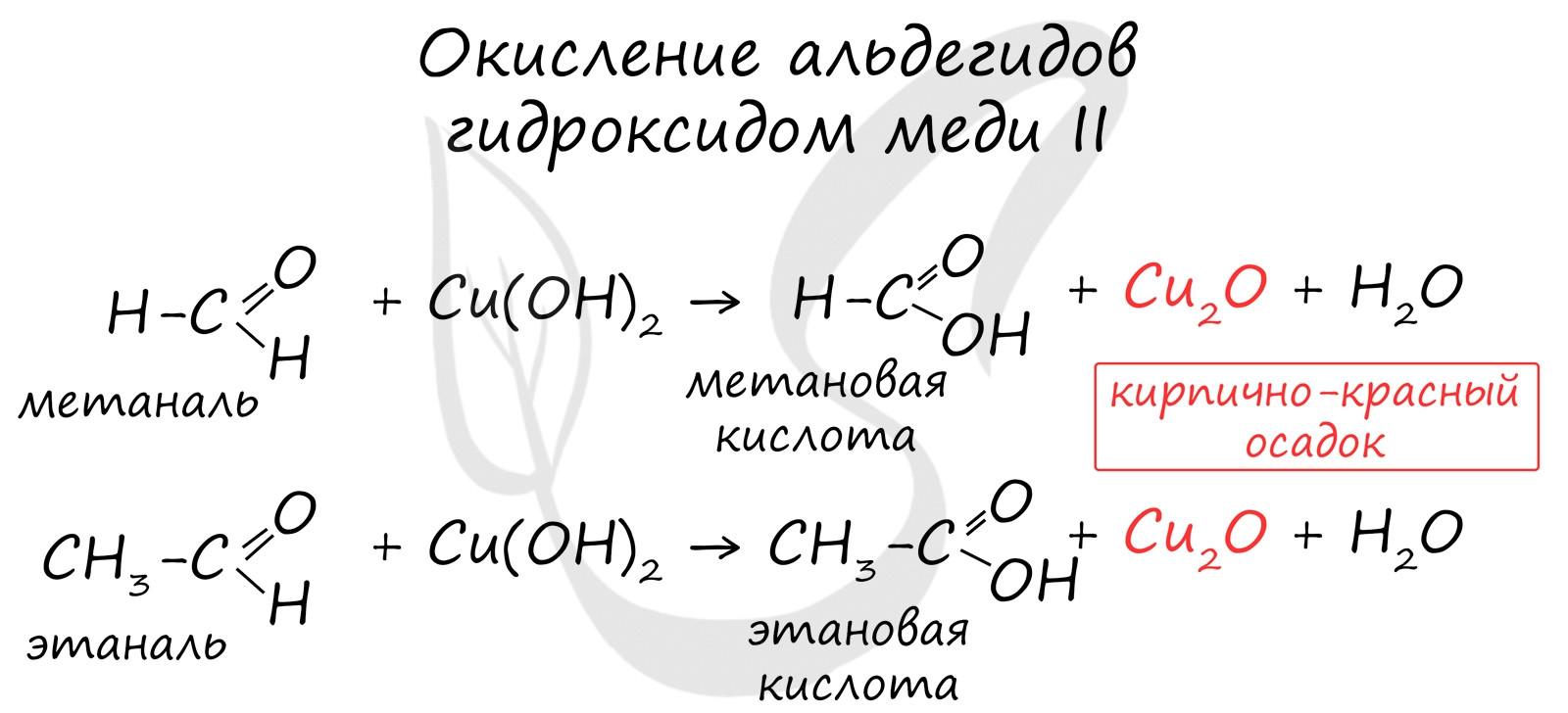
Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
![Окисление альдегидов гидроксидом меди II]()
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Любой представитель класса органических соединений, в котором углерод имеет двойную связь с кислородом, одинарную с водородом или другим атомом, обозначающимся R в структурных схемах, называется альдегидом. Многие из этих веществ имеют приятные запахи, и, в принципе, их получают довольно просто — из спиртов путём дегидрирования для того, чтобы использовать в различных промышленных целях.
![Альдегиды это]()
Полезно знать
- витамина А — важный для человеческого зрения;
- пиридоксальфосфат — одна из форм витамина В6;
- глюкозы и других редуцированных сахаров;
- некоторых природных и синтетических гормонов.
Когда кислород образует двойную связь с углеродом, получается карбонильная функциональная группа (КГ) — СНО. Такое сочетание даёт широкий спектр функциональных возможностей.
Структура и номенклатура
![Из чего состоят альдегиды]()
В формальдегиде, простейшем альдегиде, молекула связана с двумя атомами водорода, а во всех других с одной. Его формула — HCHO, а, например, ацетальдегид выглядит как CH3CHO. Углерод, связанный с КГ, может быть частью алкильных или неалкильных групп, или они могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения с двумя альдегидными группами — диальдегиды. Существует два основных способа именования альдегидов. Первый — основан на системе, используемой Международным союзом теоретической и прикладной химии, и его часто называют систематической номенклатурой. Этот метод предполагает самую длинную цепь атомов углерода, которая содержит карбонильную группу в качестве исходного алкана. При этом не принято использовать числовое определение КГ, поскольку она всегда находится в конце родительской цепи. Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
![Формула альдегидов]()
- по нормам Международного союза соединение будет называться — 2-пропеналь;
- по общей номенклатуре — акролеин (название происходит от акриловой кислоты, родительской карбоновой группы).
К альдегидам относят, например, формальдегид — СН2О (метаналь, муравьиный альдегид), ацетальдегид — C2H4O (этаналь, уксусный альдегид), пропионовый альдегид (пропаналь), бутиральдегид (бутаналь), пентаналь или валериановый альдегид и другие.
Отличительные свойства
Единственное структурное различие между углеводородами и альдегидами заключается в наличии у последней КГ, которая и несёт ответственность за различие в свойствах, как физических, так и химических. Карбонильная группа изначально полярна, то есть электроны, составляющие связь C=O, притягиваются ближе к кислороду, чем к углероду. Это даёт первому частичный отрицательный заряд, а второму — положительный. Важные физические свойства:
![Строение альдегида]()
- Температуры плавления и кипения карбонилсодержащих соединений значительно выше, чем у тех, что состоят только из углерода и водорода. Например, бутан (CH3CH2CH2CH3), пропаналь (CH3CH2CHO) и ацетон (CH3COCH3) имеют одинаковую молекулярную массу, но углеводородный бутан закипает уже при 0 градусов Цельсия, тогда как ацетон только при +56. Ацетальдегид кипит при комнатной температуре, валериановый — при +100,4 градусах Цельсия, а изовалериановый — при +92,5. Другие альдегиды, за исключением высокомолекулярных, в обычных условиях представляют собой жидкости.
- Углеводороды нерастворимы в воде, потому что водные молекулы полярны. Однако альдегиды с менее чем примерно пятью атомами углерода могут растворяться, но углеводородная часть их молекул выше этого числа делает их нерастворимыми.
Промышленное производство
Поскольку эти вещества являются важными строительными блоками в органической химии, они используются для синтеза многих других соединений, поэтому есть много способов их получения.
![Примеры применения альдегида]()
Гидроформилирование является более важным методом для коммерческого применения, где он известен как оксопроцесс, чем для лабораторных синтезов. Оксоальдегиды сами по себе не имеют большого значения в качестве конечных продуктов. Обычно они восстанавливаются до спиртов или окисляются до карбоновых кислот. Оксоспирты используются как сырьё для синтеза моющих средств и текстильных волокон. Оксокарбоновые кислоты превращаются в сложные эфиры и применяются как промышленные или лабораторные растворители.
Где и как используются альдегиды
![Что такое альдегиды]()
Сотни отдельных альдегидных соединений ежедневно используются химиками для синтеза других веществ, но они менее важны в промышленном производстве, то есть в масштабе тонн. Только формальдегид широко используется во всём мире, что определяется общим объёмом используемого химического вещества в год. Получают его путём окисления метанола. В итоге соединение представляет собой газ, но обычно его применяют в виде 37% водного раствора, называемого формалином. Используют его для дубления, консервации и бальзамирования, а также как бактерицидное, фунгицидное и инсектицидного средства для обработки растений. Но наибольшее его применение относится к производству некоторых полимерных материалов. Например, синтетическая смола бакелит образуется во время реакции между формальдегидом и фенолом. Это не просто линейная цепочка, а целая трёхмерная структура. Такие полимеры используются не только как пластмассы, но и чаще всего из них делают клей и различные покрытия. Например, фанера состоит из тонких слоёв дерева, склеенных одним из таких соединений.
Другие альдегиды промышленного значения в основном используют в качестве растворителей, отдушек, ароматизаторов. Они также являются промежуточными продуктами при изготовлении пластмасс, красителей и фармацевтических препаратов. Это паральдегид, гексаналь, гексилкоричный и ортофталевый альдегиды.
- бензальдегид — обеспечивает запах и вкус миндального ореха;
- коричный альдегид, или масло корицы;
- ванилин — основной ароматизатор ванильных бобов.
![Производство альдегидов]()
- Углеводы, включая сахара, крахмал и целлюлозу, которые основаны на соединениях, обладающих альдегидной или кетонной группой наряду с гидроксильной.
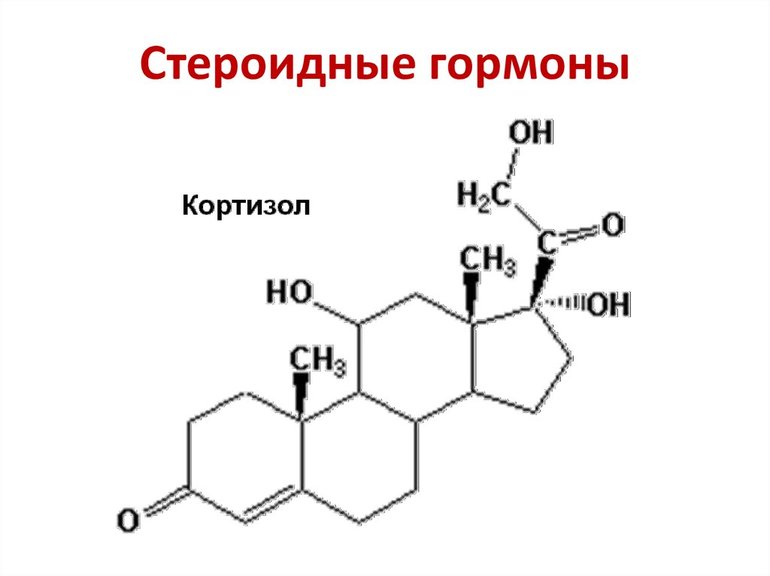
- Стероидные гормоны, многие из которых, в том числе прогестерон, тестостерон, кортизон и альдостерон, являются кетонами.
- Ретиналь альдегид, который после объединения с белком в сетчатке глаза, образующего родопсин, является основным соединением, участвующим в процессе зрения.
Воздействие на человека
Очевидно, что не все альдегидные соединения являются безопасными. Например, ацетальдегид — его молекулы всегда в низких концентрациях циркулируют в человеческой крови. Это вещество — канцероген и может нанести вред организму, а его продолжительное воздействие способно привести к раку и другим тяжёлым системным заболеваниям. Нужно сказать, что ацетальдегид вырабатывается в теле человека в ходе физиологических процессов, но здоровая печень в силах расщепить это вещество до безопасных соединений. Недостаток ацетальдегиддегидрогеназы (специального фермента) приводит к накоплению альдегидов и увеличивает риск развития онкопатологий пищеварительной системы. Внешние источники ацетальдегида:
Читайте также: